Презентация "Классификация и свойства кислот" по химии – проект, доклад
Презентацию на тему "Классификация и свойства кислот" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация и свойства кислот
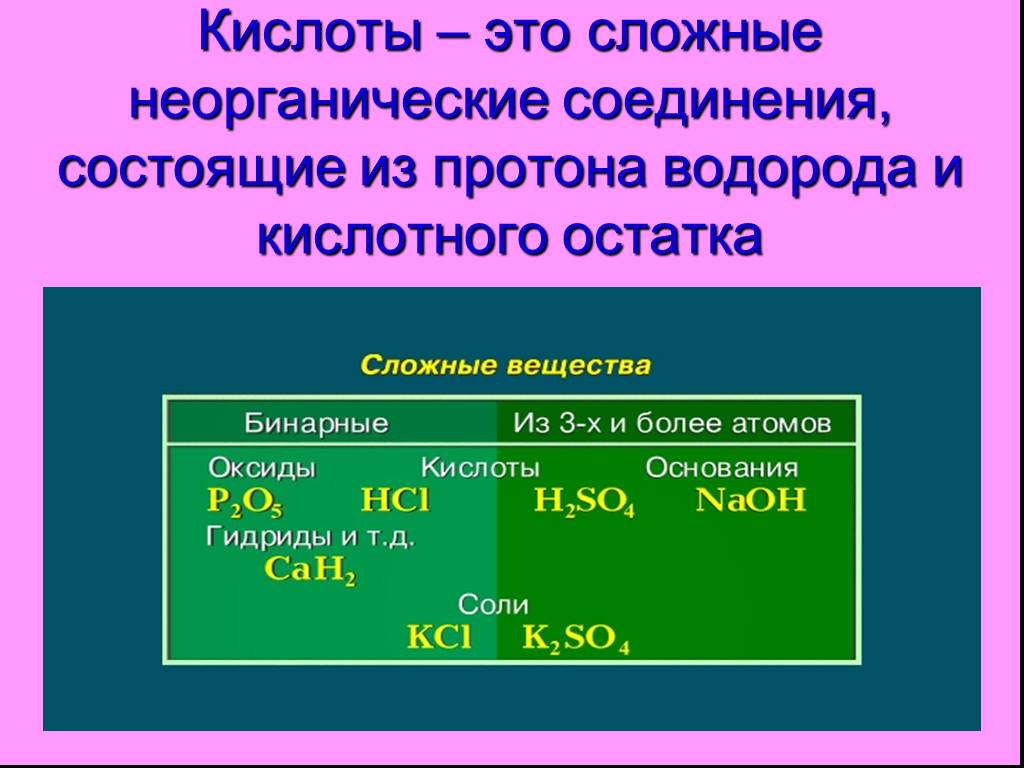
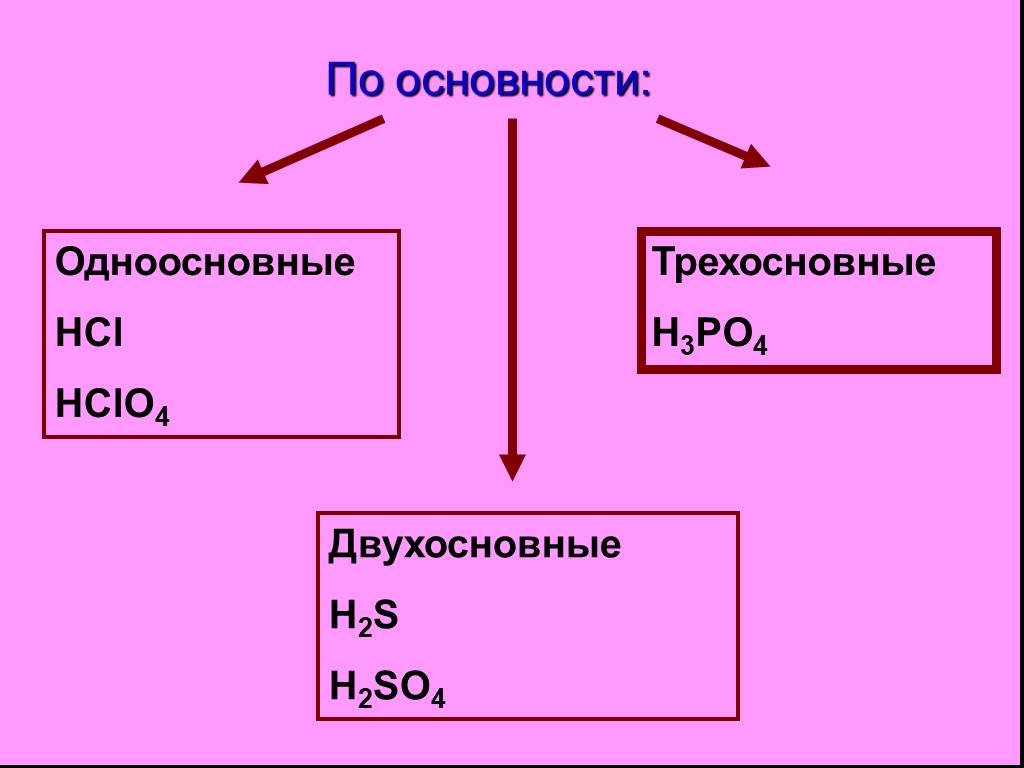
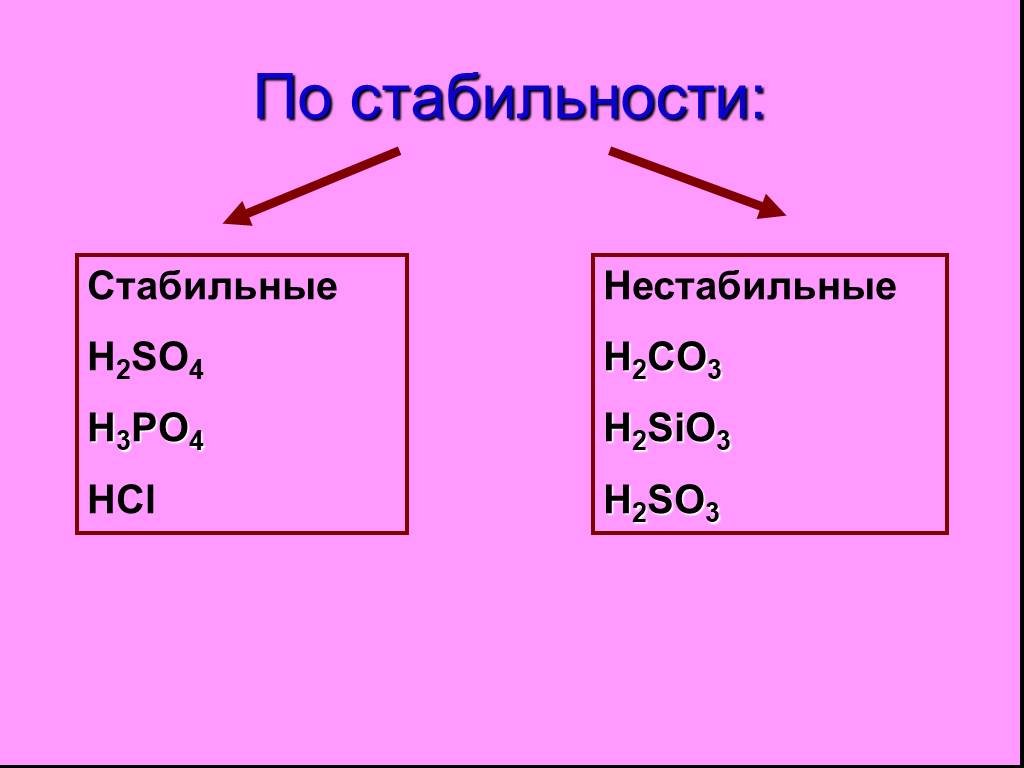
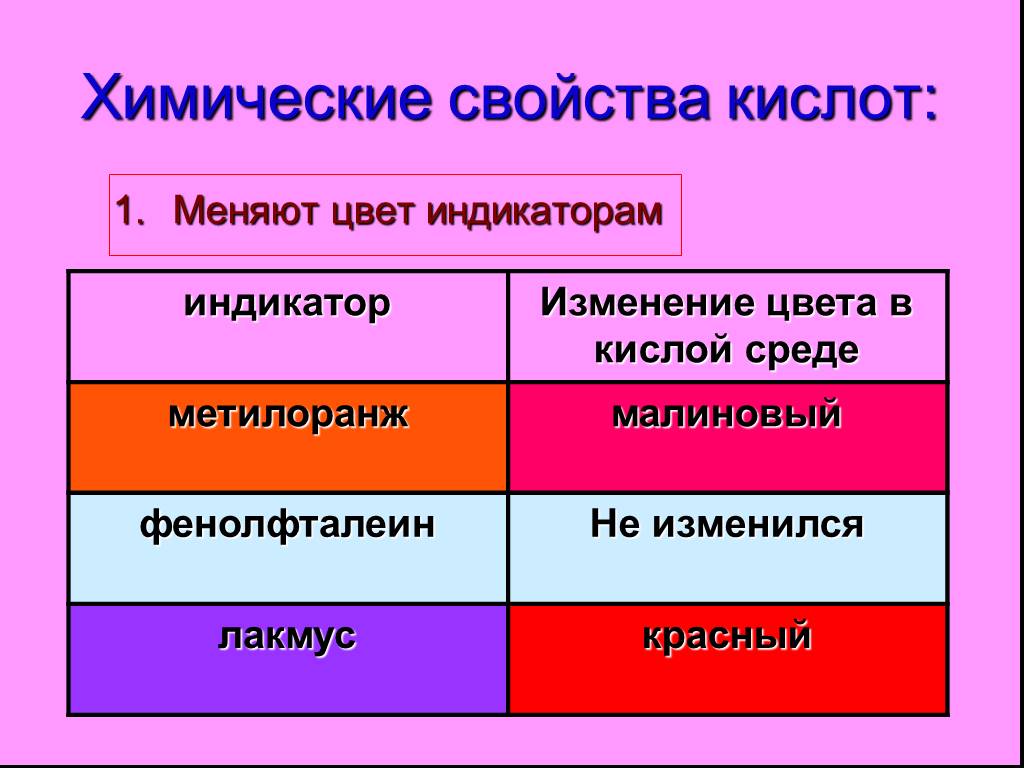
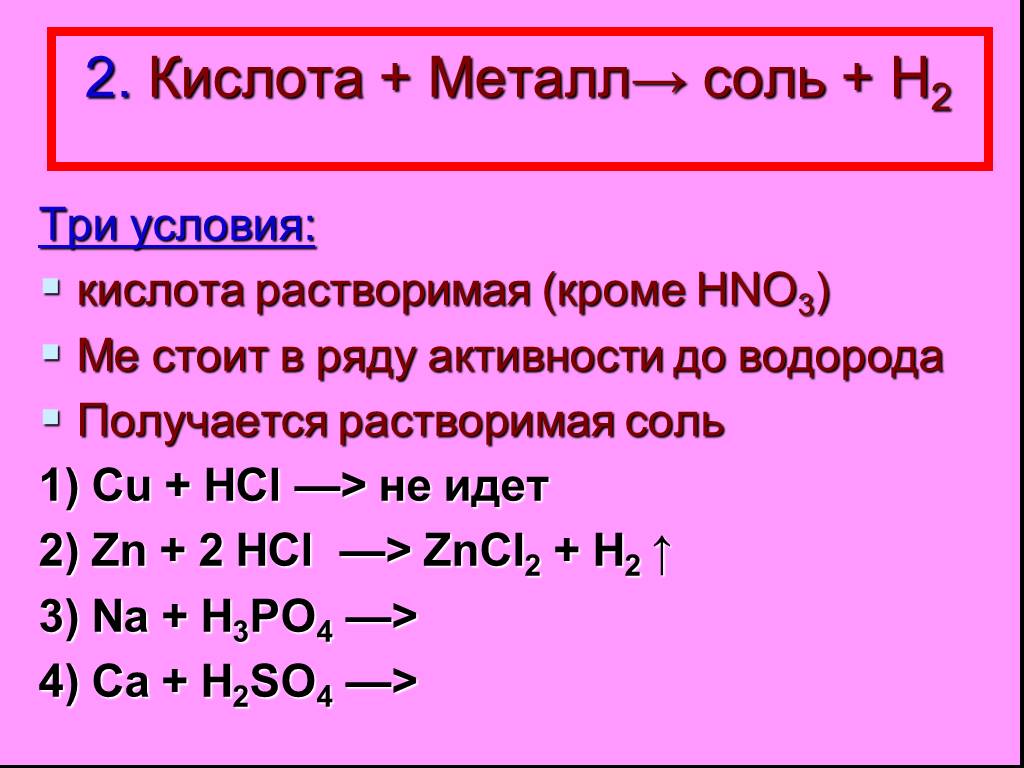
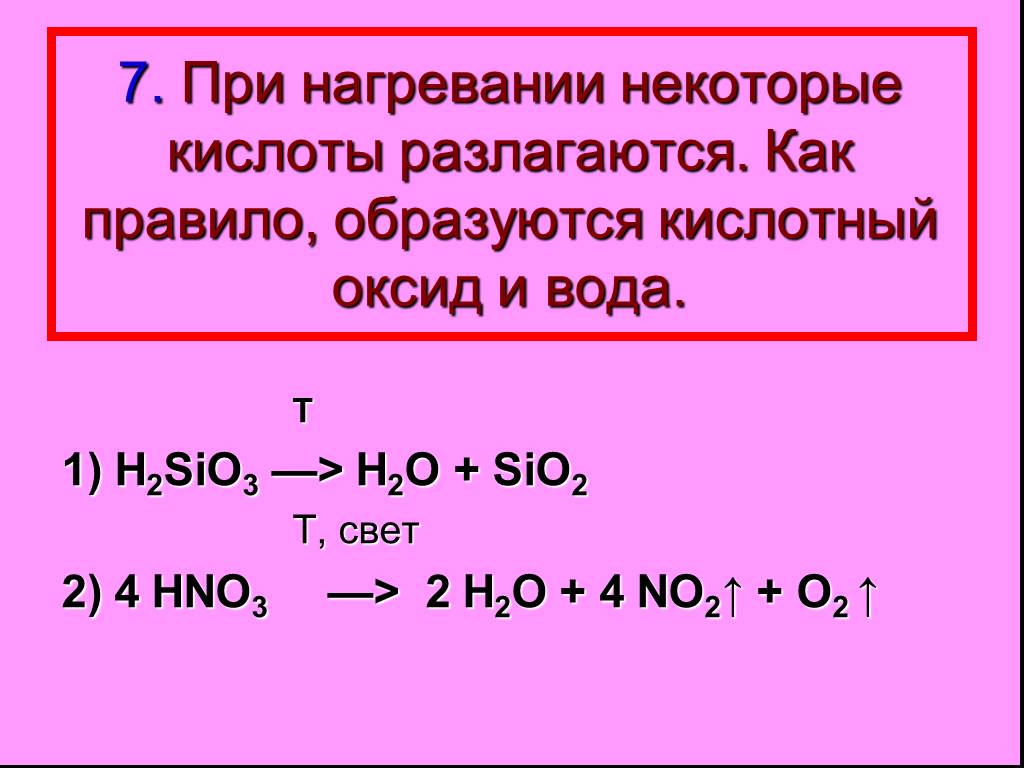
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Окислительные свойства концентрированной серной и азотной кислот
HN⁺⁵O₃ Разб. С активными металлами до Zn. Cr -Pb. C малоактивными металлами. Соль + H₂O + N₂ (N⁻³H₄NO₃). Соль + H₂O + N₂⁺O (N⁺²O). Соль + H₂O + N⁺²O. ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Оксиды, их классификация и свойства
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Классификация сложных неорганических веществ. Кислоты
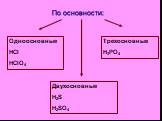
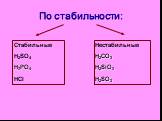
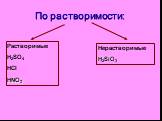
Сложные вещества неорганические органические оксиды кислоты основания соли. дать определение кислотам, рассмотреть состав кислот, классифицировать ...Классификация кислот
Из своего жизненного опыта вы знаете, что многие продукты питания обладают кислым вкусом. Кислый вкус этим продуктам придают кислоты. Кислый вкус ...Аминокислоты и белки: строение и свойства
Аминокислоты. Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. . . . Незаменимые ...Классификация кислот
. . . . . . . ...Классификация химических элементов
Цели урока:. Ознакомление с понятием классификация и её первыми попытками по отношению к химическим элементам; Развитие умения сравнивать химические ...Классификация химических реакций
Химические реакции - это. процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и строению. Классификация. ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Классификация полимеров
Полимеры - вещества, молекулы которых состоят из большого числа повторяющихся группировок, соединенных между собой химическими связями Высокомолекулярные ...Классификация органических соединений
II Наличие в молекуле функциональной группы. Виды изомерии. Объект воздействия на реагент. БЛАГОДАРЮ ЗА ВНИМАНИЕ. ...Классификация неорганических веществ
Цель урока. Закрепить знания по теме «неорганические классы веществ»; Продолжить развивать навыки написания химических уравнений реакций. План урока. ...Окислительно-восстановительные свойства соединений хрома в различных средах
Цель урока:. Сформировать понятие о зависимости свойств соединений хрома от степени окисления элемента через организацию исследовательской деятельности ...Белки. Строение и свойства
Белки. Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот представляющие собой биополимер, состоящий из мономеров, ...Белки, свойства и характеристики
Белок – высокомолекулярное органическое вещество, состоящее из аминокислот, соединённых в цепочку пептидной связью. Функции белков. Аминокислоты. ...Конспекты
Кислоты, их классификация и свойства
Муниципальное образование Новокубанский район. . муниципальное общеобразовательное бюджетное учреждение основная общеобразовательная школа № 21 х. ...Кислоты, их классификация и свойства
. МАОУ «Голышмановская средняя общеобразовательная школа №2». Урок химии в 8 классе. Кислоты, их классификация и свойства. ...Кислоты: классификация, номенклатура, физические и химические свойства
Химия 8 класс. Тема урока:. . Кислоты: классификация, номенклатура, физические и химические свойства. «Всё познаётся в сравнении». Цель урока:. ...Кислоты, их состав, классификация, общие свойства
Информационный план-проспект урока. №. . Описание. . . . Тип урока. . Урок изучения нового материала с использованием химического ...Кислоты. Классификация. Химические свойства с точки зрения электролитической диссоциации
8 класс. . . Урок-игра «Химическое лукошко» по теме «Урок-упражнение по теме «Кислоты. Классификация. Химические свойства с точки зрения электролитической ...Кислоты: состав, номенклатура, классификация, свойства, получение. Индикаторы. Реакция нейтрализации. Понятие о кислотных дождях
Урок химии в 8 классе. Тема:. Кислоты: состав, номенклатура, классификация, свойства, получение. Индикаторы. Реакция нейтрализации. Понятие о кислотных ...Кислоты органические и неорганические. Классификация и общие свойства кислот
Конспект открытого урока химии в 11 классе. «Кислоты органические и неорганические. Классификация и общие свойства кислот». Тема урока. Кислоты. ...Кислоты. Состав. Классификация. Физические свойства
Методическая разработка. . урока химии в 8 классе на тему:. «Кислоты. Состав. Классификация. Физические свойства». Подготовил и провёл:. ...Азотная кислота: состав молекулы, физические и хими- ческие свойства
Урок по химии разработан к учебнику И. И. Новошинского, Н. С. Новошинской. Технология критического мышления. Тема урока:. «Азотная кислота: состав ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:16 марта 2019
Категория:Химия
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию