Презентация "Классификация кислот" по химии – проект, доклад
Презентацию на тему "Классификация кислот" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
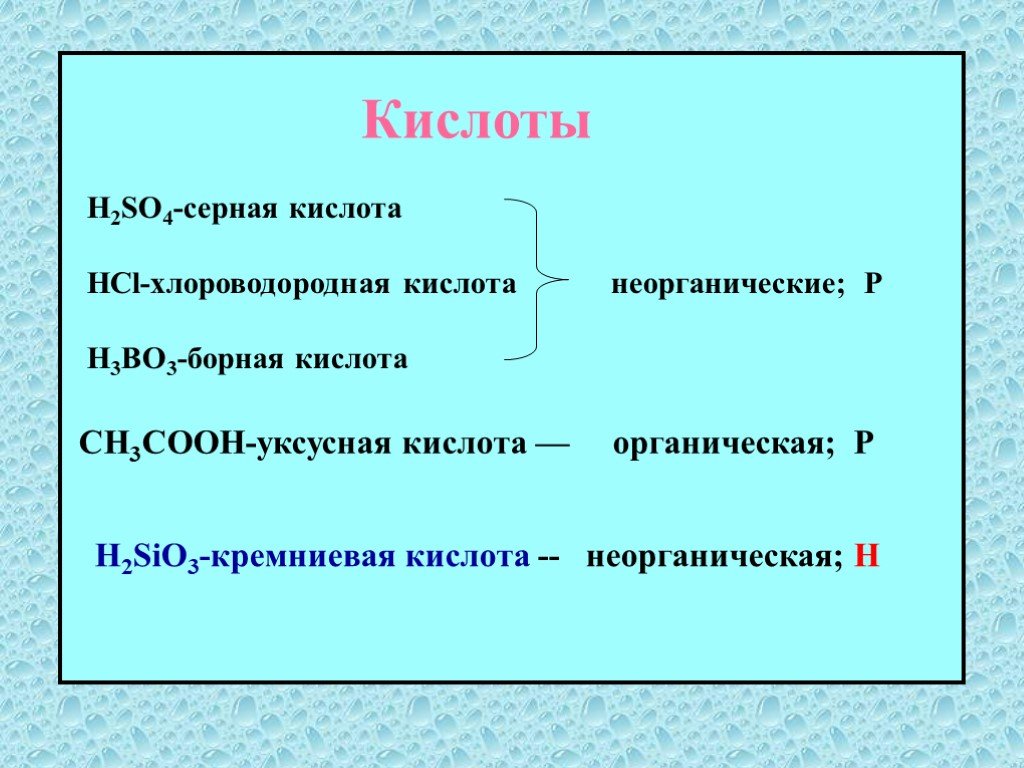
Классификация кислот
. . . . . . . ...Классификация сложных неорганических веществ. Кислоты
Сложные вещества неорганические органические оксиды кислоты основания соли. дать определение кислотам, рассмотреть состав кислот, классифицировать ...Классификация и свойства кислот
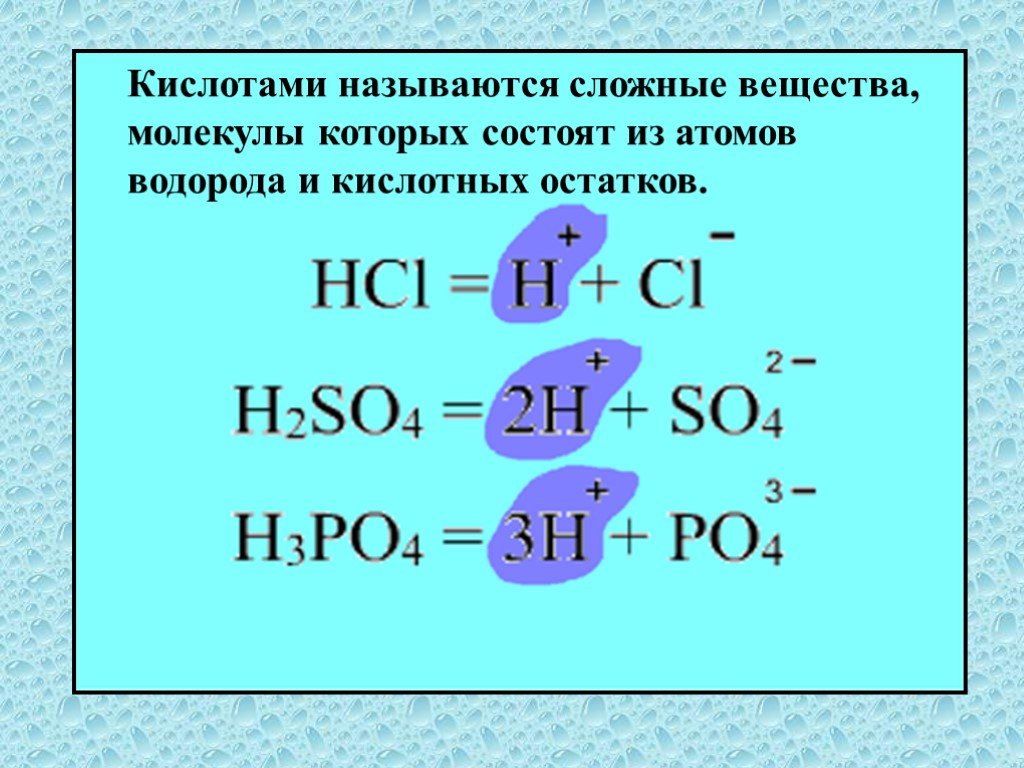
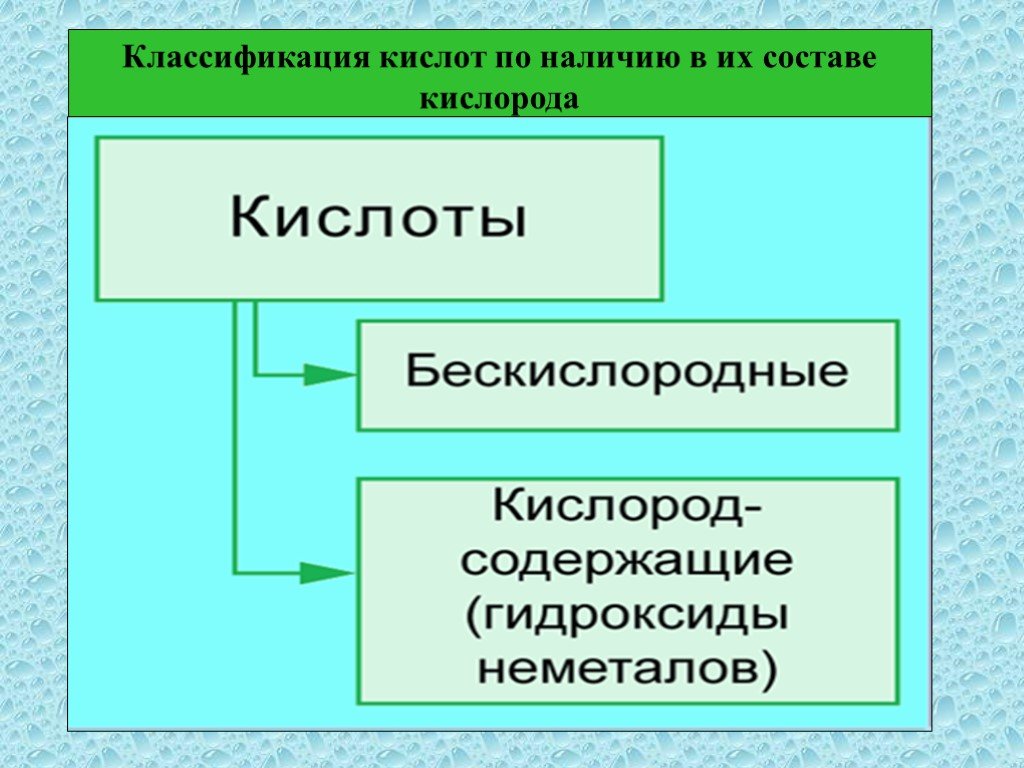
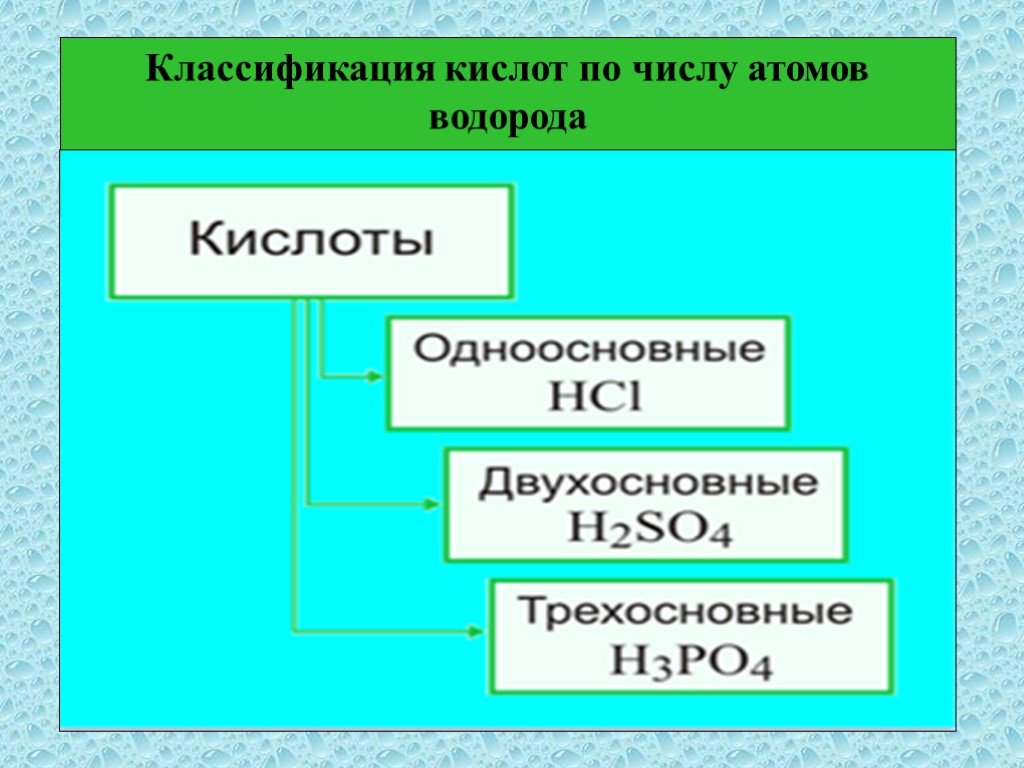
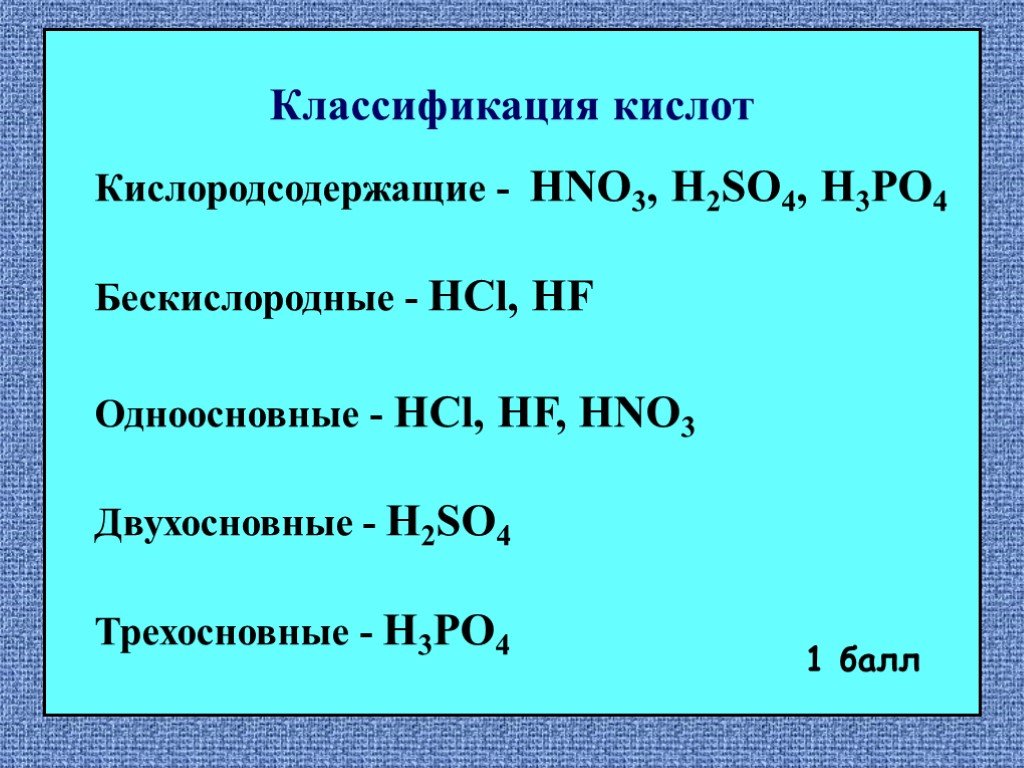
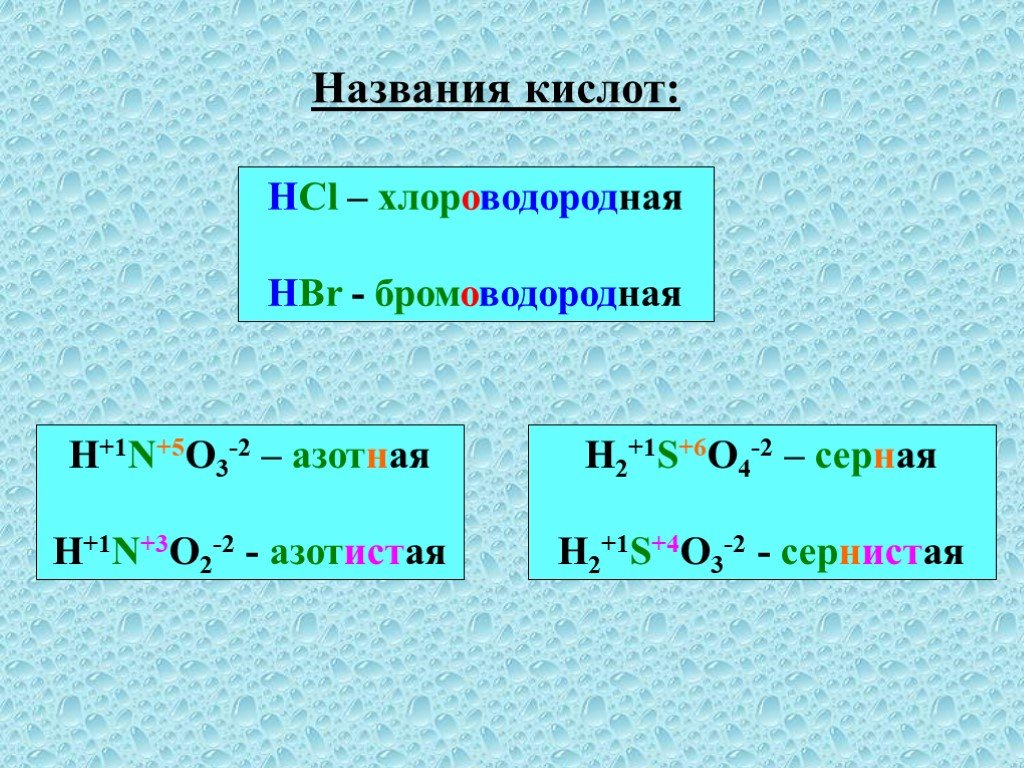
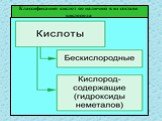
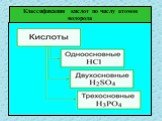
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка. Классификация кислот. По основности:. Одноосновные ...Классификация и свойства кислот
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на ...Классификация химических реакций в органической и неорганической химии
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества; рассмотреть классификацию ...Классификация химических реакций
это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и (или) строению. Химические реакции -. По числу ...Классификация химических реакций
«Химическое превращение, химическая реакция есть главный предмет химии». Н.Н.Семёнов. Какие явления относятся к (Ф) физическим, а какие к (Х) химическим. ...Классификация химических реакций
Химические реакции – процессы в результате которого из одних веществ получаются другие, отличающиеся по составу и строению. І.По числу и составу реагирующих ...Классификация химических реакций
. . . . . . . . . . . . . . . ...Классификация углеводов
Никонорова М. В. Учитель химии ГБОУ №2082 г. Москва. Углеводы-это исторически сложившееся название. Формально можно рассматривать как соединения углерода ...Взаимодействие кислот
HCl H2SO4 HNO3 H2CO3 H3PO4 I. Классификация кислот. По количеству атомов водорода (по основности) 1. одноосновные HCl 2. двухосновные H2SO4 3. трехосновные ...Предмет органической химии. Классификация органических веществ
План. 1. Определение предмета орг. химии. 2. Признаки органических веществ. 3. Особенности углерода. 4. Виды ковалентной связи, тип гибридизации электронных ...Классификация и номенклатура неорганических соединений
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Классификация веществ
ВЕЩЕСТВА простые сложные. ПРОСТЫЕ ВЕЩЕСТВА МЕТАЛЛЫ НЕМЕТАЛЛЫ. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ. Агрегатное состояние. Пластичность ( ковкость). Способность ...Исследование морей кислот
Загадочны морей просторы… Что там – под толщей темных вод? Долины, впадины, и горы Веществ сплошной круговорот… К. Паустовский. Исследование морей ...Виды нуклеиновых кислот
Нуклеиновые кислоты были впервые выделены из клеток гноя человека и спермы лосося швейцарским врачом и биохимиком Ф.Мишером между 1869 и 1871. Впоследствии ...Классификация химических элементов
Типичные металлы и типичные неметаллы. Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca + O2 ...В царстве кислот
Сегодня мы отправляемся в гости к кислотам. Наша задача как больше узнать о них. 1. Повторить определение кислот, их состав и классификацию. 2. Выяснить ...Многообразие карбоновых кислот
Валериановая кислота. Валериа́новая кислота́ (пента́новая кислота́) С4Н9COOH — одноосновная предельная карбоновая кислота, бесцветная жидкость с неприятным ...Важнейшие представители карбоновых кислот
Формула - HOOC – CH – CH2 – COOH OH. Название (по систематической номенклатуре) (гидроксиянтарная, 2 – гидроксибутандиовая кислота) Группа – Двухосновная ...Конспекты
Кислоты. Классификация кислот
Урок №_____ Класс _____ Дата__________. Тема урока: "Кислоты. Классификация кислот". Цели урока:. . Образовательные:. Сформировать понятия ...Состав и классификация кислот
Муниципальное общеобразовательное учреждение. средняя общеобразовательная школа № 16. г. Таганрога Ростовской области. Урок по химии ...Кислоты. Состав и классификация кислот
Разработка открытого урока по химии в 8 классе. учитель химии средней школы № 42,. г. Петропавловска Кривошеевой Н.А. Тема: Кислоты. Состав ...Кислоты органические и неорганические. Классификация и общие свойства кислот
Конспект открытого урока химии в 11 классе. «Кислоты органические и неорганические. Классификация и общие свойства кислот». Тема урока. Кислоты. ...Химические свойства кислот
МАОУ «СОШ № 36». . Витязева Оксана Валерьевна. Предмет:. химия. Класс:. 8 класс. Тип урока:. урок изучения нового материала. Тема урока:. ...Химические свойства карбоновых кислот
Технологическая карта урока учителя химии МБОУ СОШ№5г.Армавира Титович Е,Н,. Предмет ХИМИЯ. Класс 10. Автор УМК Новошинский И.И. Новошинская ...Химические свойства карбоновых кислот
Анацко . Ольга Эдуардовна, учитель химии. ГБОУ гимназия №399, Санкт-Петербург. Урок по теме «Химические свойства карбоновых кислот» в 9 классе. ...Соли азотной и азотистой кислот
Тема:. Соли азотной и азотистой кислот. Цель:. познакомить учащихся с солями азотной и азотистой кислот. Задачи:. . Обучающие. . . Познакомить ...Оксиды. Классификация оксидов
Муниципальное бюджетное общеобразовательное учреждение. «Ковылкинская средняя общеобразовательная школа № 2». Тема урока. «Оксиды. Классификация ...Взаимодействие кислот с металлами
ФИО:. Хомушку Шончалай Каадыровна. Место работы:. МБОУ СОШ № 2 г.Ак-Довурака Республики Тыва. должность:. учитель химии. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 января 2019
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию