Презентация "Предмет органической химии. Классификация органических веществ" (10 класс) – проект, доклад
Презентацию на тему "Предмет органической химии. Классификация органических веществ" (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 32 слайд(ов).
Слайды презентации
Список похожих презентаций
Классификация неорганических веществ
Цель урока. Закрепить знания по теме «неорганические классы веществ»; Продолжить развивать навыки написания химических уравнений реакций. План урока. ...Классификация органических веществ
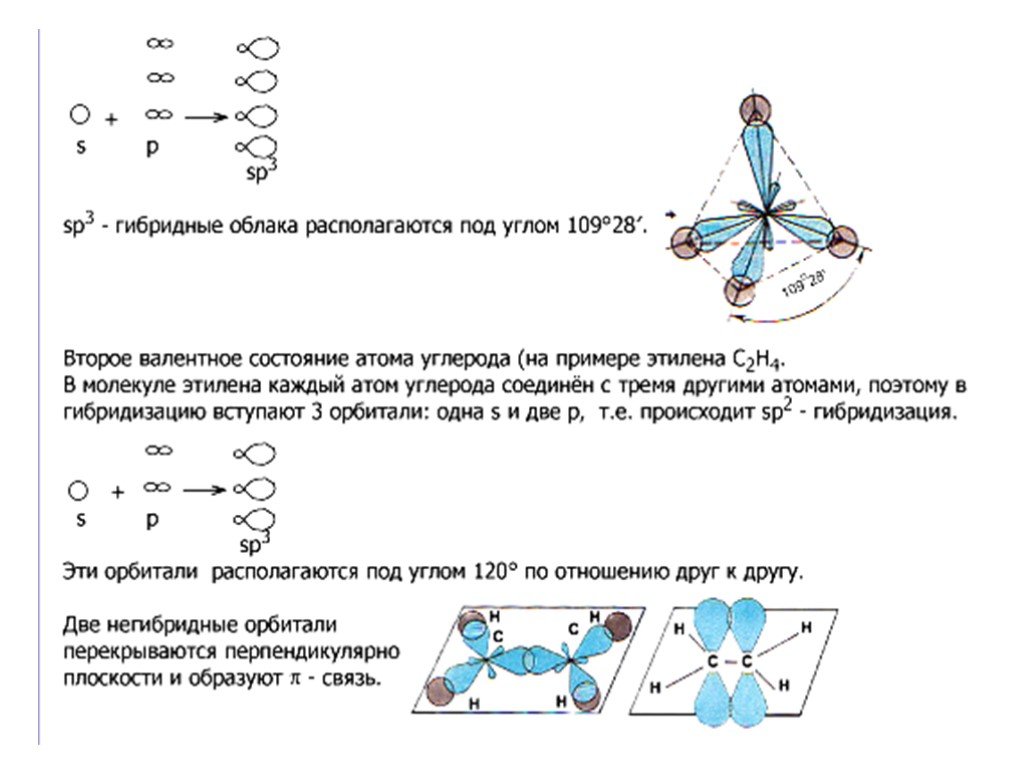
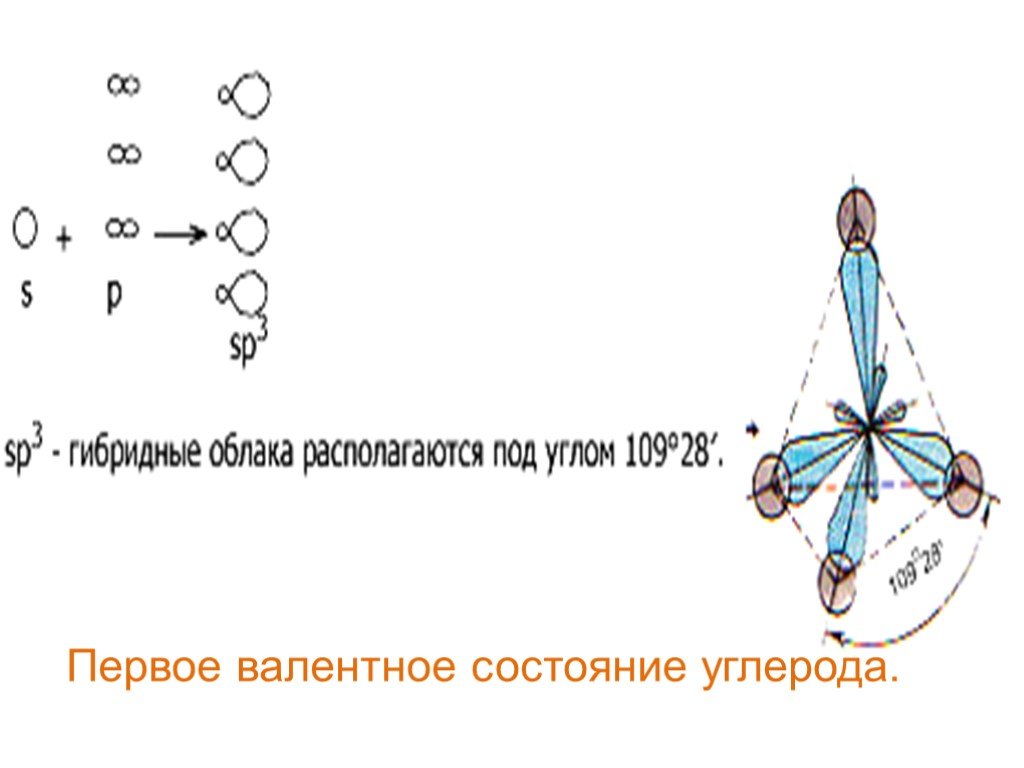
Органические вещества классифицируют:. По типу углеродной цепи По функциональной группе Функциональной называется группа атомов, определяющая наиболее ...Классификация неорганических веществ. Оксиды
ОКСИДЫ. Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число ...Классификация сложных и неорганических веществ. Оксиды". 8-й класс
Na2O – оксид натрия. Al2O3 – оксид алюминия ВаО – оксид бария. FeO – оксид железа Fe2O3 – оксид железа N2O – оксид азота NO2 – оксид азота ? N2O – ...Классификация органических веществ.
Астрономы обнаружили органические соединения на расстоянии 220 световых лет от Земли. Классификация органических соединений. ...Классификация сложных неорганических веществ. Кислоты
Сложные вещества неорганические органические оксиды кислоты основания соли. дать определение кислотам, рассмотреть состав кислот, классифицировать ...Классификация сложных неорганических веществ. Соли
Сложные вещества неорганические органические оксиды кислоты основания соли. ЦЕЛИ УРОКА:. дать определение солям, рассмотреть состав солей, классифицировать ...Классификация химических реакций в органической и неорганической химии
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества; рассмотреть классификацию ...«Становление органической химии»
ОРГАНИЧЕСКАЯ ХИМИЯ. ОРГАНИЧЕСКАЯ ХИМИЯ – раздел химической науки, изучающий углеводороды – вещества, содержащие углерод и водород, а также различные ...Значение органической химии
Значение органической химии чрезвычайно велико. Оно обусловлено той исключительной ролью , какую играют в жизни человека органические вещества. Белки, ...Классы неорганических веществ
Подборка различных заданий и вопросов по данной теме в игровой форме. Можно их использовать на уроке совершенствования знаний и умений и обобщения ...Классификация органических соединений
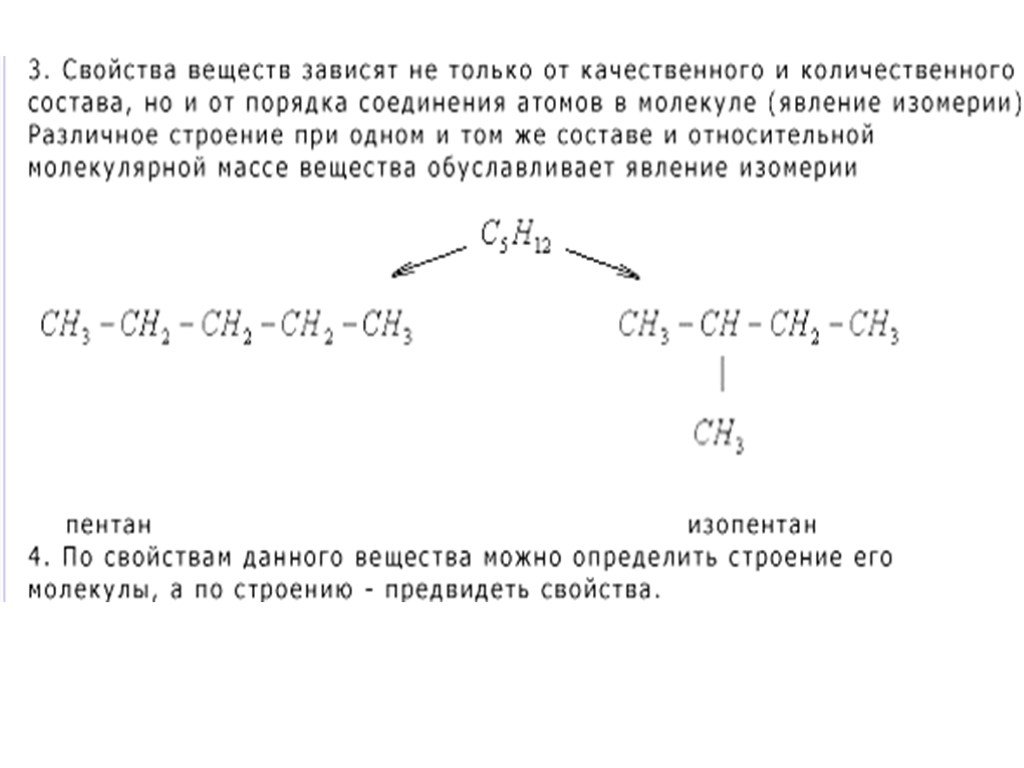
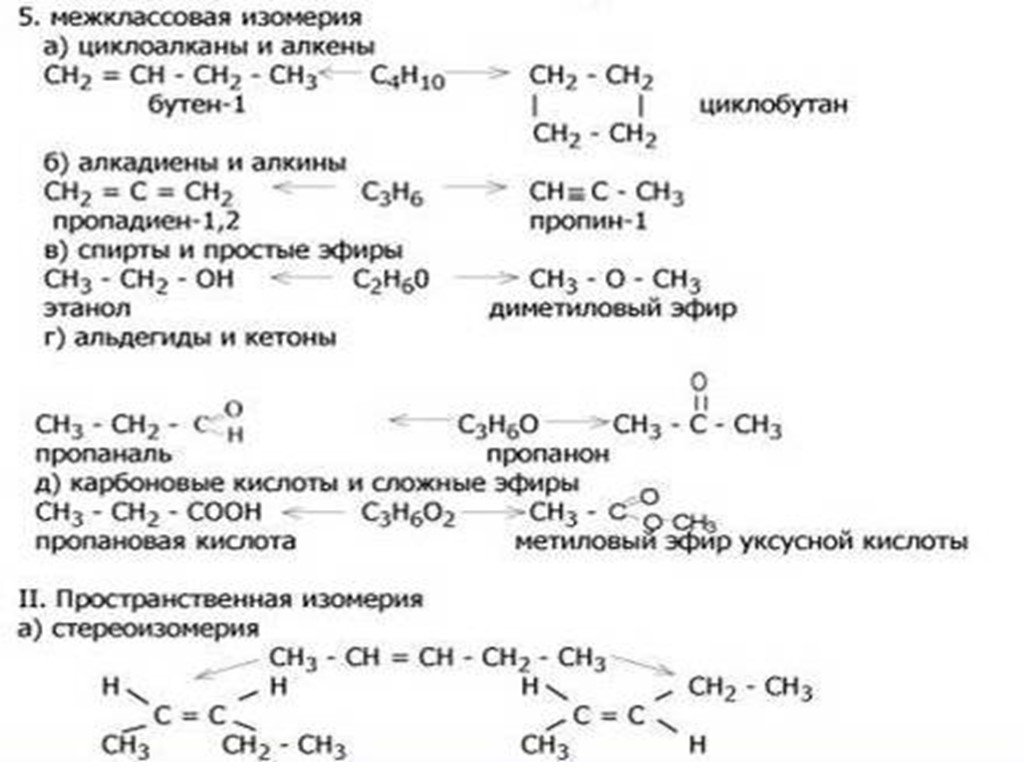
II Наличие в молекуле функциональной группы. Виды изомерии. Объект воздействия на реагент. БЛАГОДАРЮ ЗА ВНИМАНИЕ. ...Классификация органических соединений
Классификация. Органические вещества. Углеводороды СхНу. Кислородсодержащие. Азотсодержащие Углеводы предельные непредельные Алканы СnH2n+2 Алкины ...Важнейшие классы неорганических веществ
Неорганические вещества. Простые Сложные. Простые вещества Металлы Неметаллы. Сложные вещества. Оксиды - сложные вещества, состоящие из двух химических ...Классификация органических соединений
Классификация соединений по строению углеродной цепи. Ациклические соединения - соединения с открытой (незамкнутой) углеродной цепью. Эти соединения ...Классификация органических соединений
Органическая химия – химия углеводородов и их функциональных производных. органические вещества. углеводороды. функциональные производные углеводородов. ...Знаешь ли ты классы неорганических веществ
И Г Р А 9 К Л А С С ЗНАЕШЬ ЛИ ТЫ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ? Я с вами пройду весь химический путь, отыщим мы с вами ответы! Я не дам на пути вам ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Классификация и номенклатура неорганических соединений
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Классификация веществ
ВЕЩЕСТВА простые сложные. ПРОСТЫЕ ВЕЩЕСТВА МЕТАЛЛЫ НЕМЕТАЛЛЫ. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ. Агрегатное состояние. Пластичность ( ковкость). Способность ...Конспекты
Предмет органической химии. Особенности строения органических веществ
Муниципальное бюджетное образовательное учреждение. . «Аргуновская средняя общеобразовательная школа». Никольский район. Вологодская область. ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. Орловская средняя общеобразовательная школа №3. Открытый урок. по теме «Предмет ...Предмет органической химии. Взаимосвязь живой и неживой природы
Интегрированный урок химия + биология «Предмет органической химии. Взаимосвязь живой и неживой природы». Ход урока. Организационный момент :. ...Предмет химии. Вещества
МБОУ «Гимназия №1 города Новопавловска». Химия 8 класс. Тема:. Предмет химии. Вещества. Учитель: Татьяна Алексеевна Комарова. ...Предмет химии. Вещества
Тема. I. : «. Введение. Предмет химии». Урок. . №1. . . Тема урока:. . Предмет химии. Вещества. . . Л.Р.№1 «Рассмотрение веществ с различными ...Предмет химии. Вещества и их свойства
Цели урока:. Обучающая:. сформировать представление о предмете химии. Дать первоначальные понятия о веществе, химическом элементе, о простых ...Предмет химии. Вещества и их свойства
Урок по химии в 8 классе на тему. «Предмет химии. Вещества и их свойства». Цель урока. : создать условия для формирования у учащихся понятий “химия ...Предмет химии. Вещества и их свойства
Технологическая карта урока № 1. . 1. Ф.И.О. учителя:. Рымарчук Оксана Васильевна. 2. Класс:. __ _8. . Дата: ____________Предмет. Химия. № урока ...Предмет химии. Вещество
Предмет химии. Вещество. Цели урока:. Обучающая:. сформировать представление о предмете химии. Дать первоначальные понятия о веществе, химическом ...Предмет химии. Вещество
Разработка урока в 8-м классе "Предмет химии. Вещество". Цели урока:. Обучающая:. сформировать представление о предмете химии. Дать первоначальные ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 июля 2018
Категория:Химия
Классы:
Содержит:32 слайд(ов)
Поделись с друзьями:
Скачать презентацию