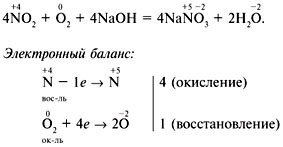Конспект урока «Соли азотной и азотистой кислот» по химии
Тема: Соли азотной и азотистой кислот
Цель: познакомить учащихся с солями азотной и азотистой кислот
Задачи:
Обучающие. Познакомить учащихся со способами получения, свойствами и областями применения нитратов и нитритов. Рассмотреть проблему повышенного содержания нитратов в сельскохозяйственной продукции. Дать представление об азотных удобрениях, их классификации и представителях.
Воспитательные. Продолжить формирование научного мировоззрения, воспитание положительного отношения к знаниям.
Развивающие. Продолжить развитие умений: выделять главное, устанавливать причинно-следственные связи, вести конспект, проводить эксперимент, применять знания на практике.
Основной ведущий метод: объяснительно-иллюстративный
Тип урока: изучение нового материала.
| Содержание урока | Методы и формы обучения | |
| Переведите с алхимического языка такую запись: «“Крепкая водка” пожирает “луну”, выпуская “лисий хвост”. Сгущение полученной жидкости порождает “адский камень”, который чернит ткань, бумагу и руки. Сегодня на уроке мы с вами поговорим об солях азотной и азотистых кислот. Узнаем области применения, как соли можно получить и их физические и химические свойства. | Методы: 1.Общий метод О-И 2.Группа частных методов словесные 3.Частный метод рассказ Формы обучения: фронтальная |
| Азотистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах. Соли азотистой кислоты называются нитритами. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны. Получение: 1. N2O3 + H2O => 2HNO2 Как можно еще получить азотистую кислоту? ( Какая степень окисления в азотистой кислоте? Значит, кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей окисляется в HNO3: 5HNO2+2HMnO4→ 2Mn(NO3)2+ HNO3+ 3H2O; HNO2+ Cl2+ H2O → HNO3+ 2HCl. 2HNO2 + 2HI → 2NO↑ + I2↓ + 2H2O – восстановительные свойства Качественная реакция на нитрит-ионNO2–– взаимодействие нитритов с раствором йодида калия КI, подкисленным разбавленной серной кислотой. Как должна изменить окраску йодкрахмальная бумажка под действием свободного I2? Получение солей (нитратов и нитритов) Назовите способы получения солей, которые вам известны? Как можно получить нитраты и нитриты? 1) Металл + неметалл = соль; 2) металл + кислота = соль + водород; 3) оксид металла + кислота = соль + вода; 4) гидроксид металла + кислота = соль + вода; 5) гидроксид металла + кислотный оксид = соль + вода; 6) оксид металла + оксид неметалла = соль; 7) соль1+ гидроксид металла (щелочь) = соль2+ гидроксид металла (нерастворимое основание); 8) соль1+ кислота (сильная) = соль2+ кислота (слабая); 9) соль1 + соль2 = соль 3+ соль4 10) соль1+ металл (активный) = соль2+ металл (менее активный). Специфический способ получения нитратов и нитритов: диспропорционирование. В присутствии избытка кислорода Соли азотной кислоты – нитраты нитраты щелочных металлов, кальция, аммония – селитры KNO3 - калийная селитра , NH4NO3- аммиачная селитра. Физические свойства: Все нитраты твёрдые кристаллические вещества, белого цвета, хорошо растворимые в воде. Ядовиты! Химические свойства нитратов Взаимодействие нитратов с металлами, кислотами, щелочами, солями Задание. Отметить признаки каждой реакции, записать молекулярные и ионные уравнения, соответствующие схемам: Cu(NO3)2+ Zn AgNO3+ HCl Cu(NO3)2+ NaOH AgNO3+ BaCl2 Разложение нитратов При нагревании твердых нитратов все они разлагаются с выделением кислорода (исключением является нитрат аммония), при этом их можно разделить на три группы. Первую группу составляют нитраты щелочных металлов 2КNО3 = 2КNО2+ О2↑. Вторую группу от щелочноземельных металлов до меди включительно 2Сu(NО3)2 = 2СuО + 4NО2+ O2, Третью группу Ме после Сu Hg(NО3)2 = Нg + 2NО2 + О2, Почему азота в природе много (он входит в состав атмосферы), а растения часто дают плохой урожай из-за азотного голодания? (Растения не могут усваивать молекулярный азот из воздуха. При недостатке азота задерживается образование хлорофилла, задерживается рост и развитие растения.) Назовите способы усвоения атмосферного азота. (Часть связанного азота поступает в почву во время гроз. Бобовые, на корнях которых развиваются клубеньковые бактерии, способные связывать атмосферный азот, переводя его в соединения, доступные для растений.) Снимая урожаи, человек ежегодно уносит вместе с ними огромные количества связанного азота. Эту убыль он покрывает внесением не только органических, но и минеральных удобрений (нитратных, аммиачных, аммонийных). Азотные удобрения вносят под все культуры. Азот усваивается растениями в виде катиона аммония Доклады учеников
| Методы: 1.Общий метод О-И 2.Группа частных методов Словесно-наглядные 3.Частный метод рассказ Формы обучения: фронтальная Работа у доски Составление электронного баланса Работа у доски Составление электронного баланса Работа у доски |
| Сегодня на уроке мы с вами познакомились с солями азотной и азотистой кислот, узнали как их получить, их физические и химические свойства. Узнали про вред нитраты | Методы: 1.Общий метод О-И 2.Группа частных методов словесные 3.Частный метод рассказ Формы обучения: фронтальная |
| | Методы: 1.Общий метод О-И 2.Группа частных методов словесные 3.Частный метод рассказ Формы обучения: индивидуальная |
Здесь представлен конспект к уроку на тему «Соли азотной и азотистой кислот», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.