Конспект урока «Соли азотной кислоты» по химии
Дата_____________ Класс_______________
Тема: Соли азотной кислоты.
Цели урока: знать состав, строение, свойства и применение солей азотной кислоты; уметь доказывать химические свойства солей азотной кислоты, записывать уравнения реакций в свете представлений об электролитической диссоциации и окислительно-восстановительных процессах.
Ход урока
1. Организационный момент урока.
2. Изучение нового материала.
Нитраты (селитры)
Азотная кислота – одноосновная, образует один ряд солей – нитраты состава:

Нитраты калия, натрия, кальция и аммония называют селитрами. Например, селитры: KNO3– нитрат калия (индийская селитра), NаNО3 – нитрат натрия (чилийская селитра), Са(NО3)2– нитрат кальция (норвежская селитра), NH4NO3 – нитрат аммония (аммиачная или аммонийная селитра, ее месторождений в природе нет). Германская промышленность считается первой в мире, получившей соль NH4NO3 из азота N2 воздуха и водорода воды, пригодную для питания растений.
Физические свойства
Нитраты – вещества с преимущественно ионным типом кристаллических решёток. При обычных условиях это твёрдые кристаллические вещества, все нитраты хорошо растворимы в воде, сильные электролиты.
Получение нитратов
Нитраты образуются при взаимодействии:
1) Металл + Азотная кислота
Cu + 4HNO3(k) = Cu(NO3)2 + 2NO2↑ + 2H2O
2) Основный оксид + Азотная кислота
CuO + 2HNO3 = Cu(NO3)2 + H2O
3) Основание + Азотная кислота
HNO3 + NaOH = NaNO3 + H2O
4) Аммиак + Азотная кислота
NH3 + HNO3 = NH4NO3
5) Соль слабой кислоты + Азотная кислота
В cоответствии с рядом кислот каждая предыдущая кислота может вытеснить из соли последующую:
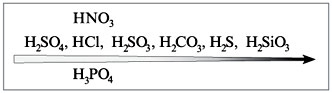
2HNO3 + Na2CO3 = 2NaNO3 + H2O + CO2 ↑
6) Оксид азота (IV) + щёлочь
2NO2 + NaOH = NaNO2 + NaNO3 + H2O
в присутствии кислорода -
4NO2 + O2 + 4NaOH = 4NaNO3 + 2H2O
Химические свойства нитратов
I. Общие с другими солями
1) C металлами
Металл, стоящий в ряду активности левее, вытесняет последующие из их солей:

Cu(NO3)2 + Zn = Cu + Zn(NO3)2
2) С кислотами
AgNO3 + HCl = AgCl↓ + HNO3
3) Со щелочами
Cu(NO3)2 + 2NaOH = Cu(OH)2 ↓ + 2NaNO3
4) C cолями
2AgNO3 + BaCl2 = Ba(NO3)2 + 2AgCl↓
II. Специфические
Все нитраты термически неустойчивы. При нагревании они разлагаются с образованием кислорода. Характер других продуктов реакции зависит от положения металла, образующего нитрат, в электрохимическом ряду напряжений:

1) Нитраты щелочных металлов разлагаются до нитритов:
2NaNO3 = 2NaNO2 + O2↑
2) Нитраты менее активных металлов разлагаются до оксидов:
2Mg(NO3)2 = 2MgO + 4NO2↑ + O2↑
2Cu(NO3)2 =2CuO + 4NO2 ↑+ O2↑
3) Нитраты наименее активных металлов разлагаются до металлов:
Hg(NO3)2 = Hg + 2NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2 ↑+ O2↑
4) Особое положение занимает нитрат аммония. Нитрат аммония разлагаются до N2O:
NH4NO3 = N2O↑ + 2H2O
Дополнительно:
Качественная реакция на нитрат-ион NO3– – взаимодействие нитратов c металлической медью при нагревании в присутствии концентрированной серной кислоты или с раствором дифениламина в Н2SO4 (конц.).
Опыт. Качественная реакция на ион NO3–.
В большую сухую пробирку поместить зачищенную медную пластинку, несколько кристалликов нитрата калия, прилить несколько капель концентрированной серной кислоты. Пробирку закрыть ватным тампоном, смоченным концентрированным раствором щелочи и нагреть.
Признаки реакции - в пробирке появляются бурые пары оксида азота(IV), что лучше наблюдать на белом экране, а на границе медь – реакционная смесь появляются зеленоватые кристаллы нитрата меди(II).
Протекают следующие уравнения реакций:
КNO3 (кр.) + Н2SO4 (конц.) = КНSО4 + НNО3↑

3. Домашнее задание
П. 20, упр. 2, 8, 9 на стр.59
Здесь представлен конспект к уроку на тему «Соли азотной кислоты», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

