Презентация "Окислительные свойства концентрированной серной и азотной кислот" по химии – проект, доклад
Презентацию на тему "Окислительные свойства концентрированной серной и азотной кислот" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 10 слайд(ов).
Слайды презентации
Список похожих презентаций
Азотная кислота и её свойства
Индивидуальная работа. Осуществите превращения 1 вариант: N2 → NO→NO2 2 вариант: N2→NH3→(NH4)SO4 3 вариант: NH3→N2→K3N. HNO. Содержание. Структурная ...Азотная кислота и ее свойства
Сегодня на уроке мы должны:. записать молекулярную и структурную формулы азотной кислоты; изучить химические свойства азотной кислоты в свете ОВР; ...Воздействие серной кислоты на углеводы
Углеводы. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся ...Нитрозный способ получения серной кислоты
Реагенты. Медь Азотная кислота Сульфит натрия Раствор серной кислоты 70%. Приборы. Две колбы Вюрца Трехгорлая колба 2 газоотводных шланга Штативы ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Классификация и свойства кислот
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Аминокислоты и белки: строение и свойства
Аминокислоты. Соединение, которое содержит одновременно и кислотную функциональную группу, и аминогруппу, является аминокислотой. . . . Незаменимые ...Классификация и свойства кислот
Кислоты – это сложные неорганические соединения, состоящие из протона водорода и кислотного остатка. Классификация кислот. По основности:. Одноосновные ...Предмет химии. Вещества и их свойства
Химия в древности. Химия, как одна из наук, изучающих явления природы, зародилась в Древнем Египте еще до нашей эры, одной из самых технически развитых ...Получение и свойства алканов
Оглавление. Определение Гомологического ряд метана Строение молекулы метана Номенклатура Изомерия Получение Физические свойства Химические свойства ...Основные свойства воды
Содержание. Краткая характеристика основных свойств воды Движение частиц воды Особенности смешивания горячей и холодной воды. Цель работы: исследовать ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Металлы, свойства металлов
Металлы – химические элементы , образующие в свободном состоянии простые вещества с металлической связью. М.В. Ломоносов - металлы «светлое тело, ...Альдегиды и их свойства
Содержание Строение молекул Изомерия и номенклатура Физические свойства Получение Химические свойства Применение Контрольные вопросы. Альдегиды – ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Аммиак: состав, строение, свойства, применение
История названия. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Алюминий и его свойства
Алюминий и его свойства. ППС. Химическая активность. Взаимодействие с простыми веществами. Взаимодействие с сложными веществами. получение лабораторное ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Конспекты
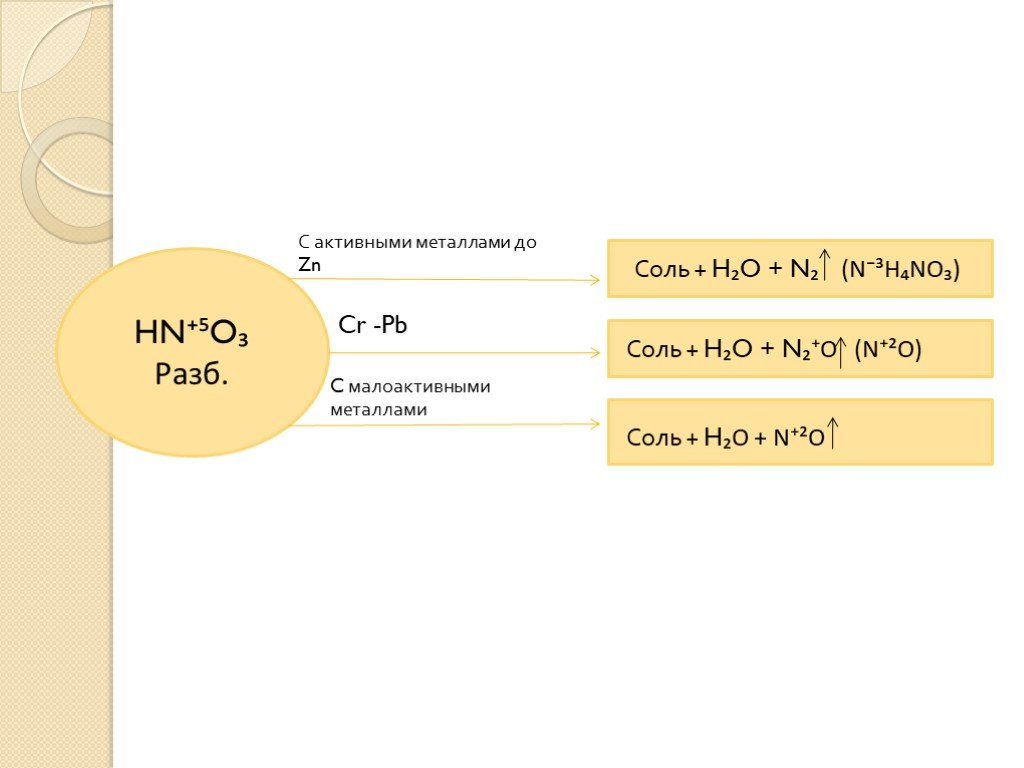
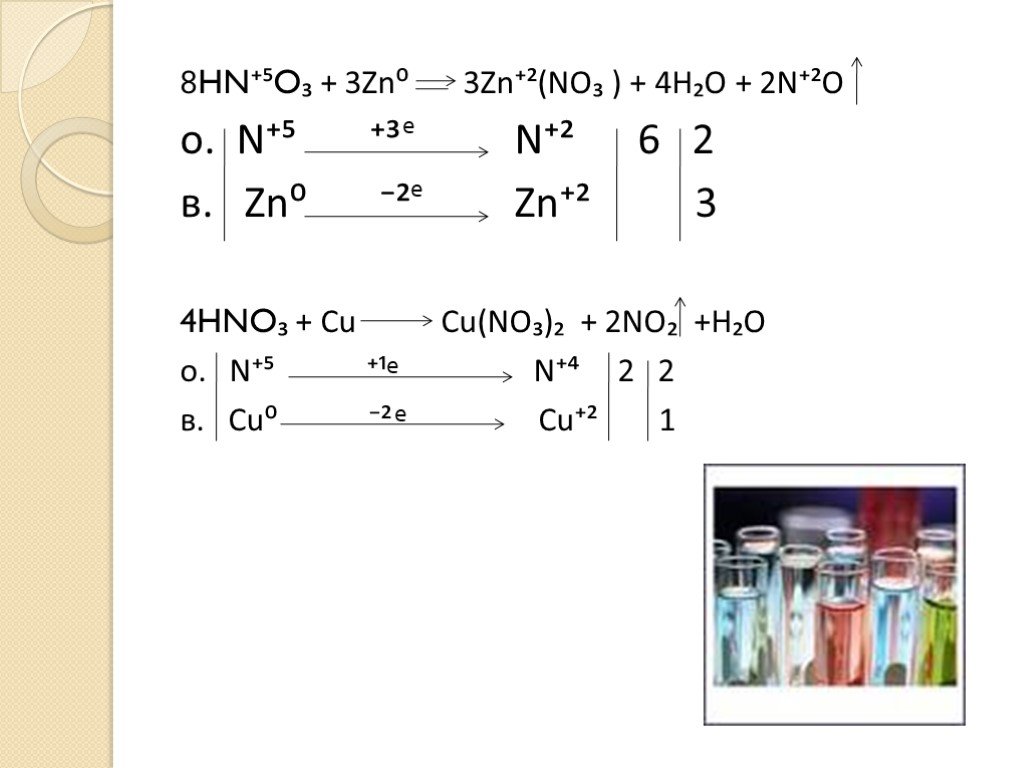
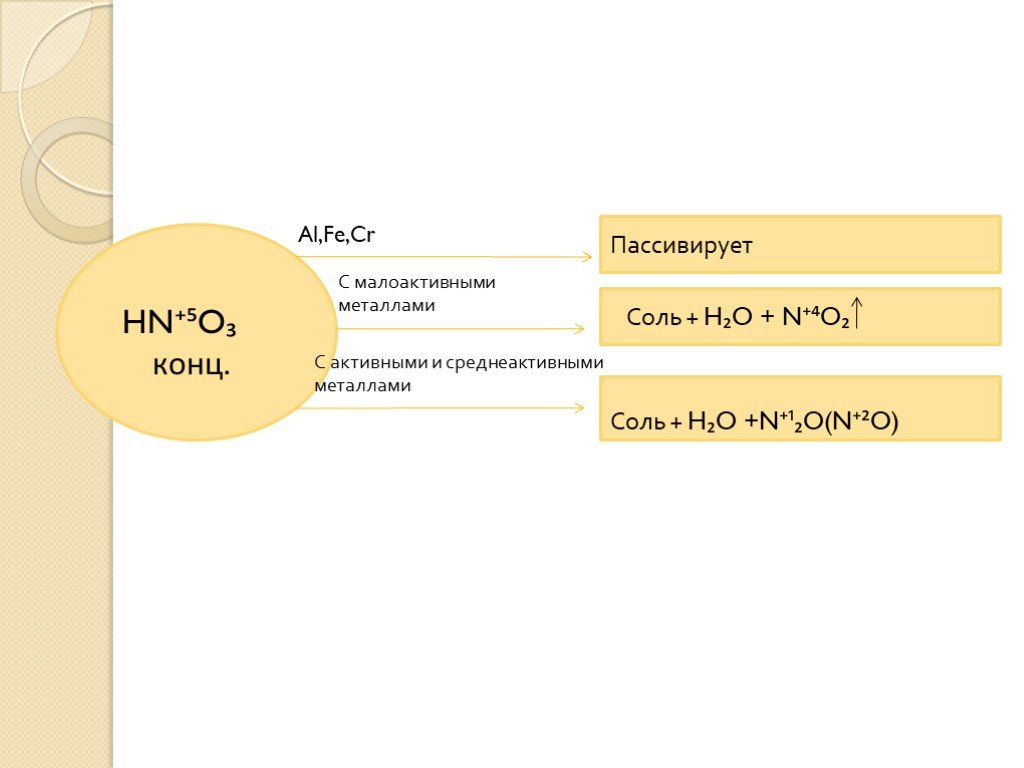
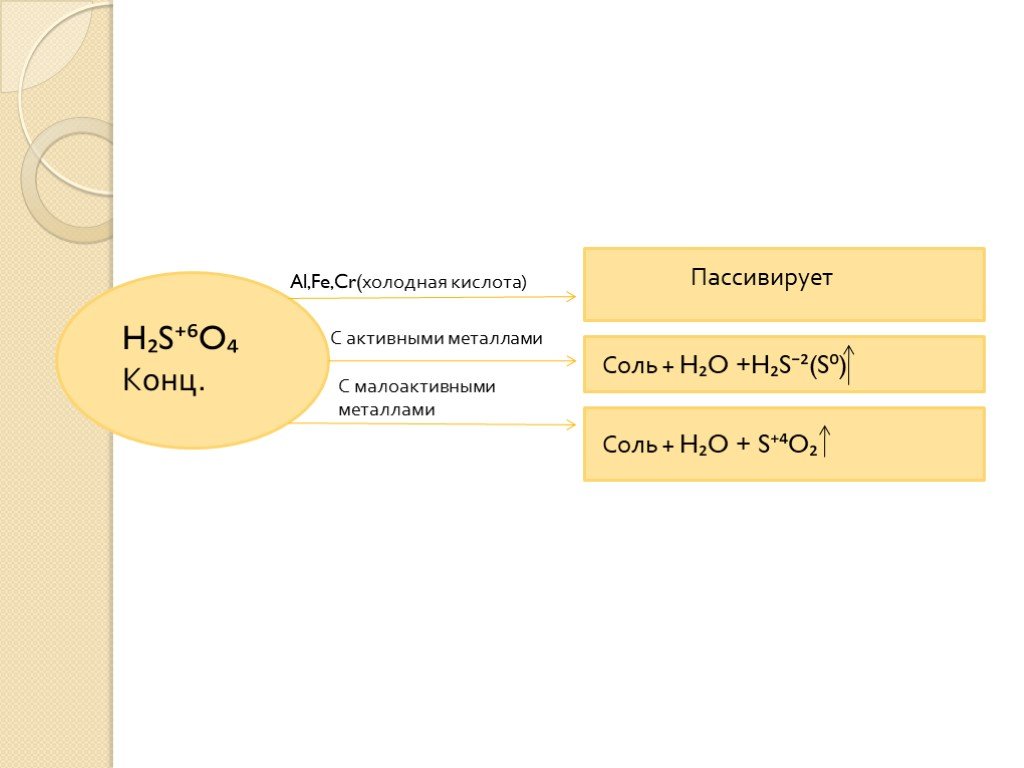
окислительные свойства серной и азотной кислот
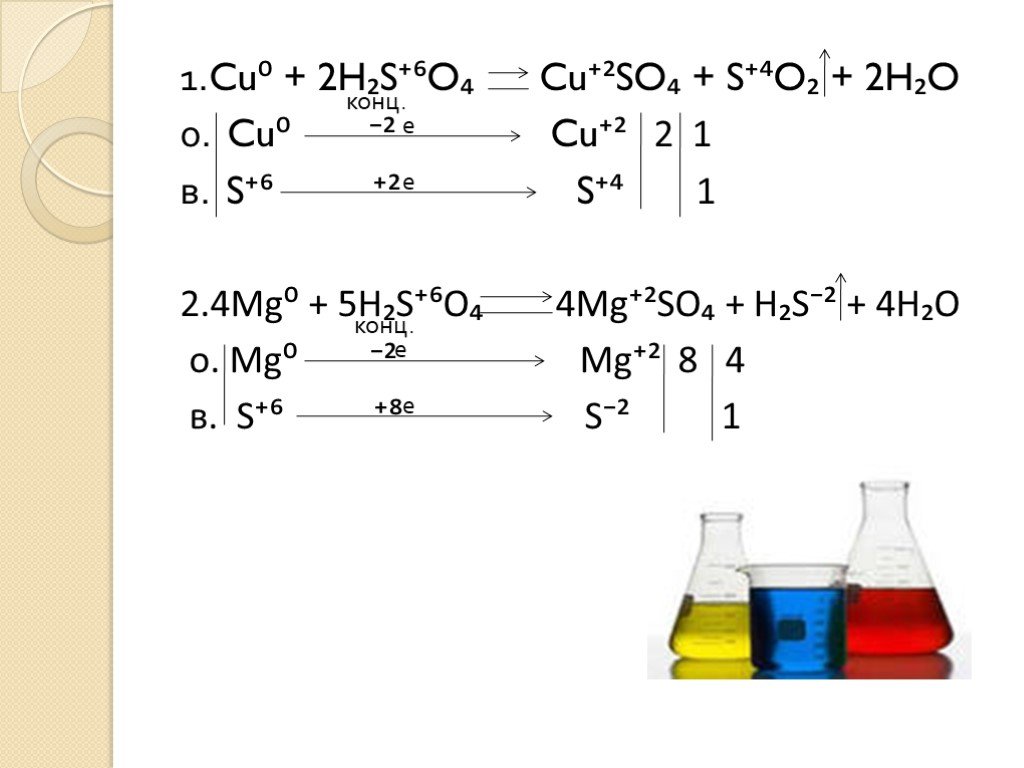
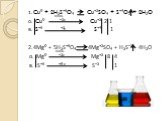
Тема:. окислительные свойства серной и азотной кислот. . Преподаватель химии ОАОУ СПО «Маловишерский техникум» Дмитриева Н.А. Цель урока:. . ...Окислительные свойства концентрированной серной кислоты
Дата_____________ Класс_______________. Тема: Окислительные свойства концентрированной серной кислоты. Цели урока:. ознакомиться с окислительными ...Окислительные свойства азотной кислоты
Дата_____________ Класс_______________. Тема:. . Окислительные свойства азотной кислоты. Цели урока:. знать строение, свойства и применение ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Окислительные свойства серной кислоты
Конспект урока. Данные об учителе: Загребина Анастасия Павловна. учитель МБОУ Июльской СОШ, 1 категория, запрашиваемая 1 категория. Предмет. : химия. ...Окислительные свойства азотной кислоты
План конспект урока. Окислительные свойства азотной кислоты. Казанцева Александра Геннадьевна. . . МБОУСОШ №4 г. Советский. . Учитель. ...Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты
Тема: «Азотная кислота и ее свойства, получение и применение. Соли азотной кислоты» (урок – исследование). Цели урока. Образовательная:. ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Азотная кислота: состав молекулы, физические и хими- ческие свойства
Урок по химии разработан к учебнику И. И. Новошинского, Н. С. Новошинской. Технология критического мышления. Тема урока:. «Азотная кислота: состав ...Кислоты. Химические свойства кислот в свете теории электролитической диссоциации
Урок химии в 8-м классе по теме: "Кислоты. Химические свойства кислот в свете теории электролитической диссоциации.". . Цели урока:. Образовательная. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:1 октября 2018
Категория:Химия
Содержит:10 слайд(ов)
Поделись с друзьями:
Скачать презентацию