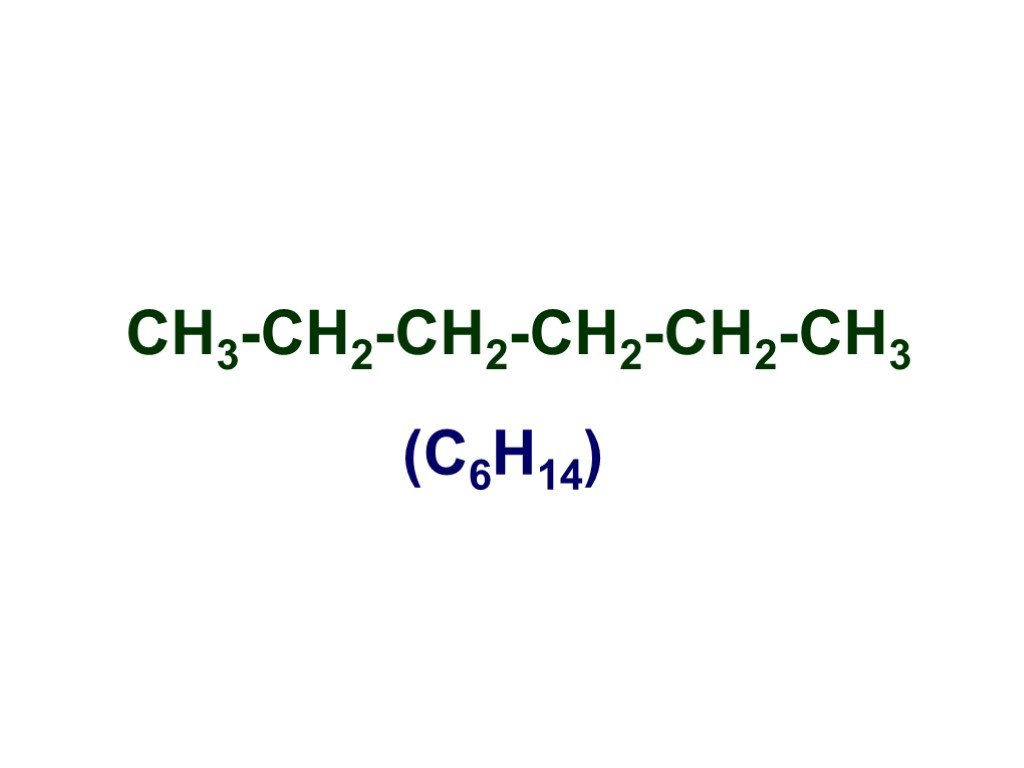
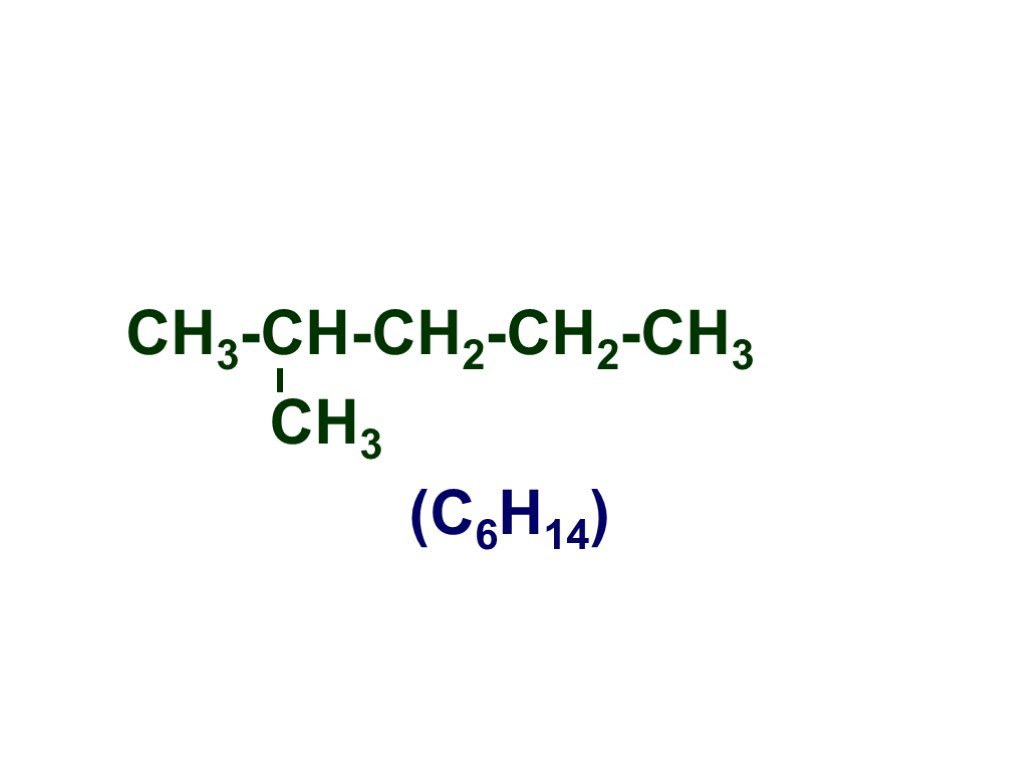
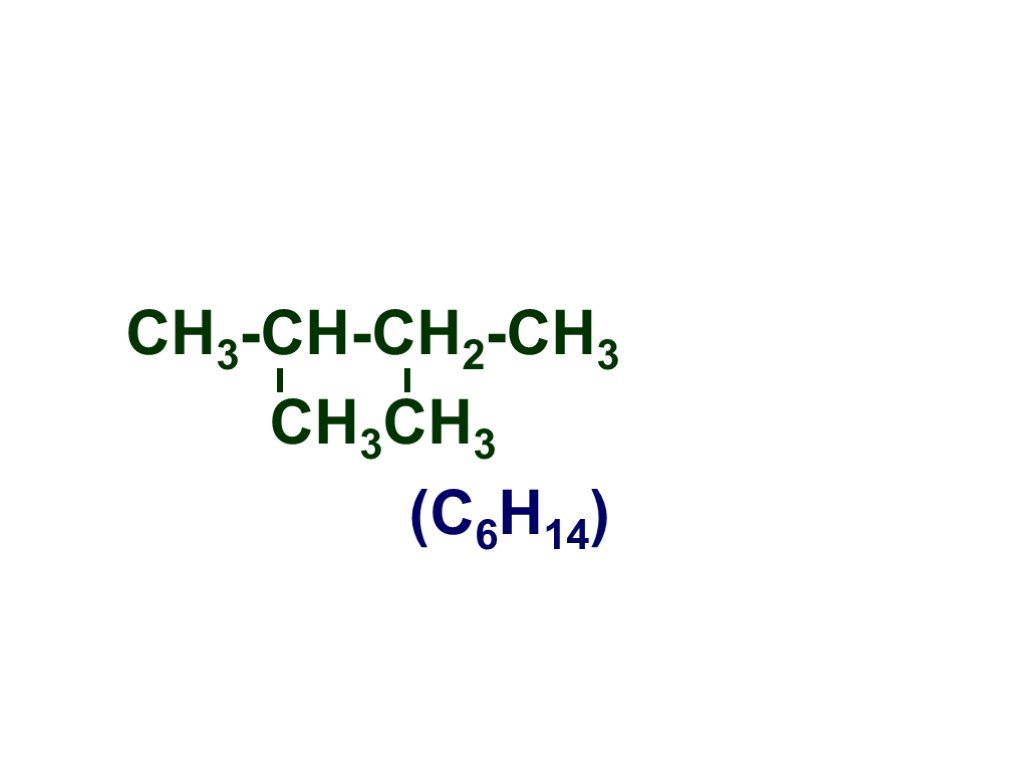
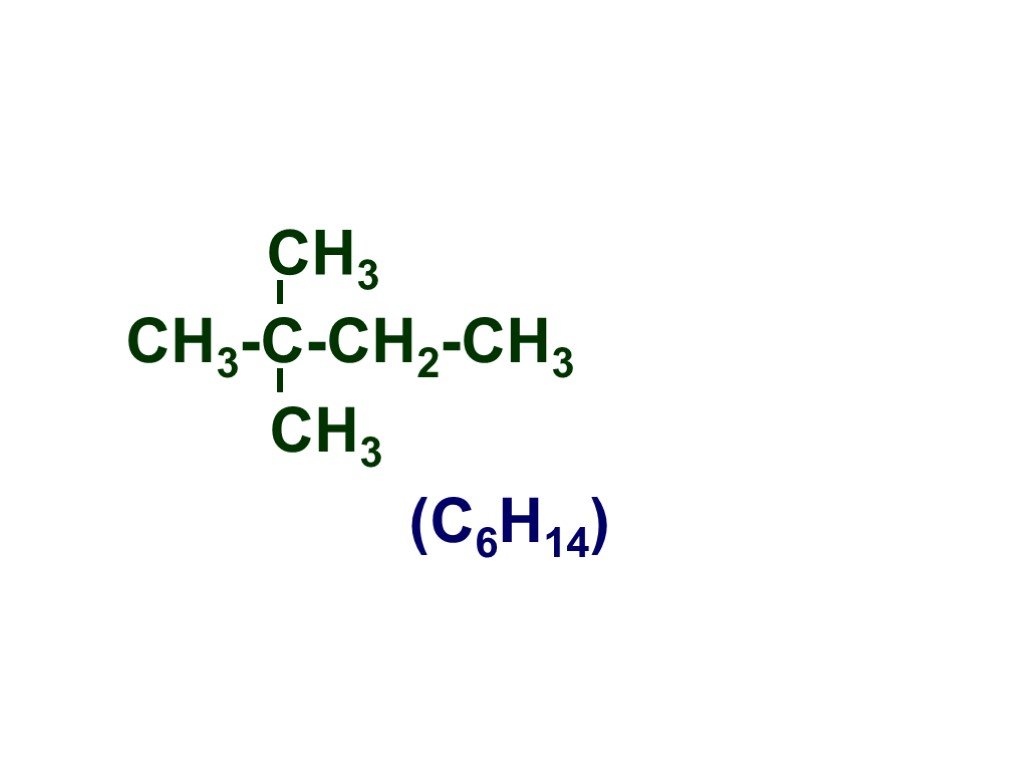
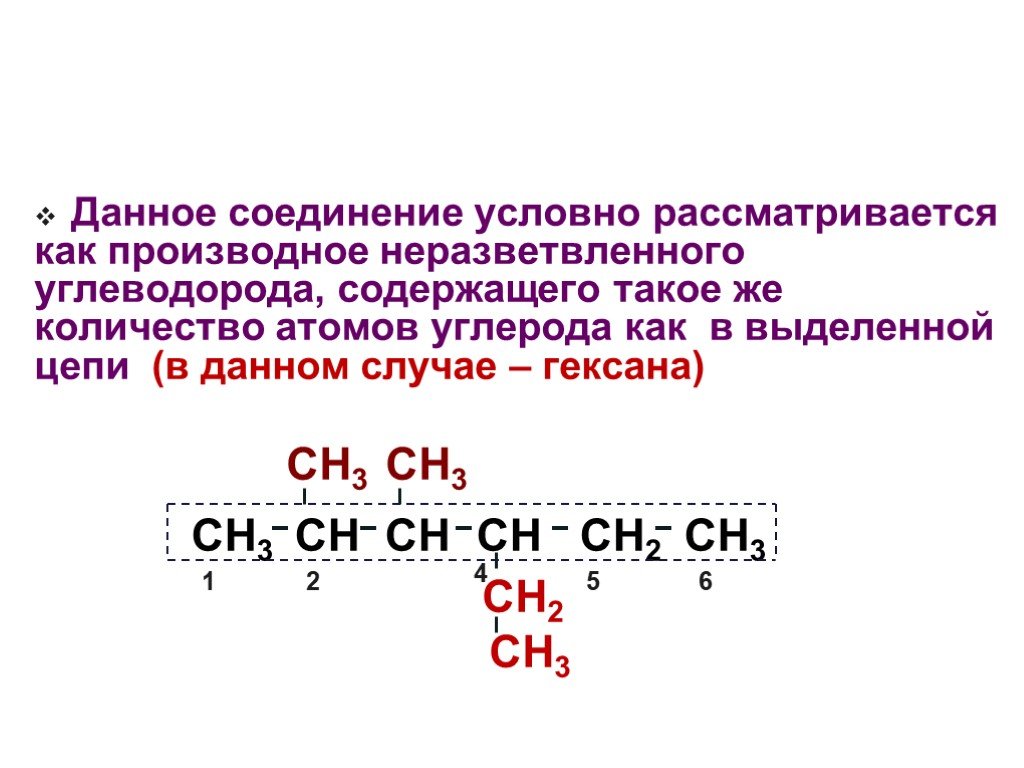
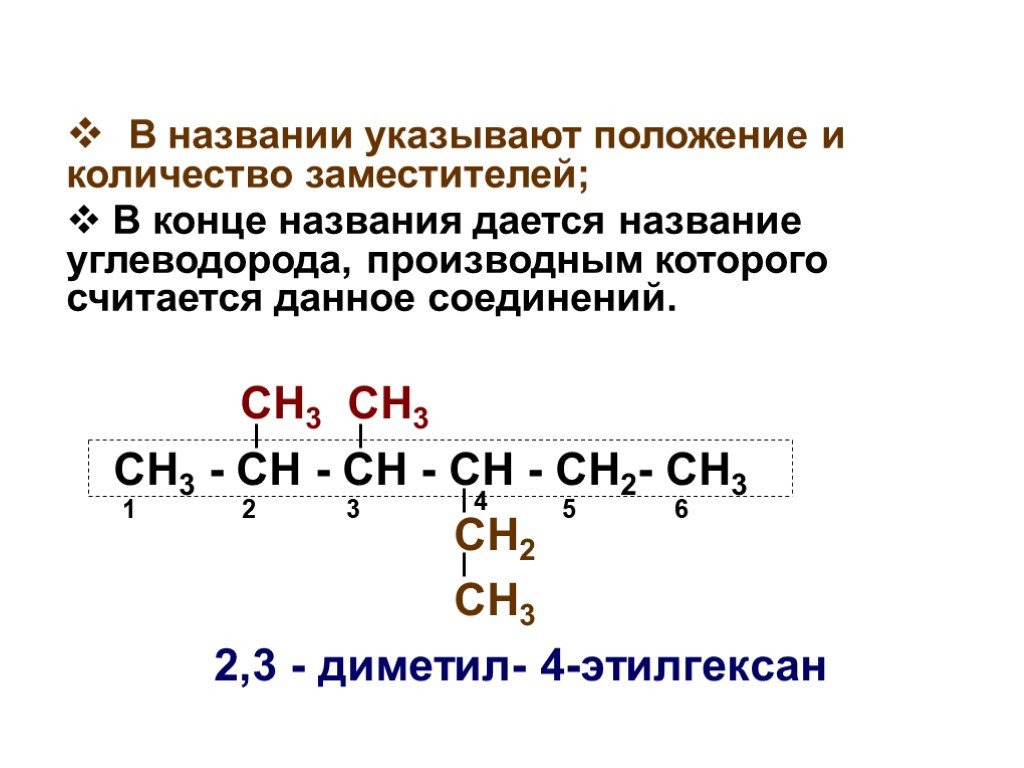
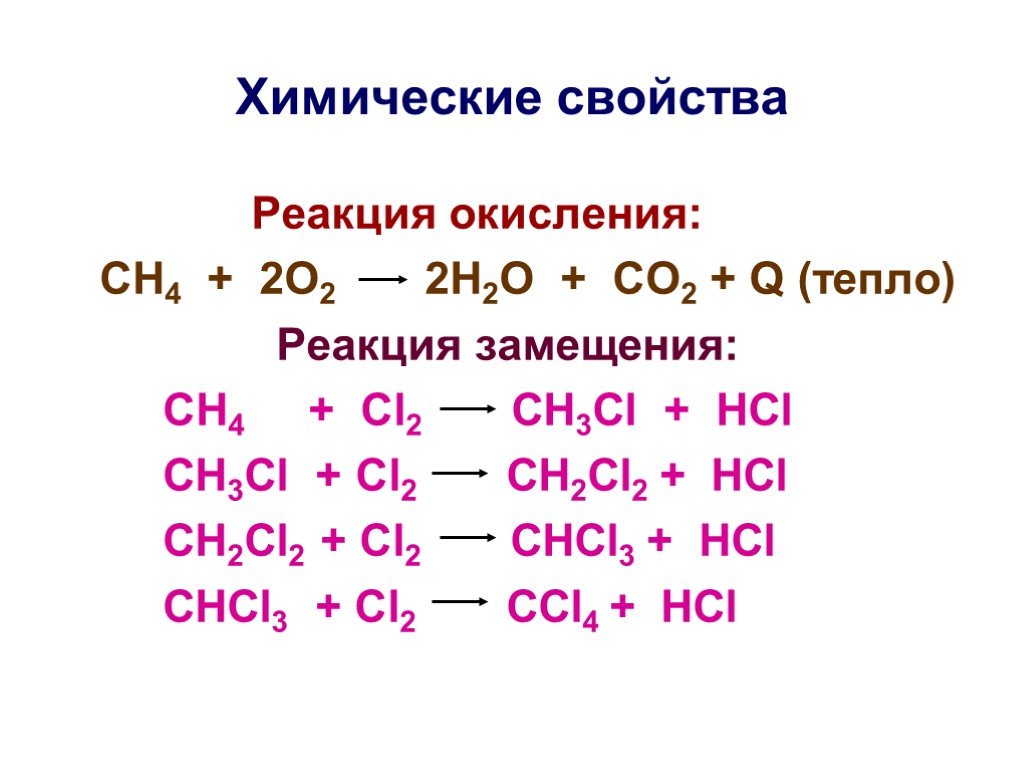
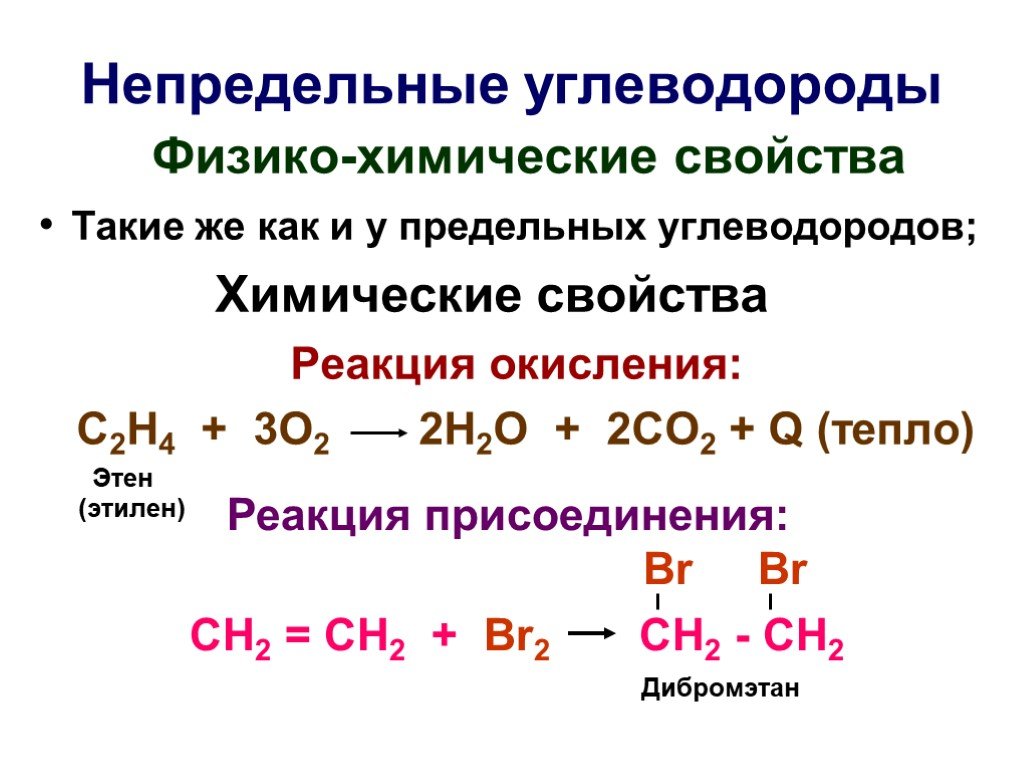
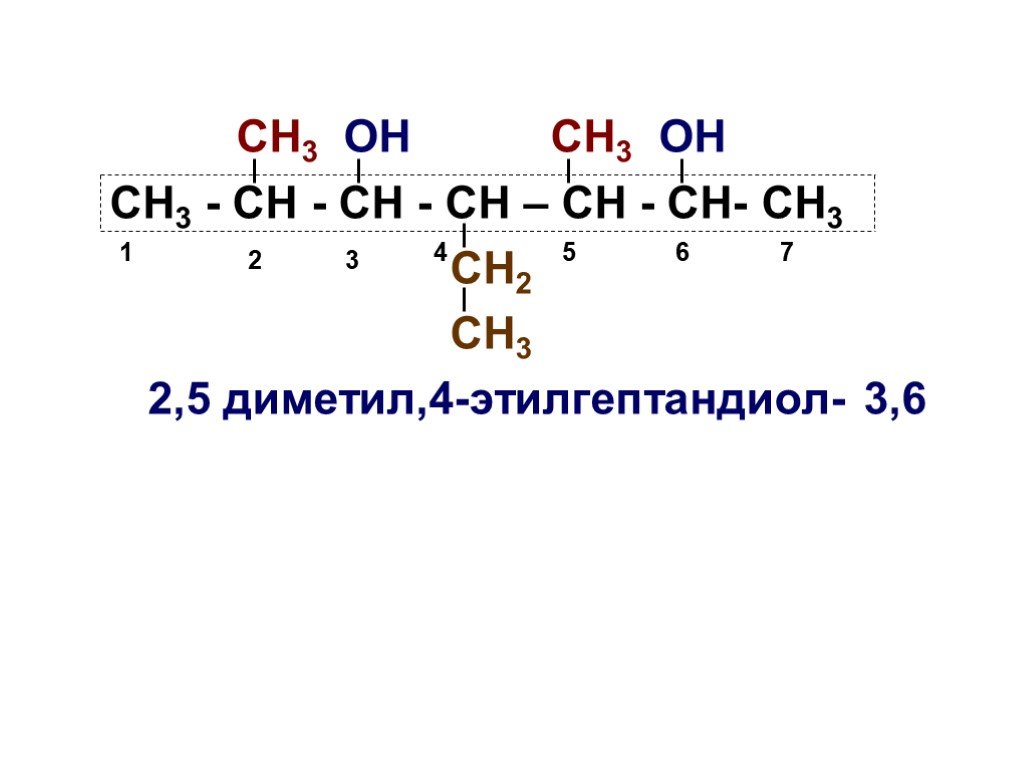
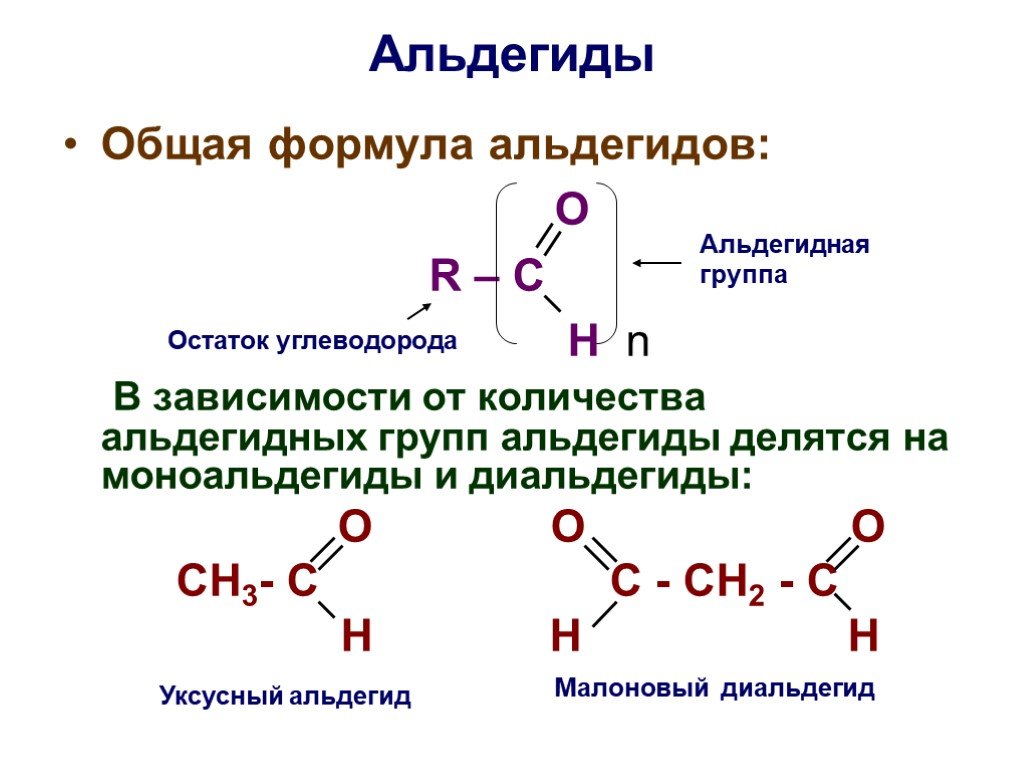
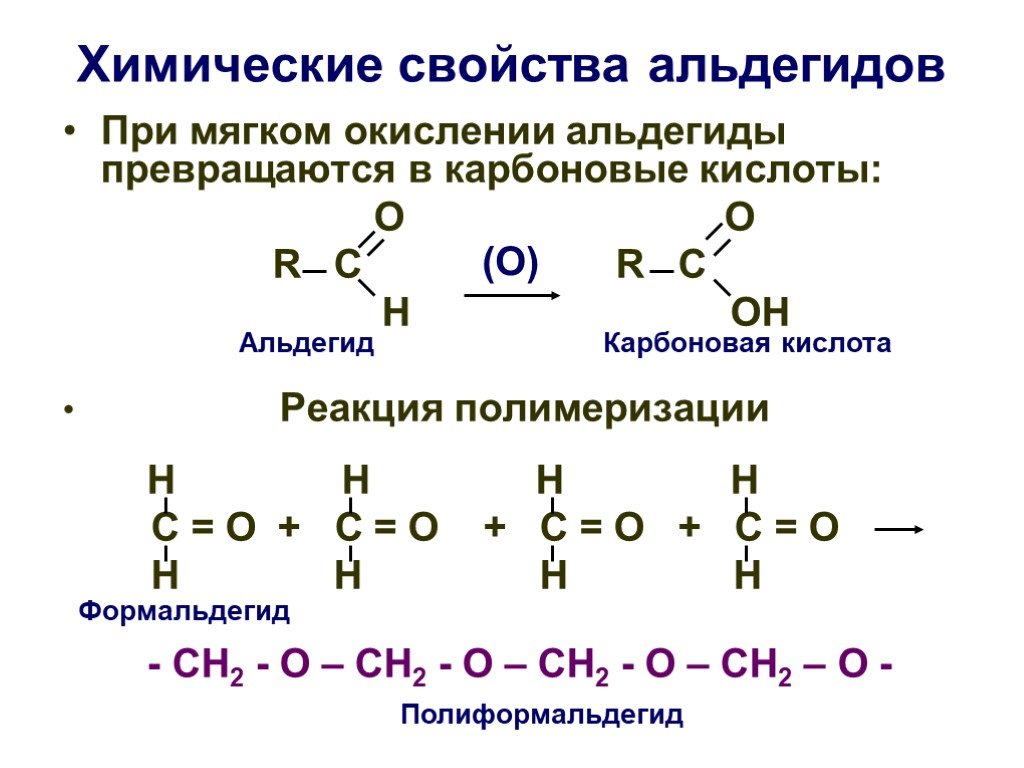
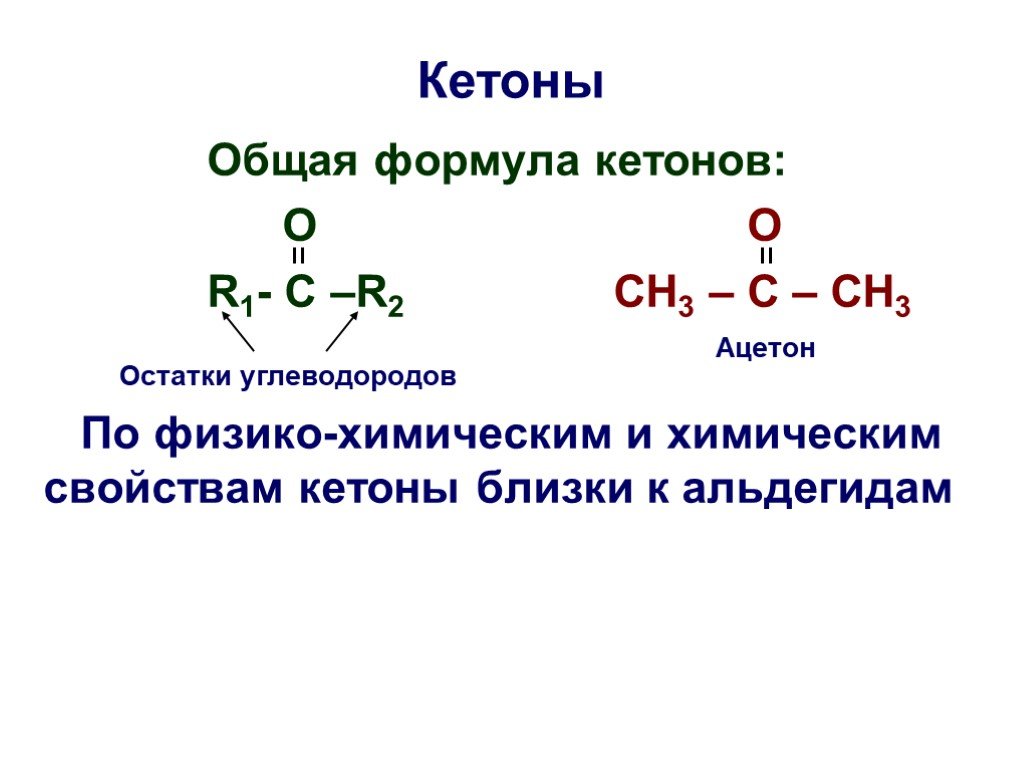
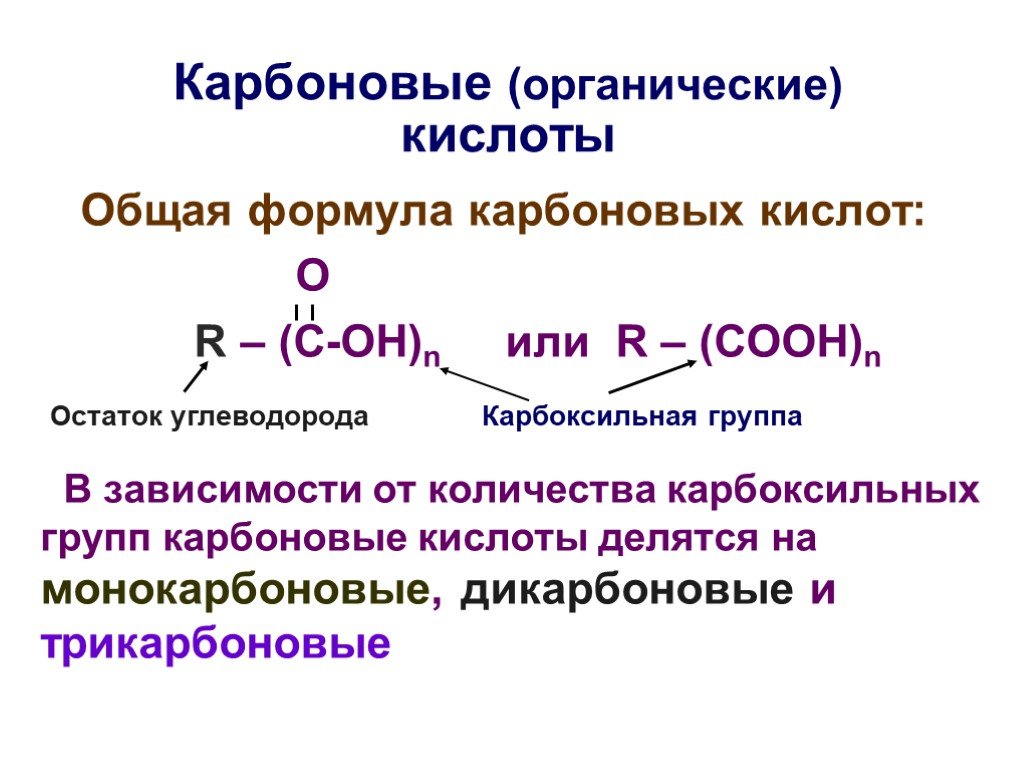
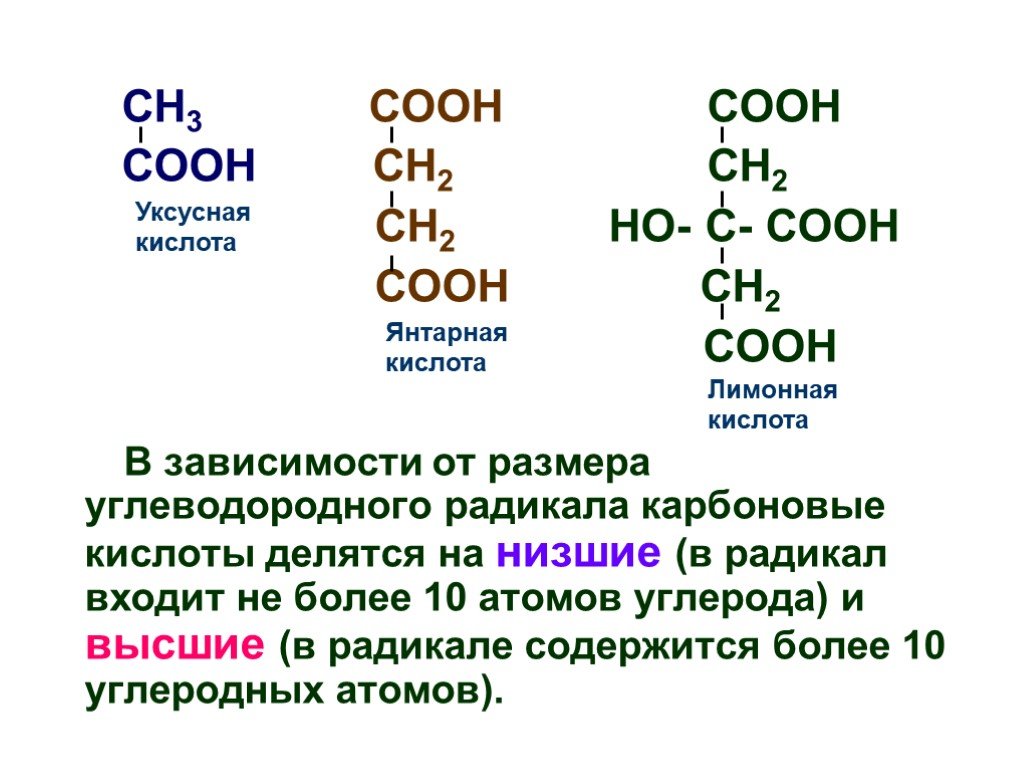
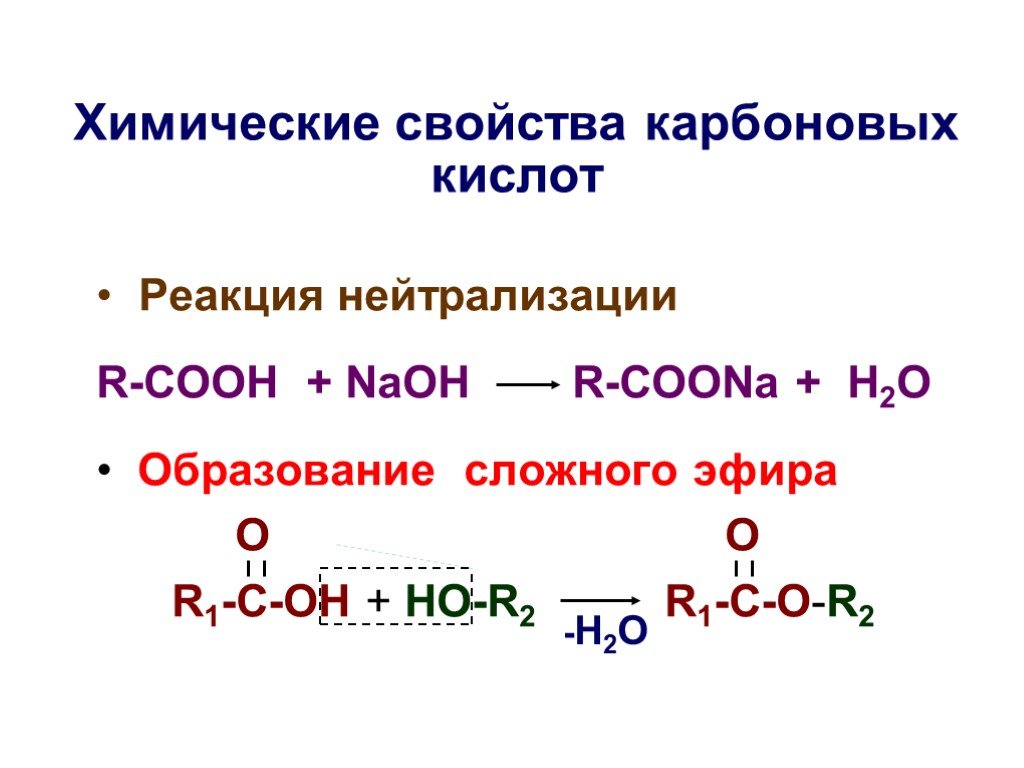
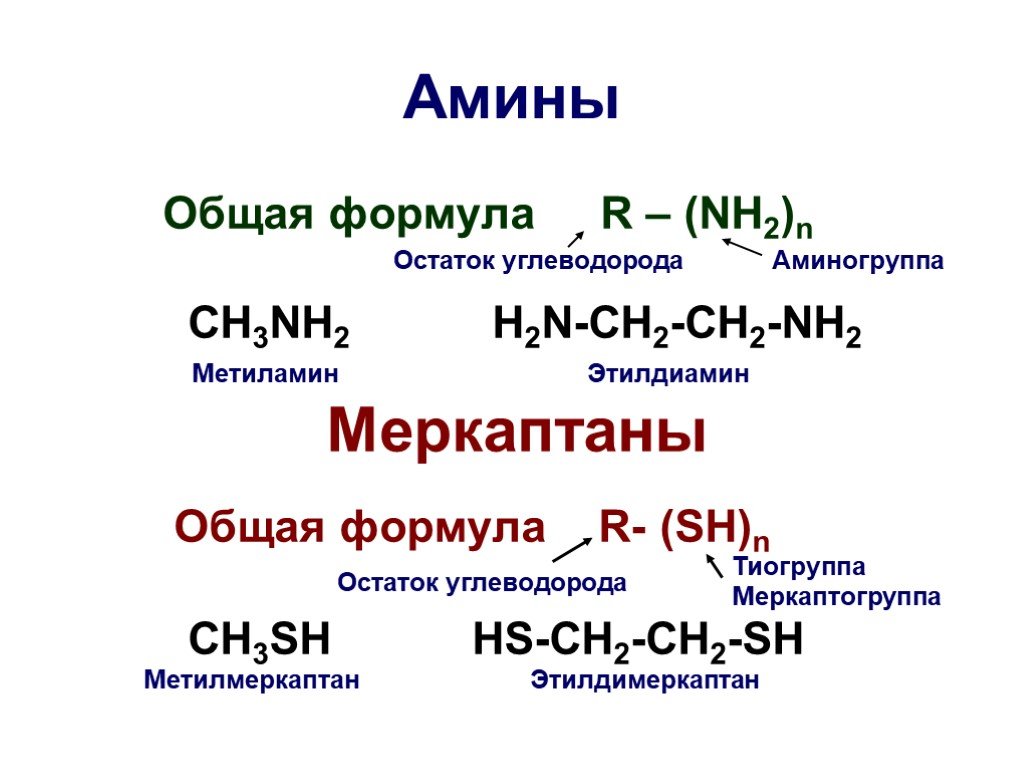
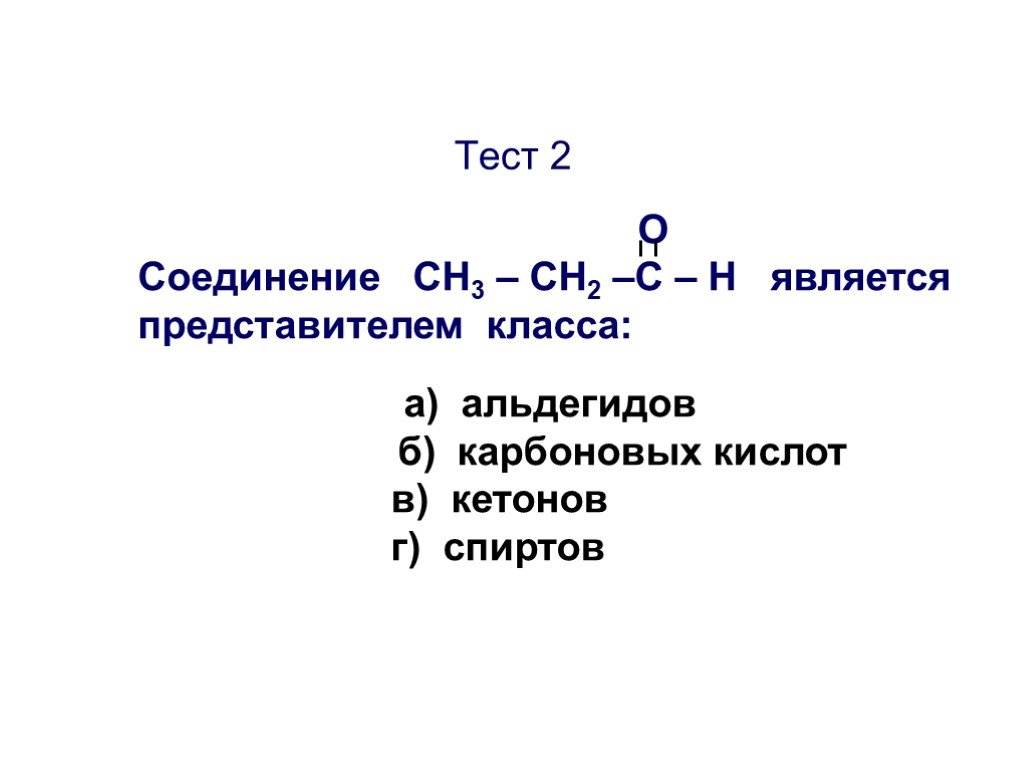
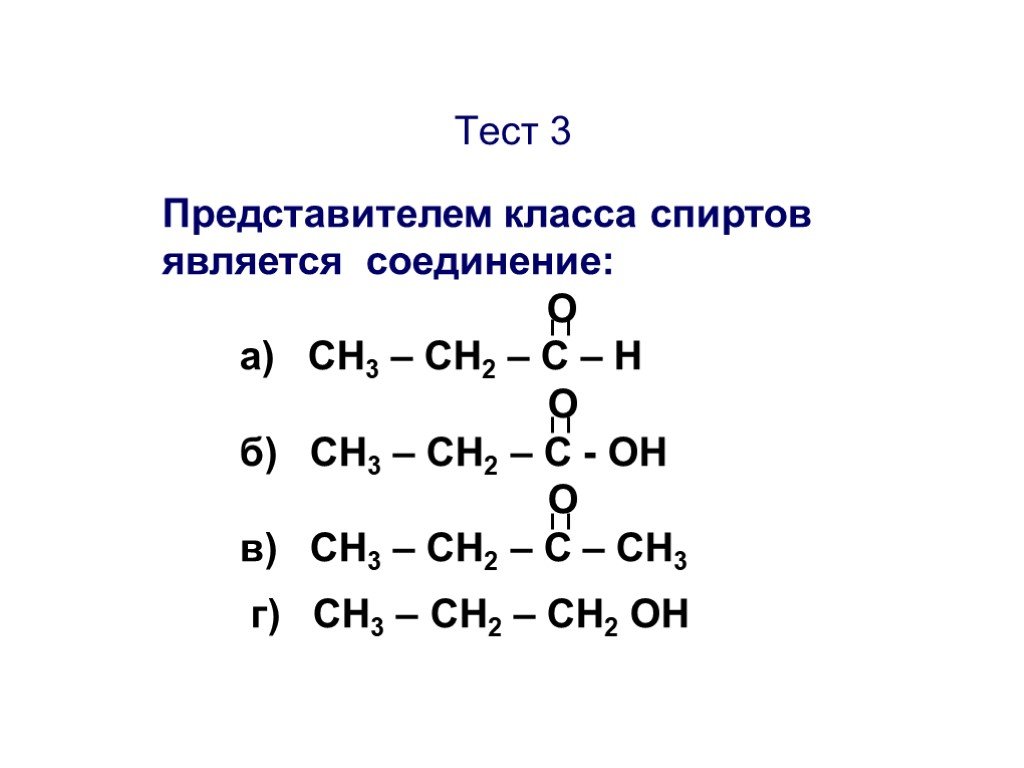
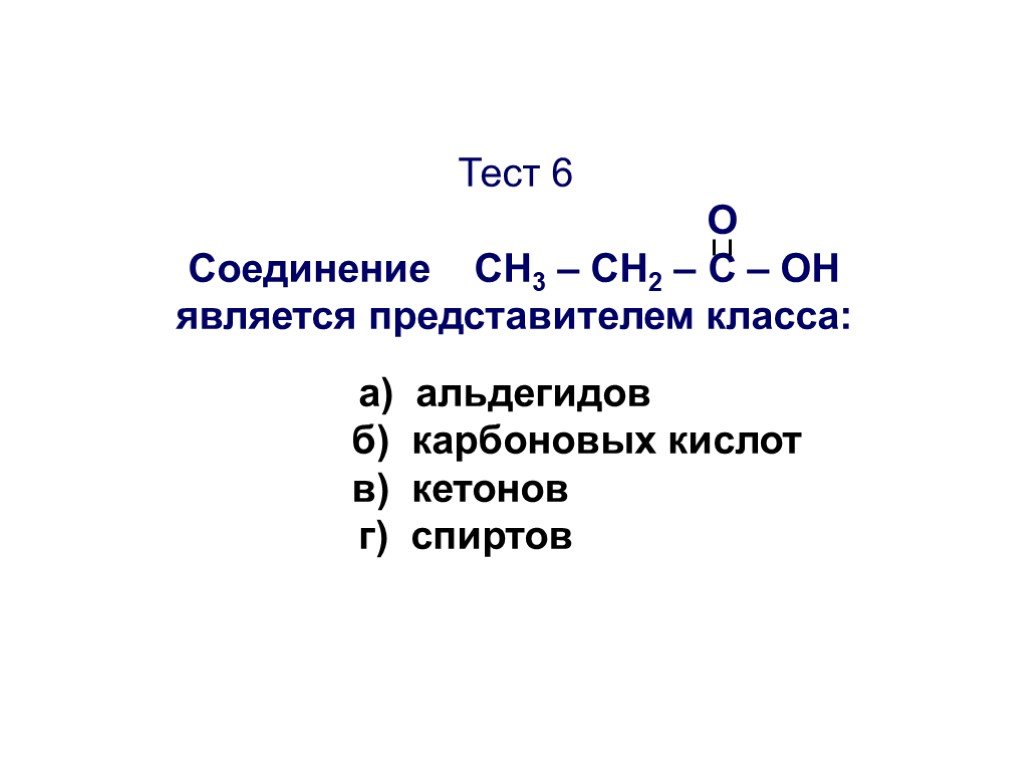
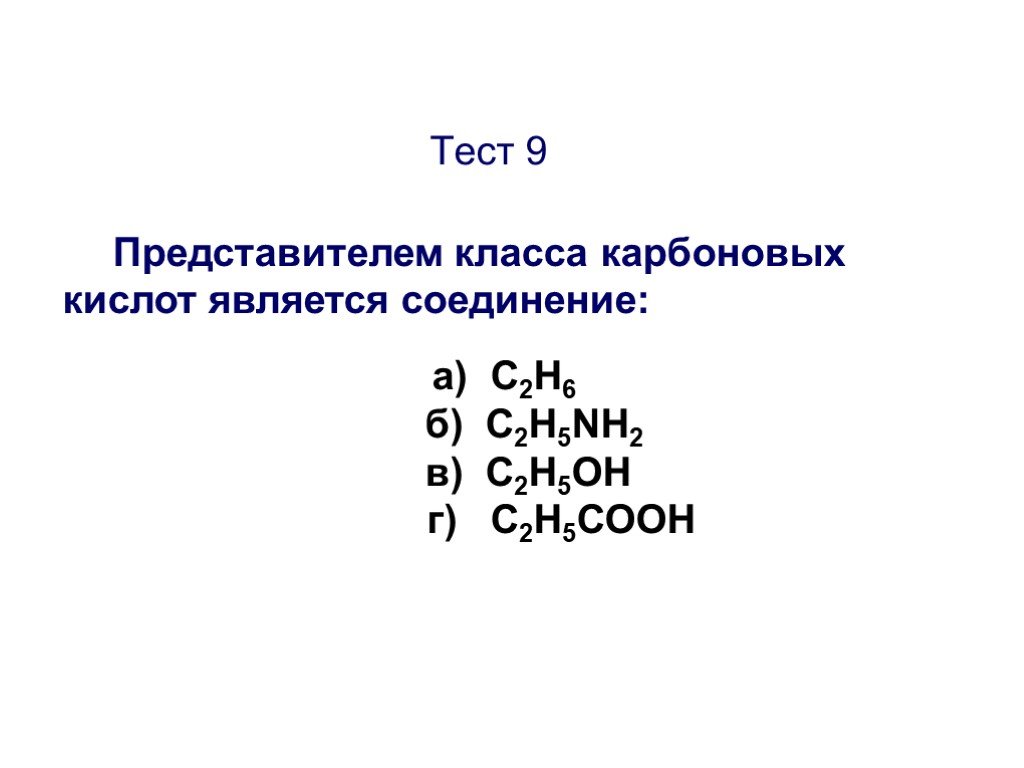
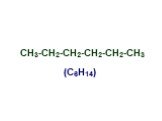
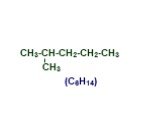
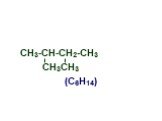
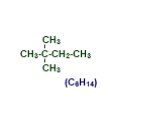
Презентация "Основы органической химии" – проект, доклад
Презентацию на тему "Основы органической химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 50 слайд(ов).
Слайды презентации
Список похожих презентаций
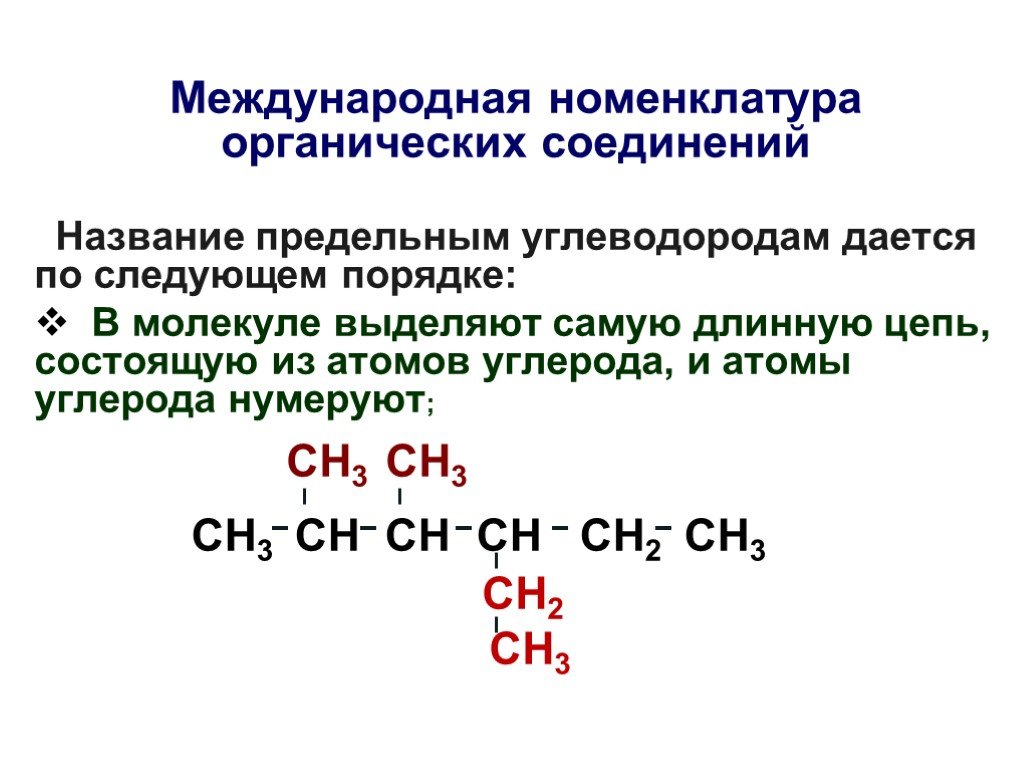
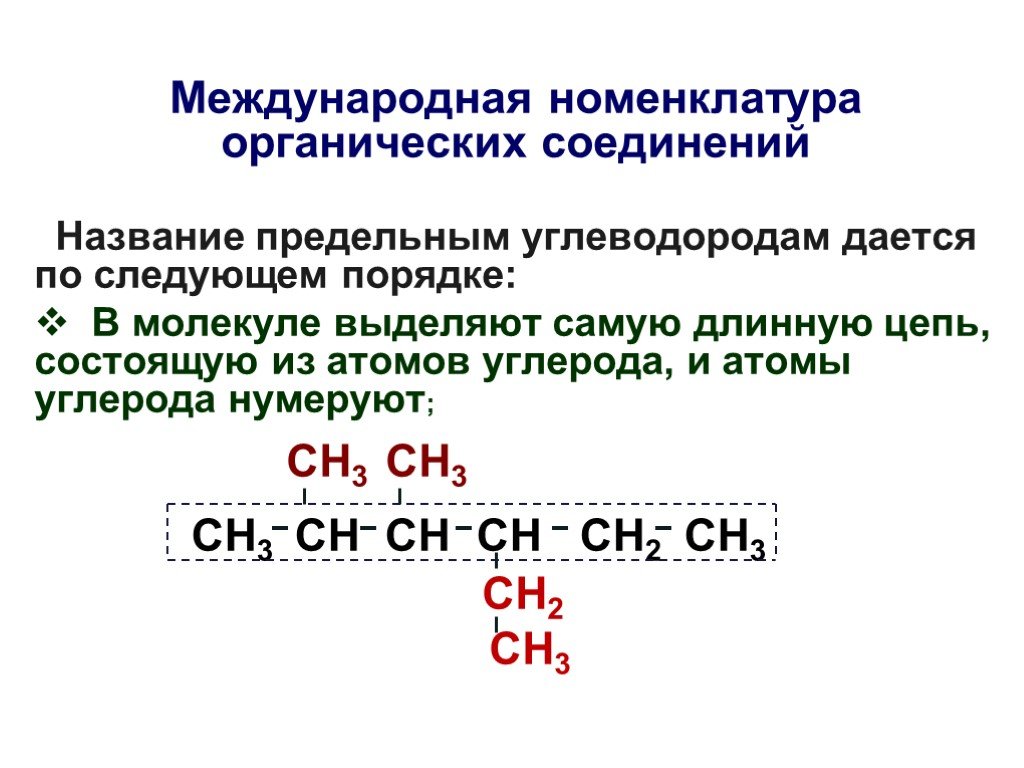
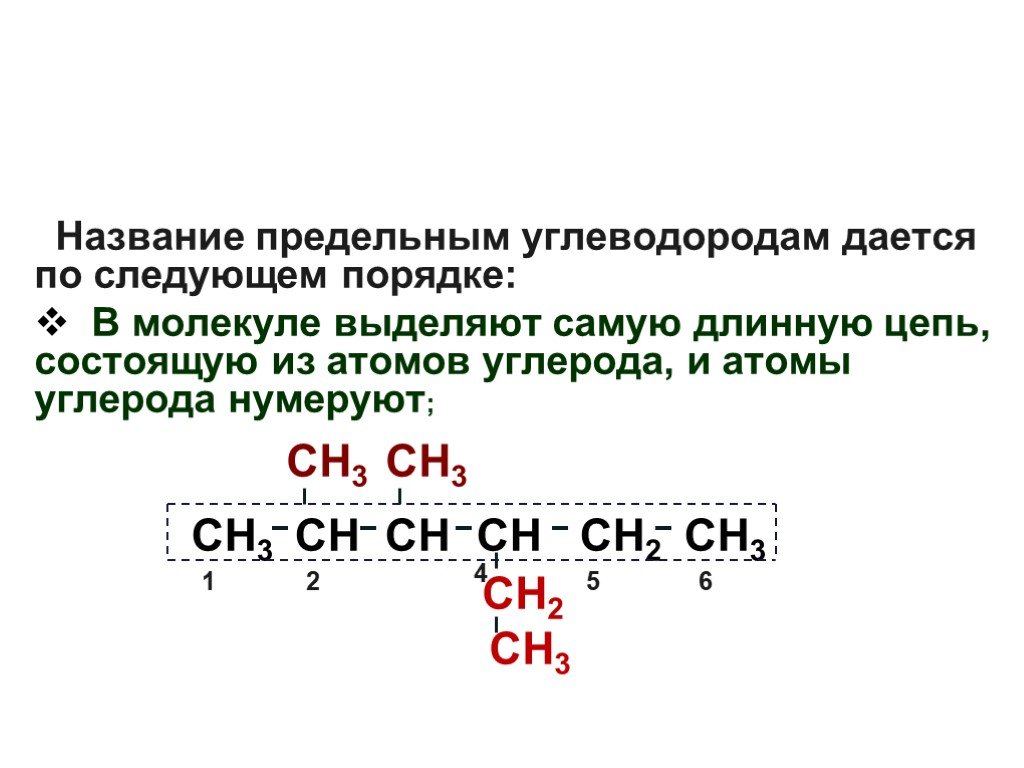
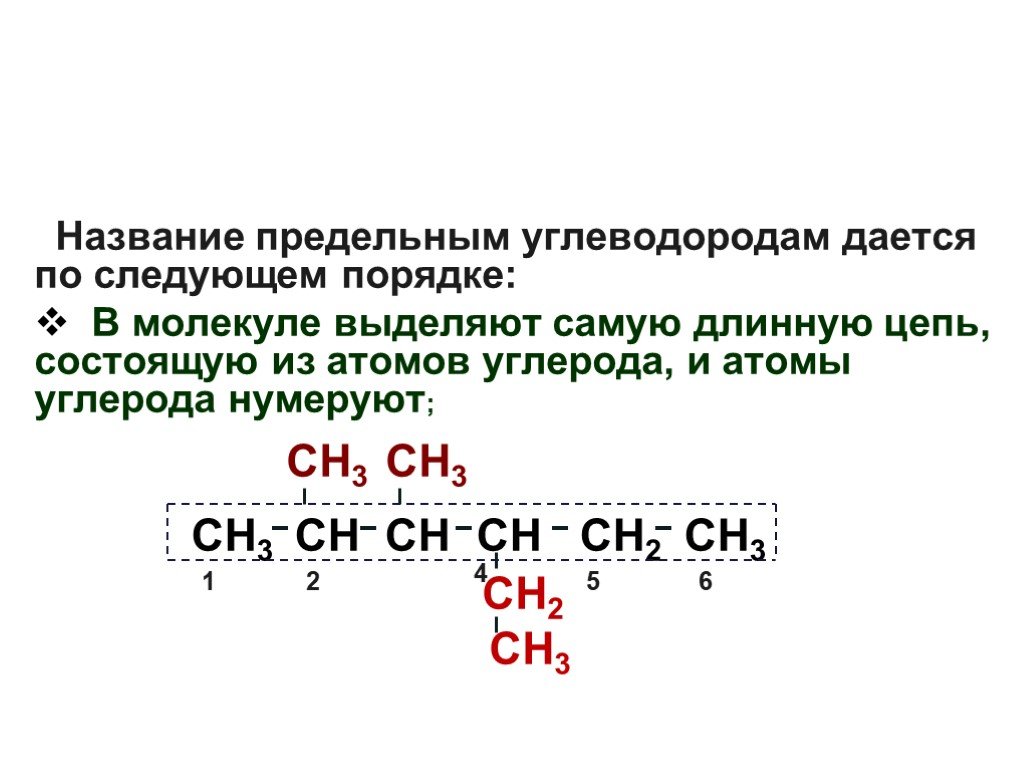
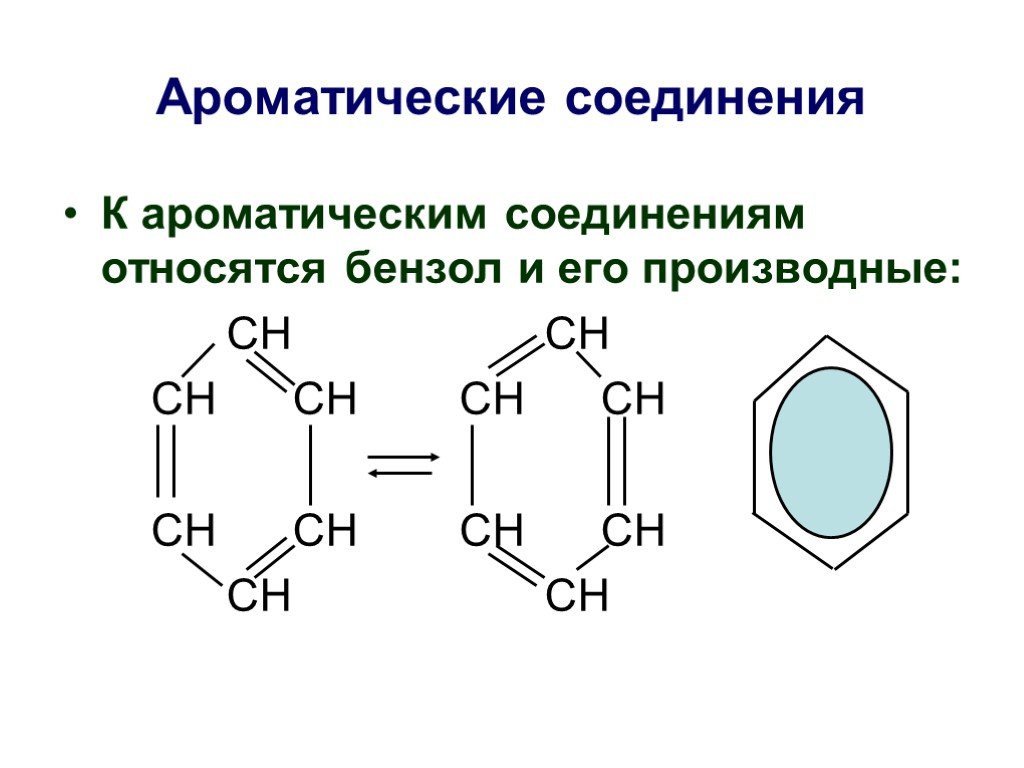
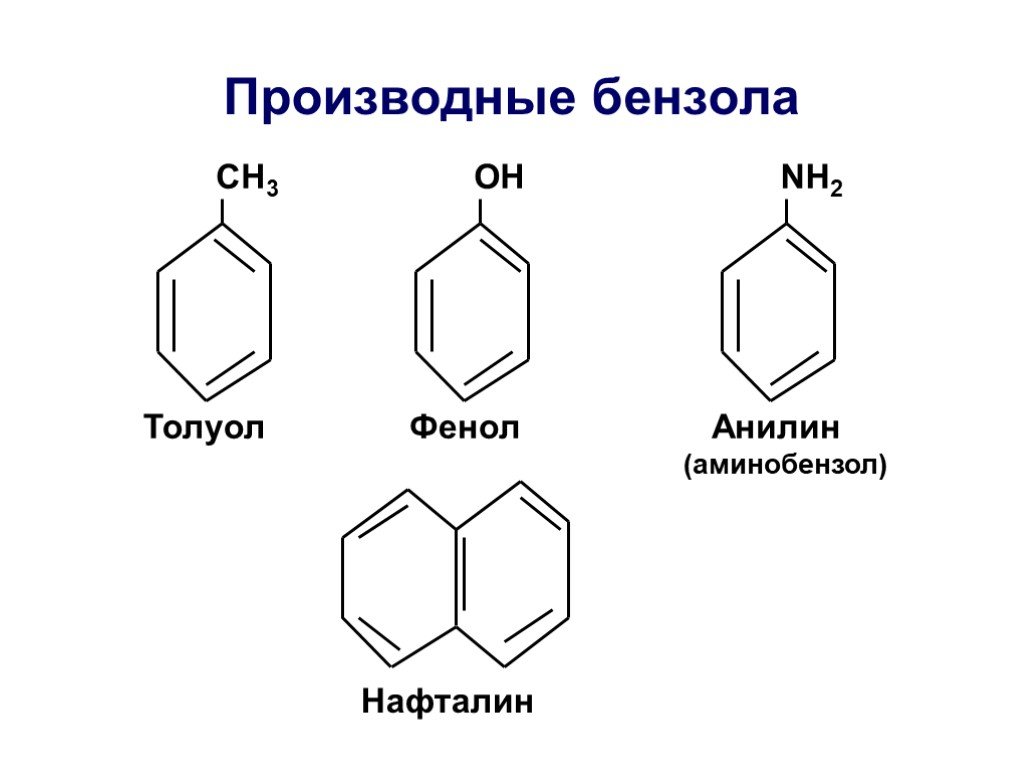
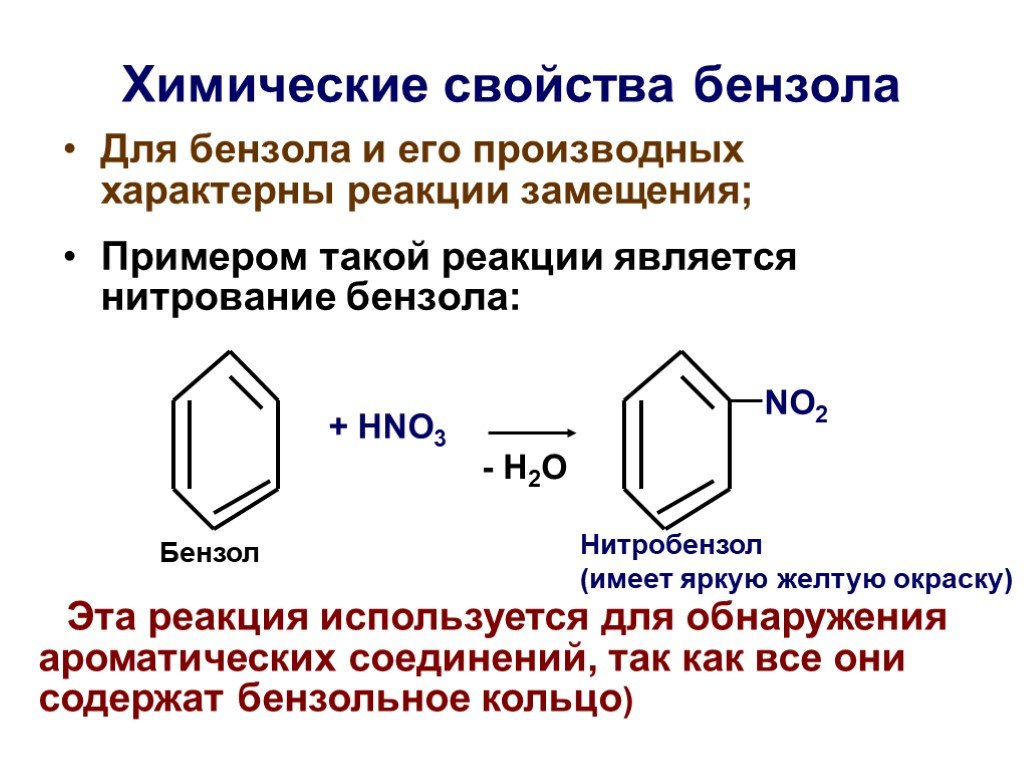
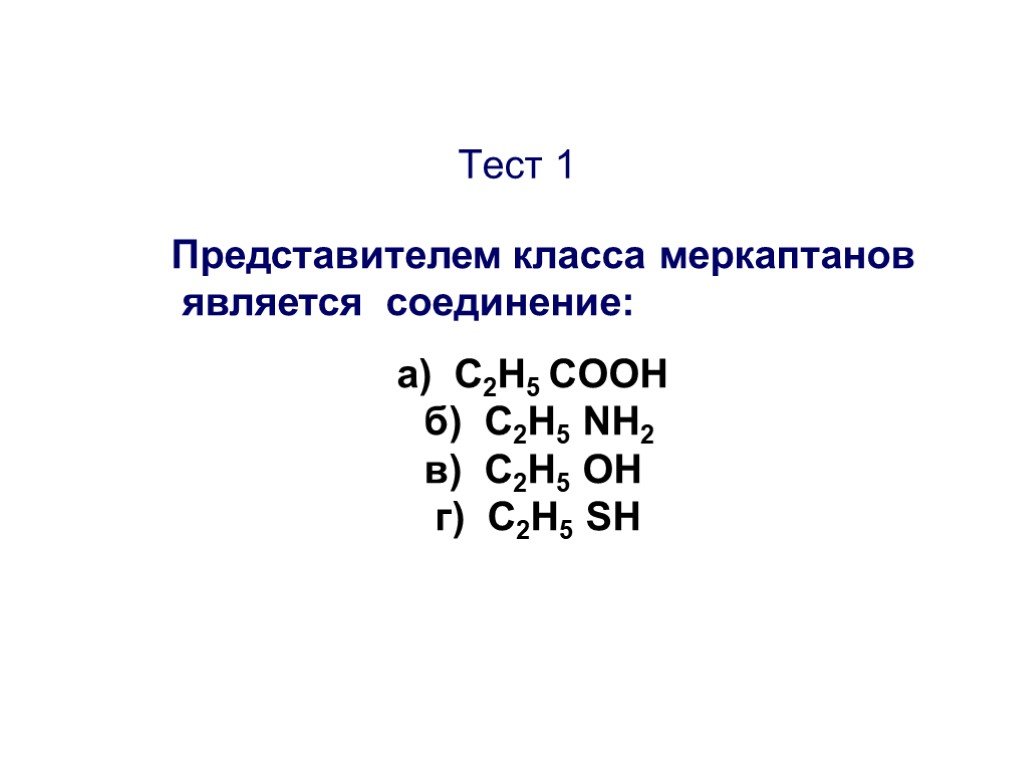
Основы органической химии
Cвойства металлоорганических соединений переходных элементов. МОС ПЭ С-Лиганд. Переходный металл. Открытия. N2 + 8H+ + 8e− + 16АТФ → 2NH3 + H2 + 16АДФ ...«Становление органической химии»
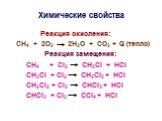
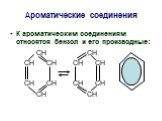
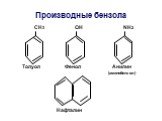
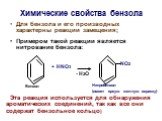
ОРГАНИЧЕСКАЯ ХИМИЯ. ОРГАНИЧЕСКАЯ ХИМИЯ – раздел химической науки, изучающий углеводороды – вещества, содержащие углерод и водород, а также различные ...ОВР в органической химии
Цель работы:. изучить и показать применение окислительно-восстановительных реакций в органической химии. Содержание. Степень окисления в органической ...ОВР в органической химии
Цель работы:. изучить и показать применение окислительно-восстановительных реакций в органической химии. Содержание. Степень окисления в органической ...Типы химических реакций в органической и неорганической химии
Классификация химических реакций. По числу и составу реагирующих и образующихся веществ (в неорганической химии). По числу и составу реагирующих и ...Урок химии предмет органической химии
Цель урока:. Сформировать понятие о предмете органической химии, рассмотреть особенности органических веществ. Познакомиться с понятием валентность. ...Реакции в органической химии
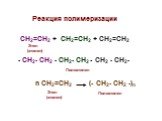
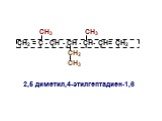
Важнейшие реакции в органической химии. Типы химических реакций по числу и составу реагирующих веществ. . Виды органических реакций. . . . . . ...Теория органической химии
Вот уже более 150 лет, слова Ф. Вёлера кажутся нам всё более правдивыми. Действительно, даже с нашими высокоразвитыми научными достижениями и технологиями ...Предмет органической химии. Классификация органических веществ
План. 1. Определение предмета орг. химии. 2. Признаки органических веществ. 3. Особенности углерода. 4. Виды ковалентной связи, тип гибридизации электронных ...Развитие органической химии
Цель:. Проследить эволюцию химических идей и представлений в период от предыстории до настоящего времени. Познакомиться с достижениями, современным ...Предмет органической химии. Органические вещества
Что изучает органическая химия? Какие вещества относят к органическим? Приведите примеры. Какую роль играют органические вещества в современной жизни? ...Предмет органической химии
План урока. Органические вещества. Валентность. Теория химического строения. Вопросы и задания. Д/З § 32, В.1,2,4. Органические вещества. Вещества. ...Классификация химических реакций в органической и неорганической химии
Цели урока: обобщить представления о химической реакции как о процессе превращения одного или нескольких веществ в другие вещества; рассмотреть классификацию ...Предмет органической химии
Происхождение веществ. Вещества животные растительные. землистые (минеральные). ОРГАНИЧЕСКИЕ НЕОРГАНИЧЕСКИЕ. ические вещества – вещества, созданные ...открытие органической химии
ОБЩАЯ ИНФОРМАЦИЯ. Белоруссия — государство в Восточной Европе. Граничит с Россией на востоке, Украиной на юге, Польшей на западе, Литвой и Латвией ...Качественные реакции в органической химии
Алканы. Качественная реакция на алканы: Определить, что какое-то вещество в смеси или в чистом виде алкан, несложно. Для этого газ либо поджигают ...Особенности базового курса органической химии издательства «ОЛМА»
Особенности курса. Уникальная структура параграфов Двухуровневость материала учебника Плашка «Выводы» - квинтэссенция изученного материала Раздел ...Химические реакции в органической химии
Тест Напиши формулы углеводородов:. 1. Бутан 6. Метан 2. Этан 7. Гексан 3. Нонан 8. Декан 4. Гептан 9. Октан 5. Пропан 10. Пентан. Реакции горения:. ...Роль органической химии в жизни человека
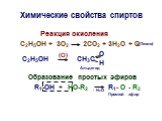
Органические вещества. Одни органические вещества известны человеку многие десятки лет, другие находятся на стадии изучения, а третьи только еще ...Значение органической химии
Значение органической химии чрезвычайно велико. Оно обусловлено той исключительной ролью , какую играют в жизни человека органические вещества. Белки, ...Конспекты
Предмет органической химии. Взаимосвязь живой и неживой природы
Интегрированный урок химия + биология «Предмет органической химии. Взаимосвязь живой и неживой природы». Ход урока. Организационный момент :. ...Обобщающее повторение по неорганической химии
Обобщающее повторение по неорганической химии за курс 8 класса. Разработан Савич Еленой Николаевной учителем биологии, химии Донецкой СШ с. Донецкое, ...Предмет органической химии. Особенности строения органических веществ
Муниципальное бюджетное образовательное учреждение. . «Аргуновская средняя общеобразовательная школа». Никольский район. Вологодская область. ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. . «СОШ № 68 с углублённым изучением русского языка и математики». . г. Оренбурга. ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. Орловская средняя общеобразовательная школа №3. Открытый урок. по теме «Предмет ...Именные реакции в органической химии
Урок обобщения: "Именные реакции в органической химии" 10 класс. Максимова И.Н. учитель химии и биологии. . МБОУ «Среднекибечская СОШ» Канашского ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Основы химического анализа
Муниципальное образование. . «Ленский район». Конспект урока для 9 класса. «Основы химического анализа. ». . ...Основы химических методов исследования вещества
Программа факультативного курса по химии. «Основы химических методов исследования вещества». Разработала:. . учитель химии МБОУ средней общеобразовательной ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 ноября 2018
Категория:Химия
Содержит:50 слайд(ов)
Поделись с друзьями:
Скачать презентацию