Презентация "Свойства спиртов" по химии – проект, доклад
Презентацию на тему "Свойства спиртов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 42 слайд(ов).
Слайды презентации
Список похожих презентаций
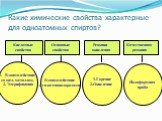
Химические свойства и получение насыщенных одноатомных спиртов
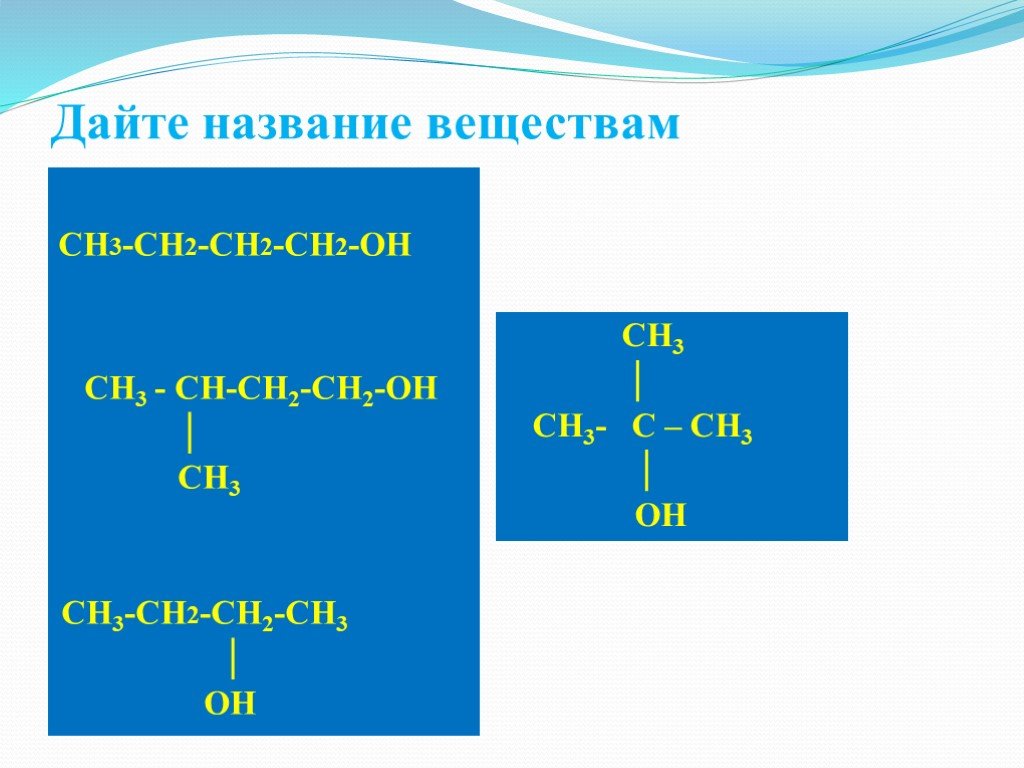
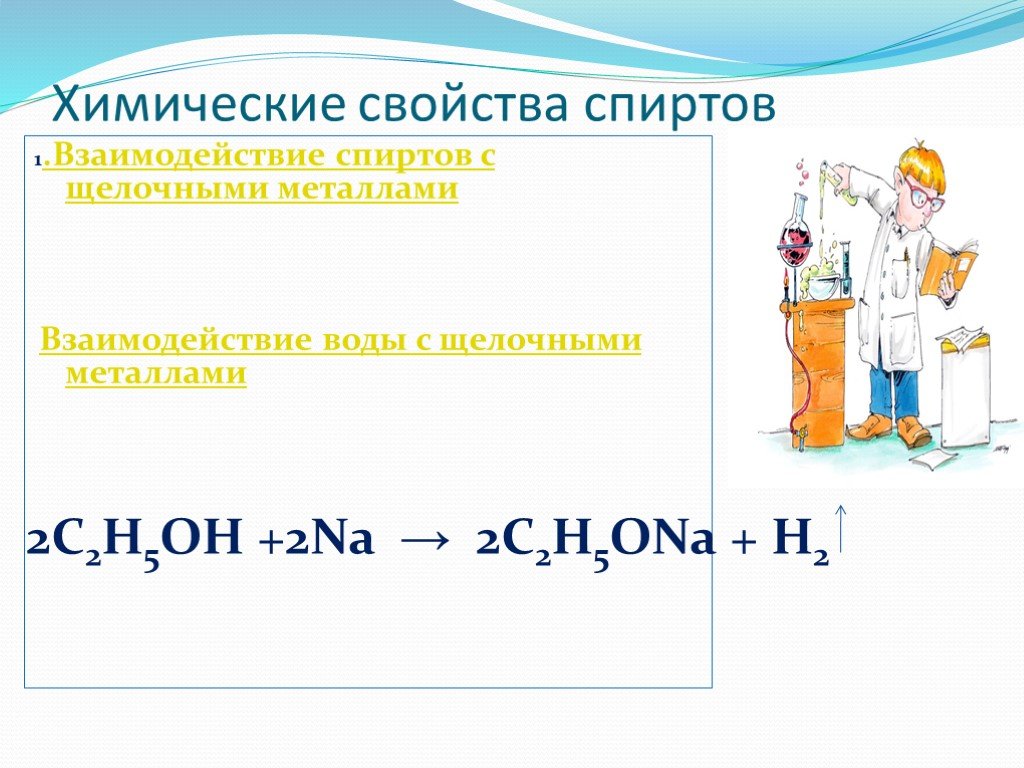
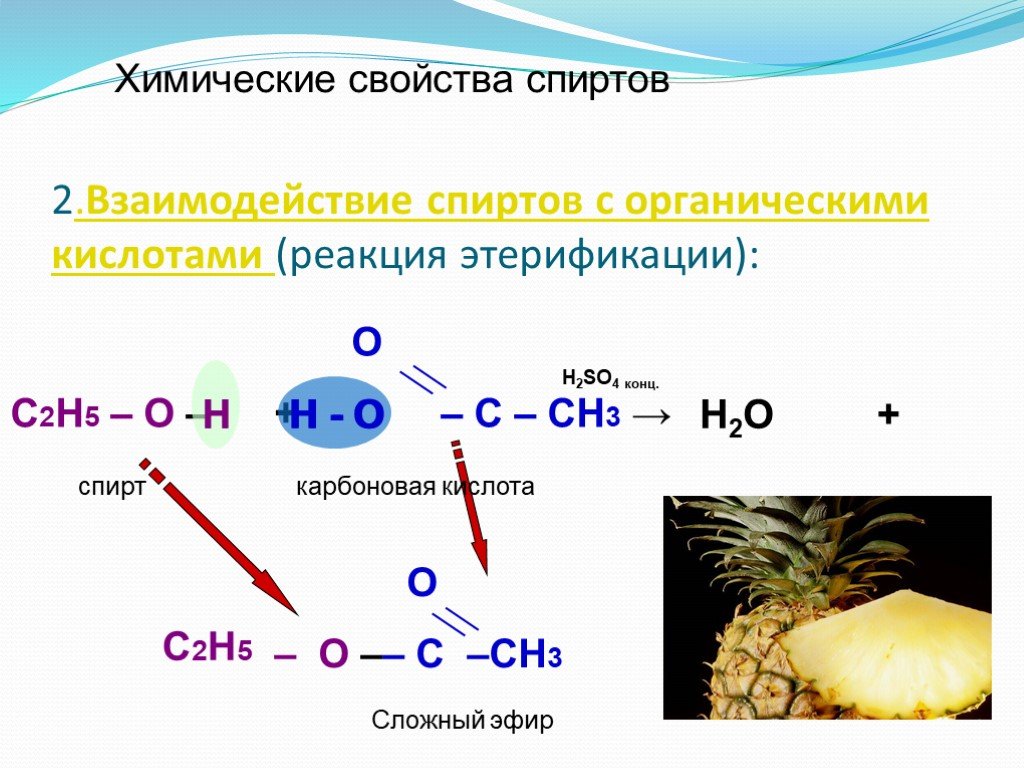
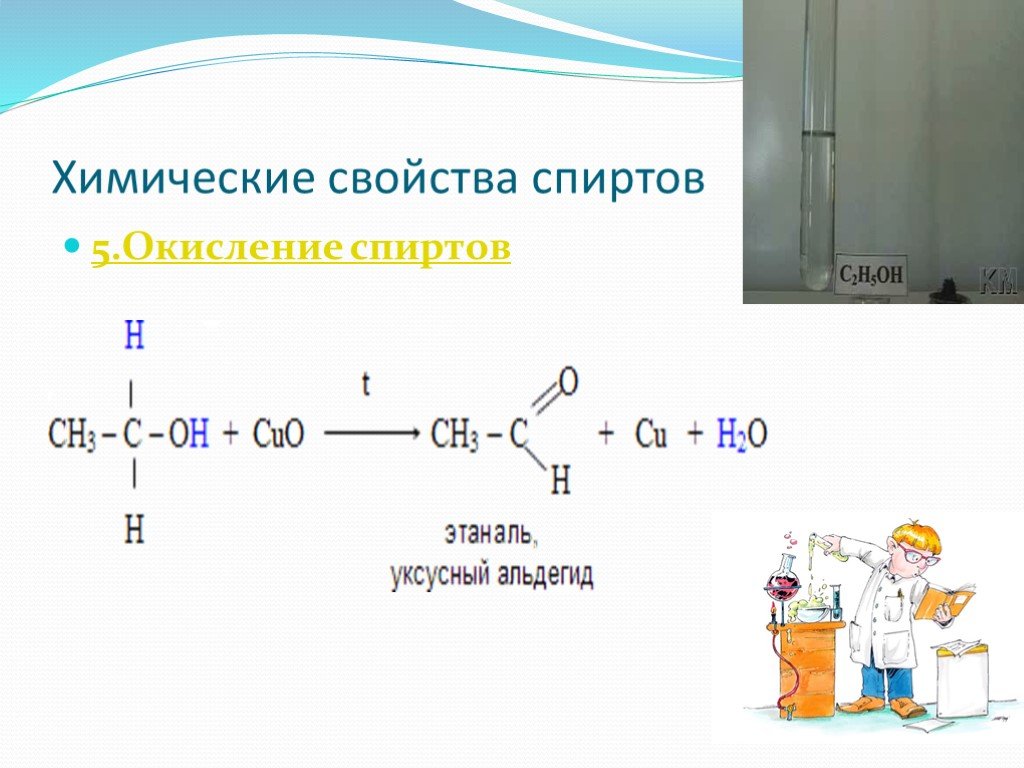
Проверка домашнего задания Упражнение 5б. 1 2 3 Н3С – СН – СН3 1) | ОН 4 3 2 1 Н3С – СН2 – СН – СН2ОН 2) | СН3 ОН 1 2 3| 3) Н3С – СН2 – СН 4| 5 СН2 ...Химические свойства спиртов
Подумай и запиши! Из названных веществ: этандиол, бутанон, этанол, пропаналь, пропантриол, 3-метилбутанол-1 выберите: девочки – многоатомные спирты, ...Свойства многоатомных спиртов
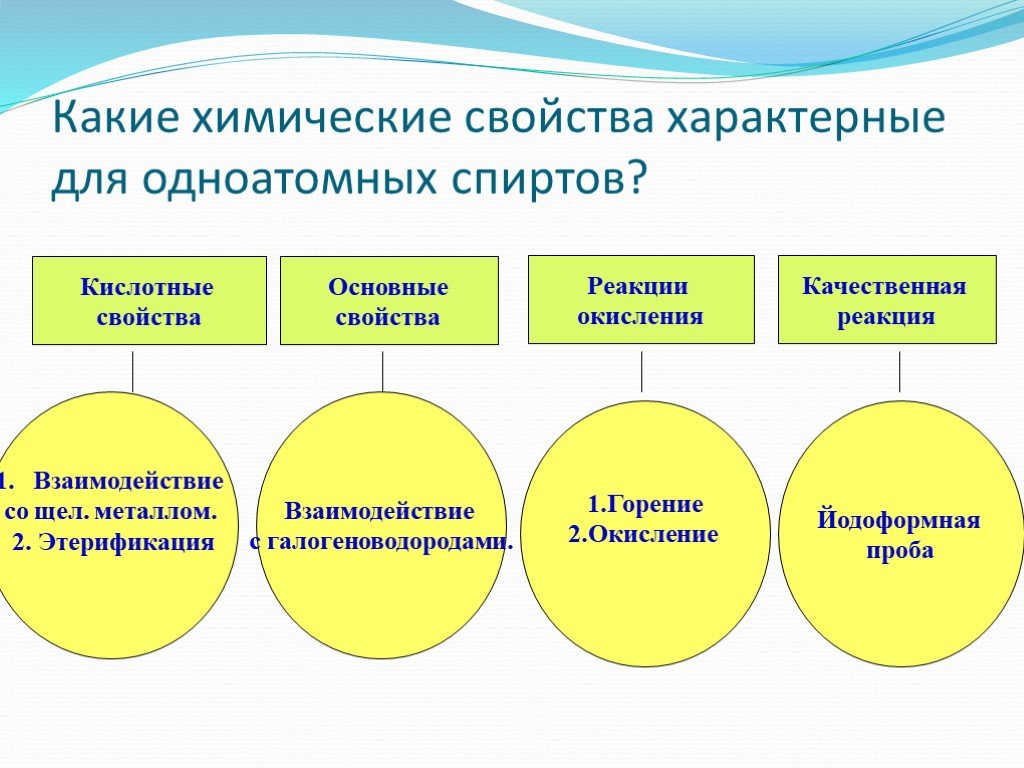
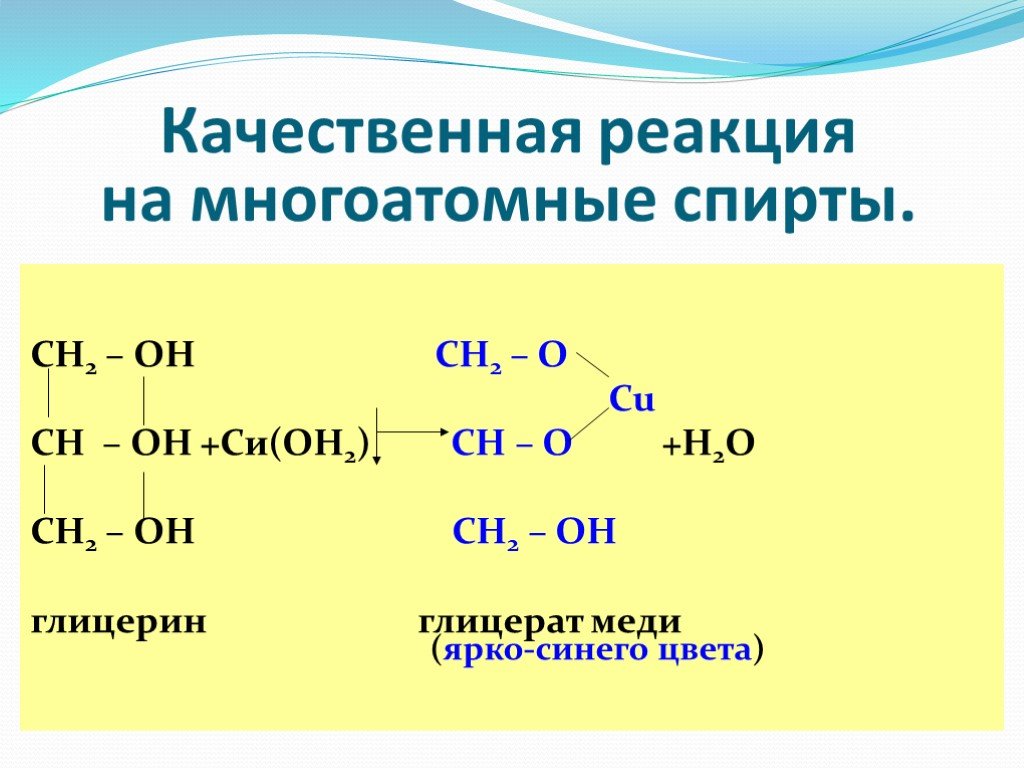
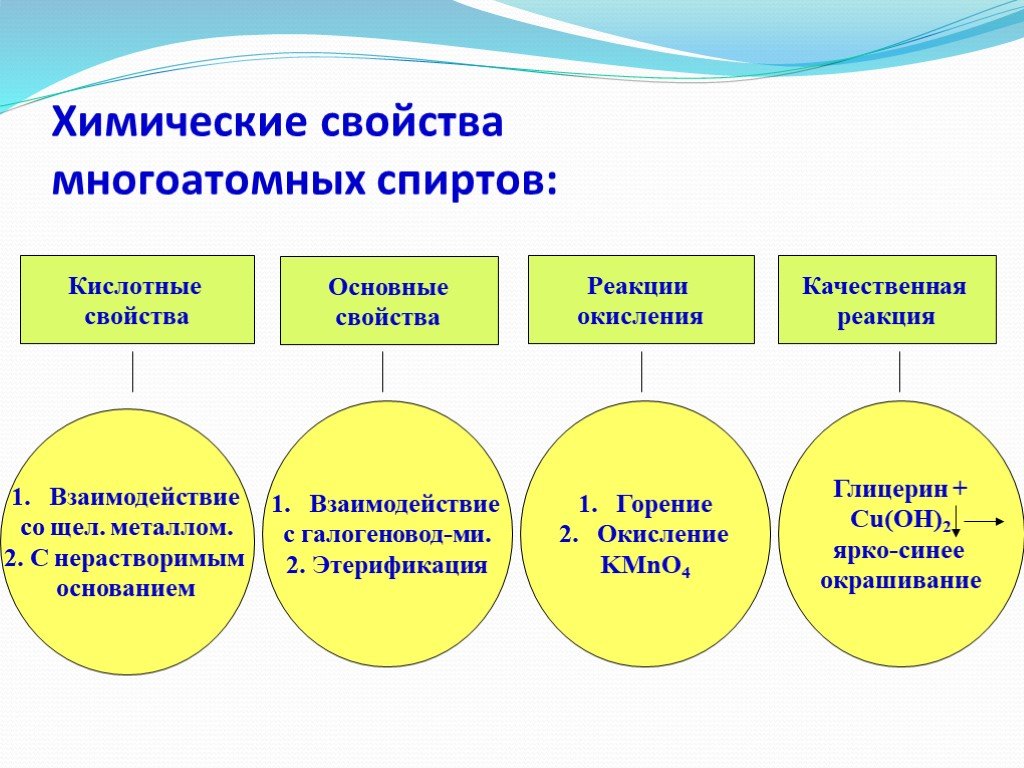
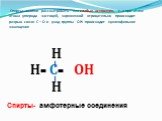
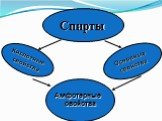
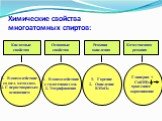
Содержание. Определение Физические свойства Номенклатура Химические свойства с активными металлами, оксидами активных металлов, с галогеноводородами, ...Химические свойства многоатомных спиртов
ХИМИЧЕСКИЕ СВОЙСТВА ГЛИКОЛЕЙ АНАЛОГИЧНЫ СВОЙСТВАМ ОДНОАТОМНЫХ СПИРТОВ. ОДНАКО У ГЛИКОЛЕЙ МОГУТ ВСТУПАТЬ В РЕАКЦИИ КАК ОДНА, ТАК И ОБЕ ГИДРОКСИЛЬНЫЕ ...Токсичность спиртов
Токсичность спиртов Токсичность возрастает с увеличением числа атомов углерода, примерно 3:1 (правило Ричардсона). Исключением является поведение ...Свойства черных и цветных металлов
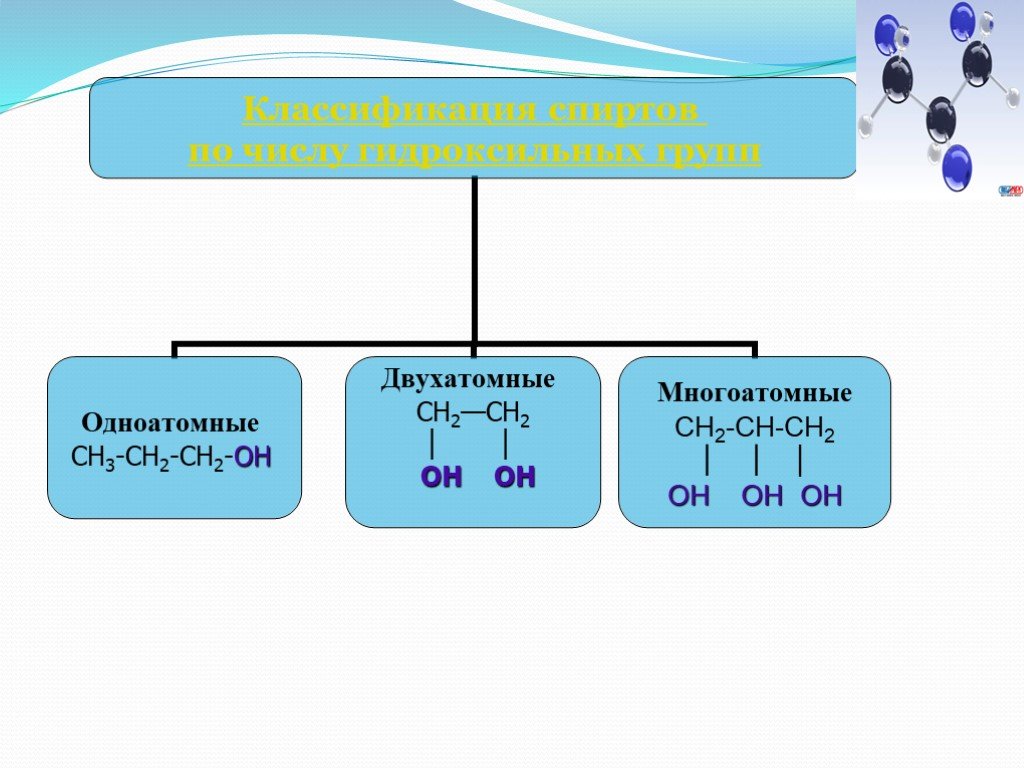
Что такое металлы и сплавы? Металл — это вещество, обладающее ярким блеском и хорошей проводимостью тепла и электричества. Сплав — макроскопически ...Спирты. Состав, классификация, изомерия спиртов
Тесты. 1.Химический элемент, образующий «скелет» любого органического вещества. а) азот б) углерод в) водород г) кислород 2. С каждым из указанных ...Свойства серы
Сера известна человечеству с древних времен, т. к. она в природе встречается в самородном виде. Считалось, что голубое пламя и запах, распространяемый ...Свойства уксусной кислоты
Немного истории... Уксус является продуктом брожения вина. Первое упоминание о его практическом применении относится к третьему веку до н. э. Греческий ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Свойства простых веществ
Металл + Неметалл = Оксид. Составьте уравнения реакций лития, кальция, алюминия с кислородом. 4Li + 2O2 = 2Li2O 2Ca + O2 = 2CaO 4Al + 3O2 = 2Al2O3. ...Свойства алюминия
План урока:. 1. Почему алюминий так нужен человеку? 2. Алюминий как химический элемент: а) положение в периодической системе и строение атома; б) ...Свойства неньютоновских жидкостей. Секреты умного пластилина
Жидкость в окружающем нас мире встречается повсеместно. Свойства жидкостей знакомы каждому и любой человек, взаимодействующий с ними в той или иной ...Свойства
История открытия металлов. Каменный век Медный век (IV – III тысячелетия до н.э.) Бронзовый век (конец IV – начало I тысячелетия до н.э.) Железный ...Свойства альдегидов, их применение.
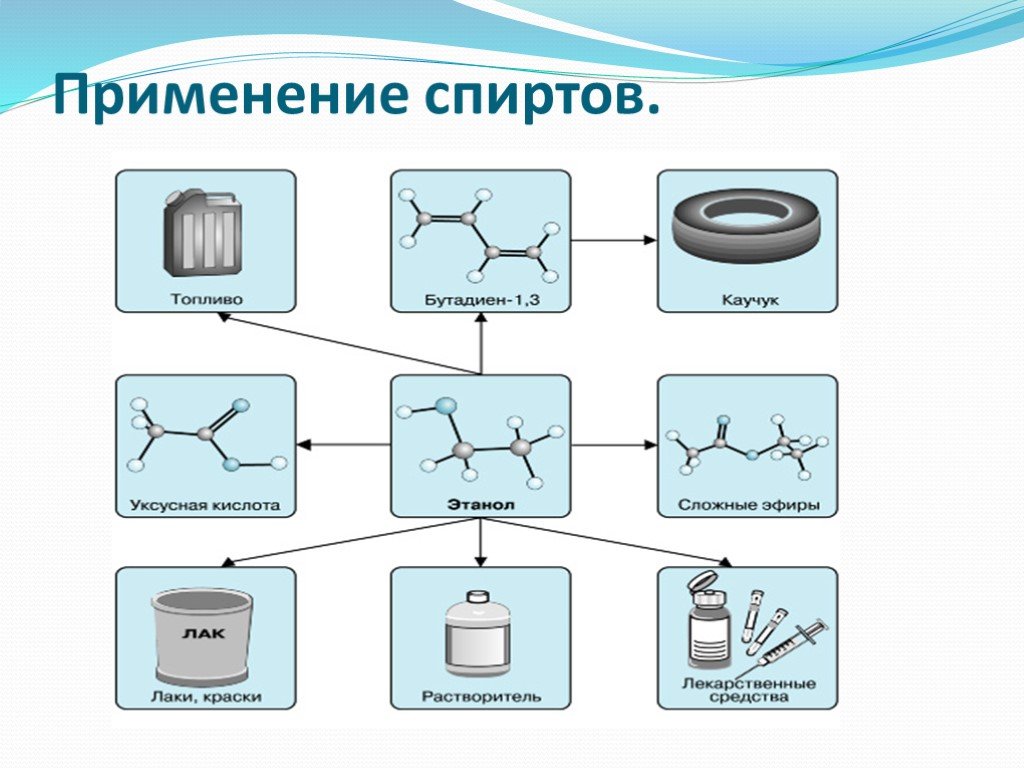
Цели урока:. Изучить химические свойства альдегидов. Познакомить учащихся с применением формальдегида и ацетальдегида на основе их свойств. Развивать ...Применение спиртов
Используются в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов. Метанол СН3ОН. Используют как ...Применение спиртов
Применение. На многих производствах спирты применяются в качестве растворителей . В химической промышленности они используются для различных синтезов ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Кислоты. Классификация. Свойства
Определение. КИСЛОТЫ-это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. Названия распространенных кислот. ...Свойства основных классов неорганических соединений
Вещества Простые Неорганические Органические Сложные Оксиды Соли Гидроксиды Кислоты Основания. Молекулы простых веществ состоят из атомов одного элемента. ...Конспекты
Физические и химические свойства спиртов
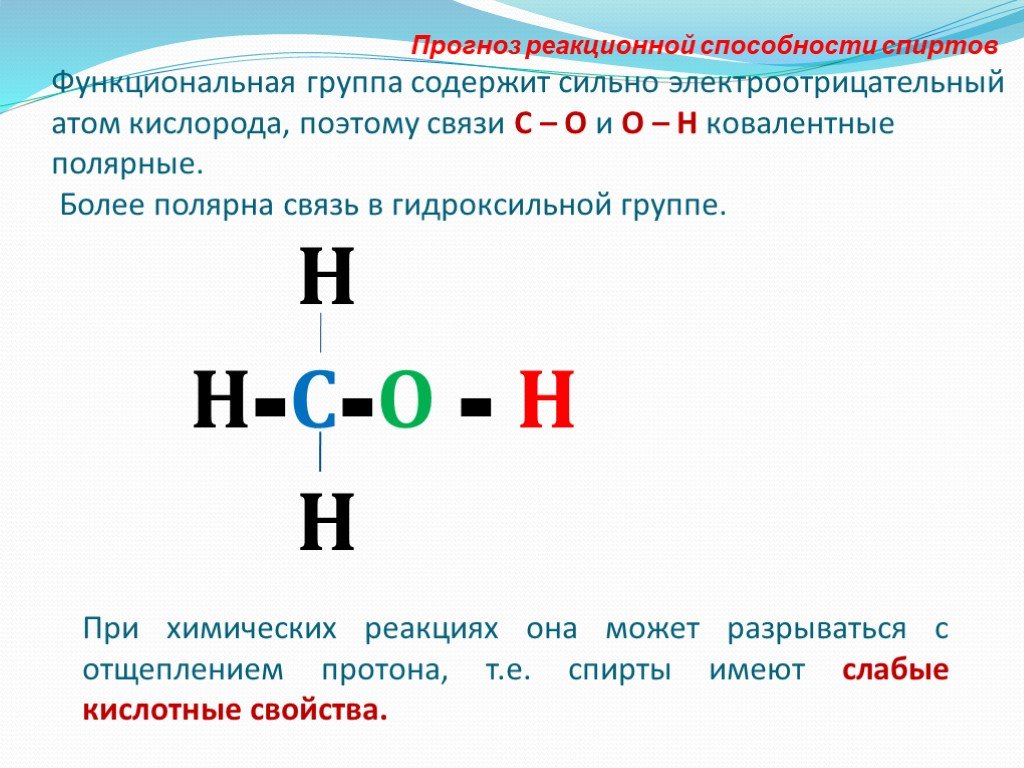
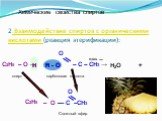
Физические и химические свойства спиртов . Урок открытия новых знаний и построения системы знаний Класс 10. . Цели урока:. - доказать, что химические ...Химические свойства предельных одноатомных спиртов
МОУ « Лицей № 47» г. Саратов. . Никитина Надежда Николаевна - учитель химии. ПОДГОТОВКА К ЕГЭ ( 10, 11 класс). Лекция по теме: Химические свойства ...Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение
Дата_____________ Класс_______________. Тема:. Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. ...Спирты, их строение, номенклатура, физические и химические свойства спиртов
Тема:. «Спирты, их строение, номенклатура, физические и химические свойства спиртов». . Цели. :. Знать строение, номенклатуру, физические и химические ...Химические свойства одноатомных спиртов
ПЛАН-КОНСПЕКТ. . урока химии (2 часа). Химические свойства одноатомных спиртов . Урок открытия новых знаний и построения системы знаний. ...Спирты Действие спиртов на организм человека
Конспект урока по химии в 10 классе. . Валеева Елена Николаевна,. . учитель химии. первой квалификационной категории. МБОУ «Гимназия №32». ...Сера. Положение в ПСХЭ. Свойства серы
9 класс. Урок 3. Тема:. «Сера. Положение в ПСХЭ. Свойства серы». Цель:. . Образовательная:. актуализация и обобщение знаний учащихся о сере ...Свойства углеводородов
9. . . Серебрянская Нелля Александровна. Учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Аннотация ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Свойства растворов электролитов
"Свойства растворов электролитов". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 сентября 2018
Категория:Химия
Содержит:42 слайд(ов)
Поделись с друзьями:
Скачать презентацию