Презентация "Свойства многоатомных спиртов" по химии – проект, доклад
Презентацию на тему "Свойства многоатомных спиртов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
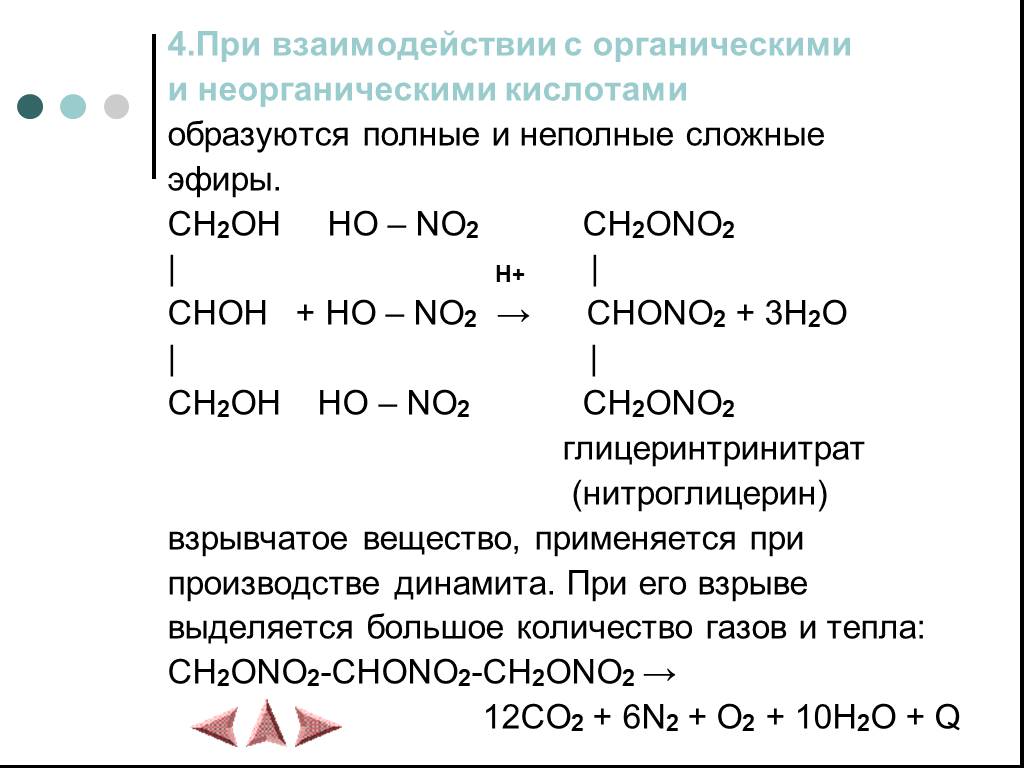
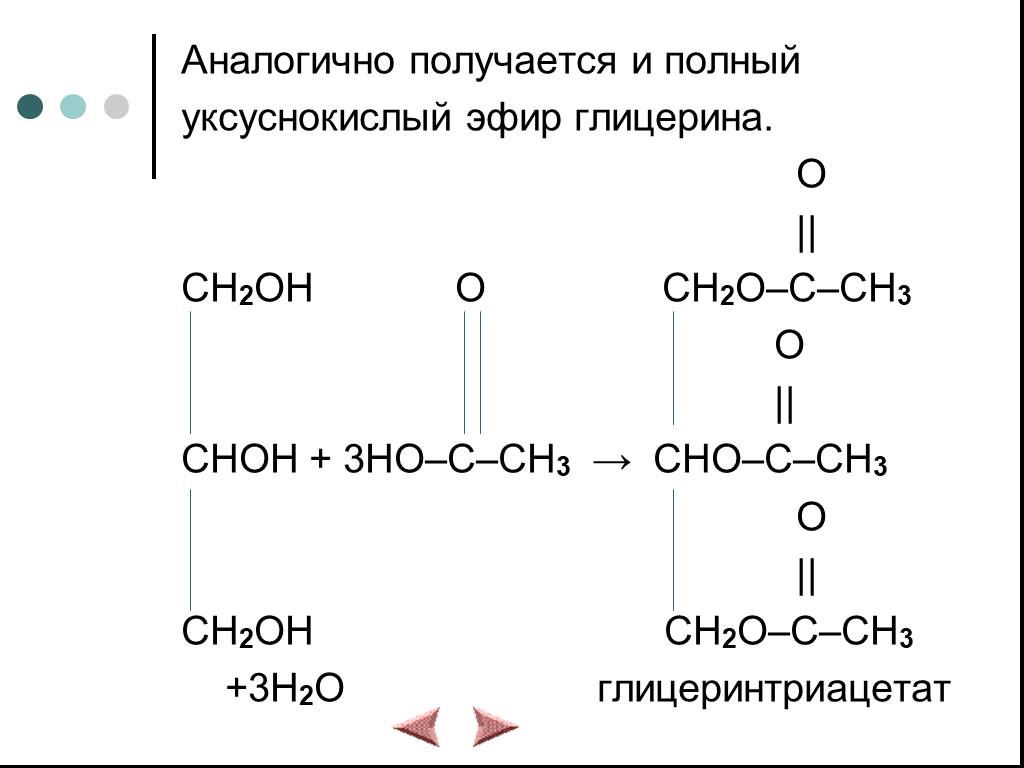
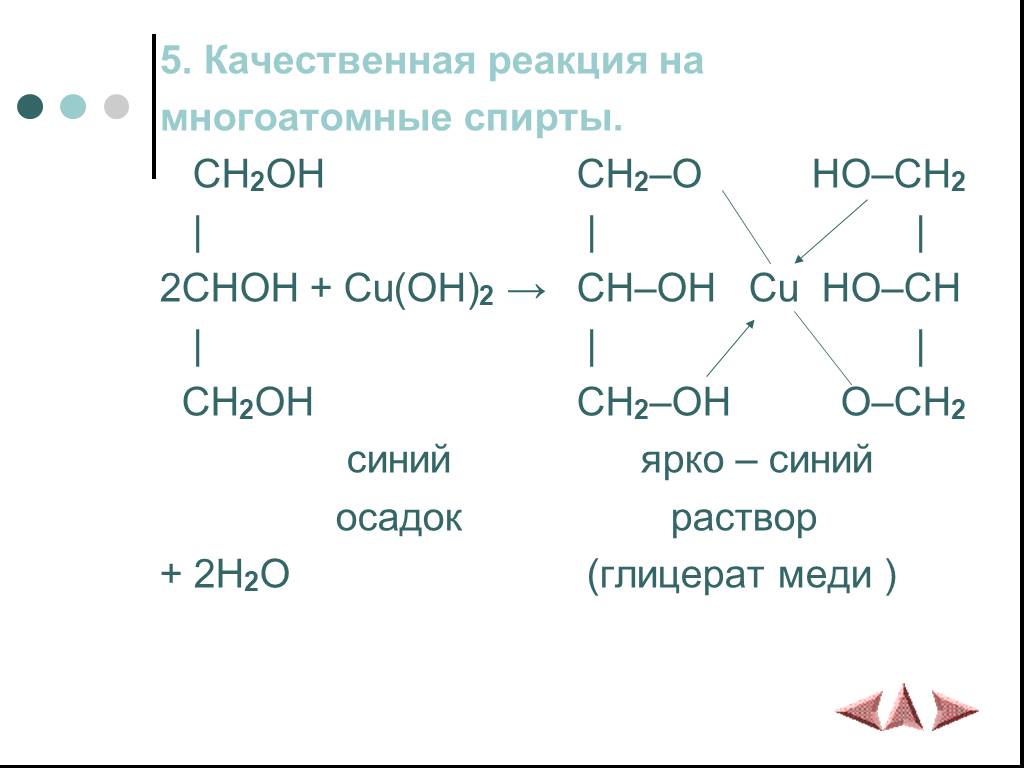
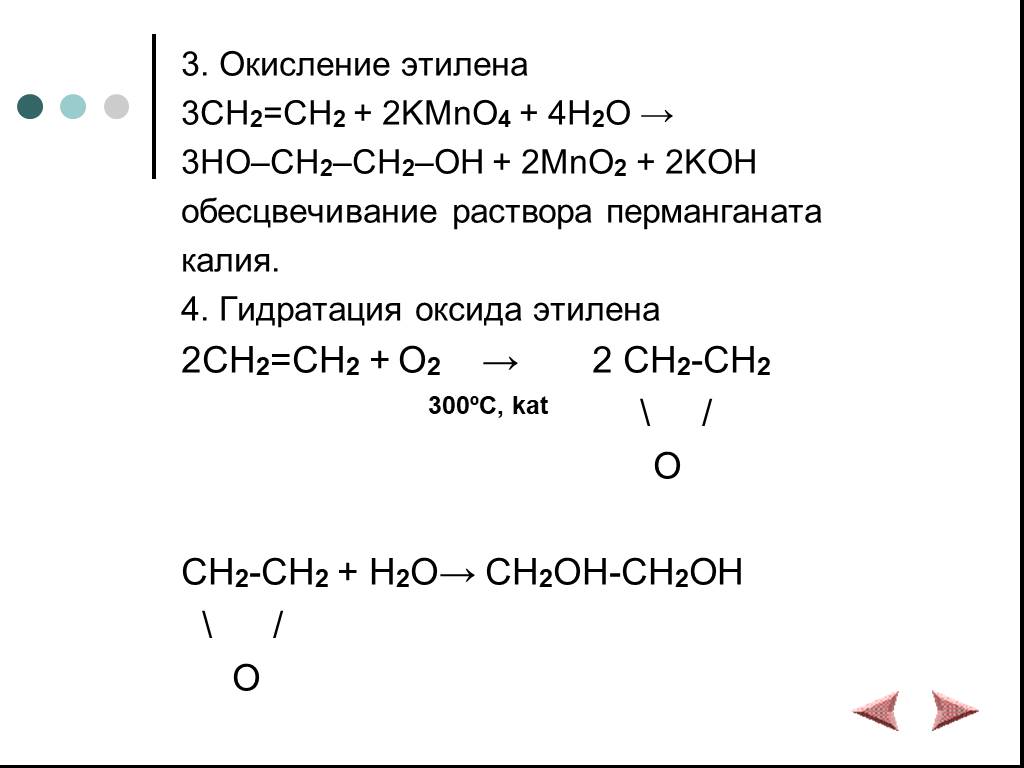
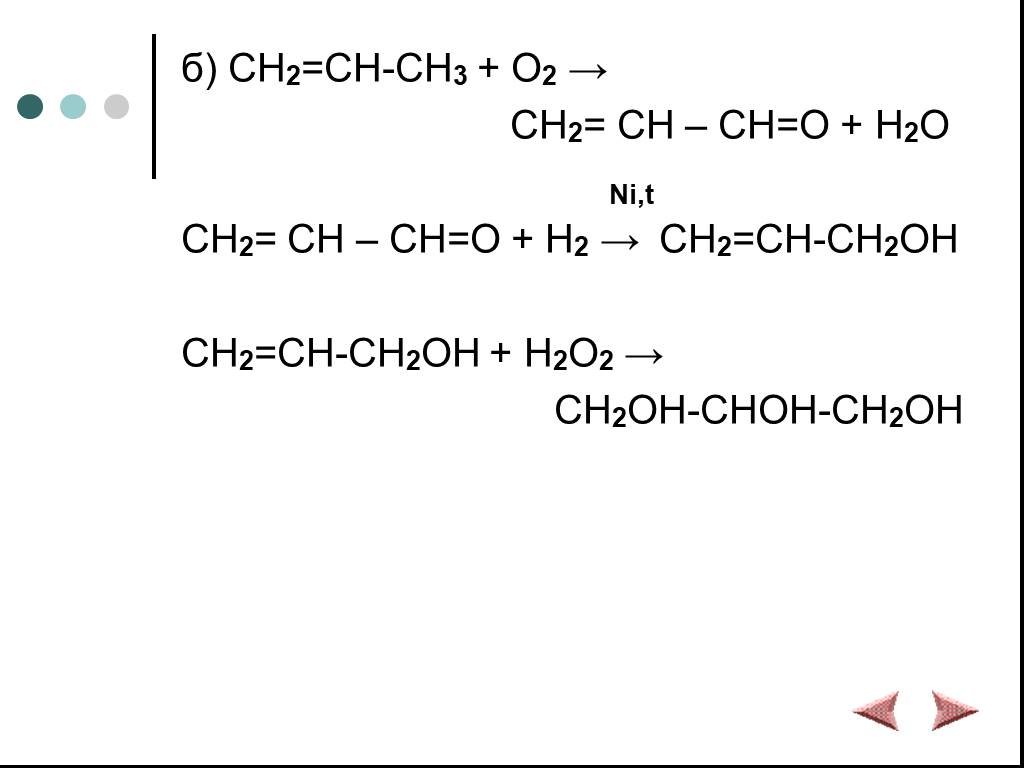
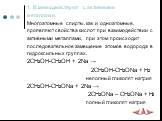
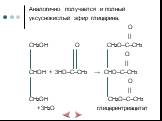
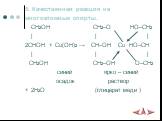
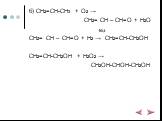
Химические свойства многоатомных спиртов
ХИМИЧЕСКИЕ СВОЙСТВА ГЛИКОЛЕЙ АНАЛОГИЧНЫ СВОЙСТВАМ ОДНОАТОМНЫХ СПИРТОВ. ОДНАКО У ГЛИКОЛЕЙ МОГУТ ВСТУПАТЬ В РЕАКЦИИ КАК ОДНА, ТАК И ОБЕ ГИДРОКСИЛЬНЫЕ ...Химические свойства и получение насыщенных одноатомных спиртов
Проверка домашнего задания Упражнение 5б. 1 2 3 Н3С – СН – СН3 1) | ОН 4 3 2 1 Н3С – СН2 – СН – СН2ОН 2) | СН3 ОН 1 2 3| 3) Н3С – СН2 – СН 4| 5 СН2 ...Химические свойства спиртов
Подумай и запиши! Из названных веществ: этандиол, бутанон, этанол, пропаналь, пропантриол, 3-метилбутанол-1 выберите: девочки – многоатомные спирты, ...Свойства спиртов
Спирты (алканолы) -. органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп –OH), соединенных с углеводородным ...Строение многоатомных спиртов
Цель урока:. Познакомитьcя со строением, физическими и химическими свойствами многоатомных спиртов,значением и применением их в промышленности и в ...Свойства черных и цветных металлов
Что такое металлы и сплавы? Металл — это вещество, обладающее ярким блеском и хорошей проводимостью тепла и электричества. Сплав — макроскопически ...Свойства уксусной кислоты
Немного истории... Уксус является продуктом брожения вина. Первое упоминание о его практическом применении относится к третьему веку до н. э. Греческий ...Свойства растворов электролитов
Начинаем наш урок, Пригласили к нам в домок, Мы не только всех друзей, И директоров, гостей. Всем хотим мы показать, Как нужно химию нам знать Без ...Свойства полимеров
Широким применением полимеры обязаны своим свойствам, важнейшими из них являются способность к образованию анизотропных высокоориентированных волокон ...Свойства основных классов неорганических соединений
Урок-игра. Девиз: «Все познается в сравнении». Повторение основных понятий темы: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ, СОЛИ. оксиды Na2O MgO BaO Mn2O7 SiO2 ...Кислоты. Классификация. Свойства
Определение. КИСЛОТЫ-это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. Названия распространенных кислот. ...Свойства альдегидов, их применение.
Цели урока:. Изучить химические свойства альдегидов. Познакомить учащихся с применением формальдегида и ацетальдегида на основе их свойств. Развивать ...Свойства
История открытия металлов. Каменный век Медный век (IV – III тысячелетия до н.э.) Бронзовый век (конец IV – начало I тысячелетия до н.э.) Железный ...Применение спиртов
Используются в качестве органических растворителей, при производстве полимеров, красителей и лекарственных препаратов. Метанол СН3ОН. Используют как ...Применение спиртов
Применение. На многих производствах спирты применяются в качестве растворителей . В химической промышленности они используются для различных синтезов ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Класс спиртов
Спирты́ (от лат. spiritus — дух; устар. алкого́ли) — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно ...Спирты. Состав, классификация, изомерия спиртов
Тесты. 1.Химический элемент, образующий «скелет» любого органического вещества. а) азот б) углерод в) водород г) кислород 2. С каждым из указанных ...Токсичность спиртов
Токсичность спиртов Токсичность возрастает с увеличением числа атомов углерода, примерно 3:1 (правило Ричардсона). Исключением является поведение ...Конспекты
Физические и химические свойства спиртов
Физические и химические свойства спиртов . Урок открытия новых знаний и построения системы знаний Класс 10. . Цели урока:. - доказать, что химические ...Химические свойства предельных одноатомных спиртов
МОУ « Лицей № 47» г. Саратов. . Никитина Надежда Николаевна - учитель химии. ПОДГОТОВКА К ЕГЭ ( 10, 11 класс). Лекция по теме: Химические свойства ...Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. Применение
Дата_____________ Класс_______________. Тема:. Одноатомные спирты. Метанол. Этанол. Физические свойства. Физиологическое действие спиртов на организм. ...Спирты, их строение, номенклатура, физические и химические свойства спиртов
Тема:. «Спирты, их строение, номенклатура, физические и химические свойства спиртов». . Цели. :. Знать строение, номенклатуру, физические и химические ...Химические свойства одноатомных спиртов
ПЛАН-КОНСПЕКТ. . урока химии (2 часа). Химические свойства одноатомных спиртов . Урок открытия новых знаний и построения системы знаний. ...Спирты Действие спиртов на организм человека
Конспект урока по химии в 10 классе. . Валеева Елена Николаевна,. . учитель химии. первой квалификационной категории. МБОУ «Гимназия №32». ...Сера. Положение в ПСХЭ. Свойства серы
9 класс. Урок 3. Тема:. «Сера. Положение в ПСХЭ. Свойства серы». Цель:. . Образовательная:. актуализация и обобщение знаний учащихся о сере ...Свойства углеводородов
9. . . Серебрянская Нелля Александровна. Учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Аннотация ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Свойства растворов электролитов
"Свойства растворов электролитов". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию