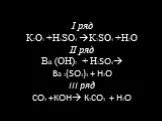Презентация "Свойства основных классов неорганических соединений" по химии – проект, доклад
Презентацию на тему "Свойства основных классов неорганических соединений" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 33 слайд(ов).
Слайды презентации
Список похожих презентаций
Свойства основных классов неорганических соединений
Вещества Простые Неорганические Органические Сложные Оксиды Соли Гидроксиды Кислоты Основания. Молекулы простых веществ состоят из атомов одного элемента. ...Обобщение сведений об основных классах неорганических веществ
Цель урока. Обобщение и систематизация знаний по основным классам неорганических веществ. Задачи урока. 1)образовательная: а)отработать умение записывать ...Окислительно-восстановительные свойства соединений хрома в различных средах
Цель урока:. Сформировать понятие о зависимости свойств соединений хрома от степени окисления элемента через организацию исследовательской деятельности ...Классы неорганических соединений
1.Назовите известные вам классы неорганических соединений. Классы неорганических веществ. кислоты соли основания оксиды. 2. Из предложенного перечня ...Ниобий и тантал. Свойства элементов и их соединений
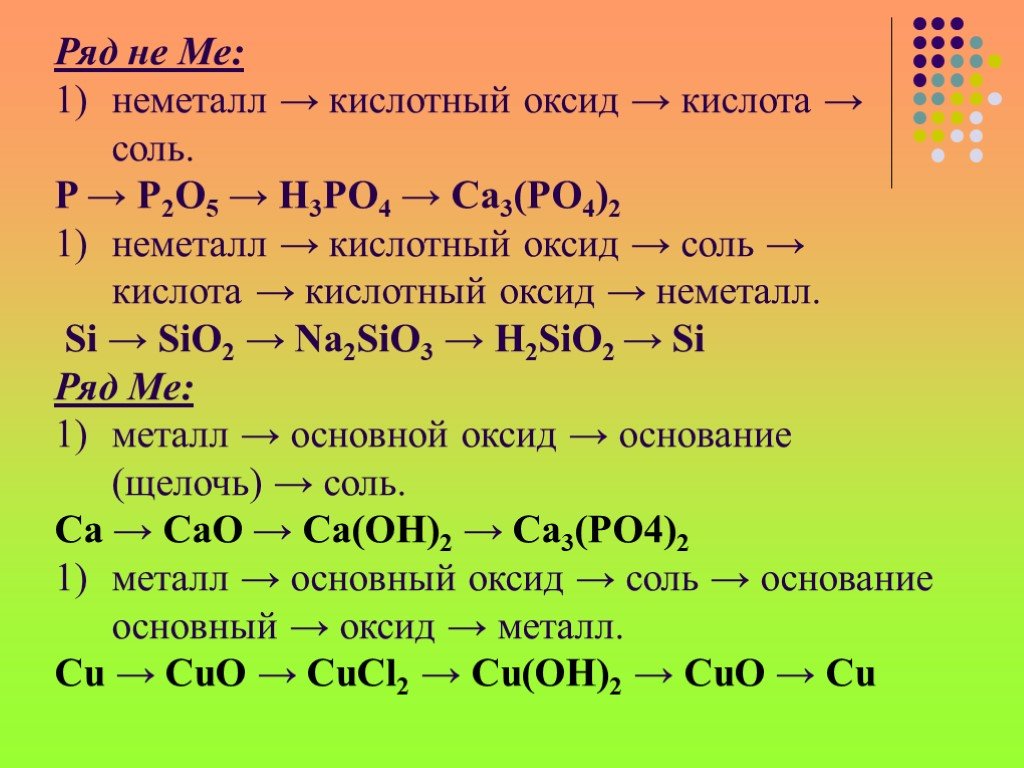
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Важнейшие классы неорганических соединений
Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых - кислород. Э Ме неМе + О2 ЭО-2. Гидроксиды — соединения оксидов химических ...Классы неорганических соединений
Оксиды. Образованы двумя химическими элементами Один из элементов кислород, имеющий степень окисления -2 Примеры: MgO, H2O. Оксидами являются оба ...Классы неорганических соединений
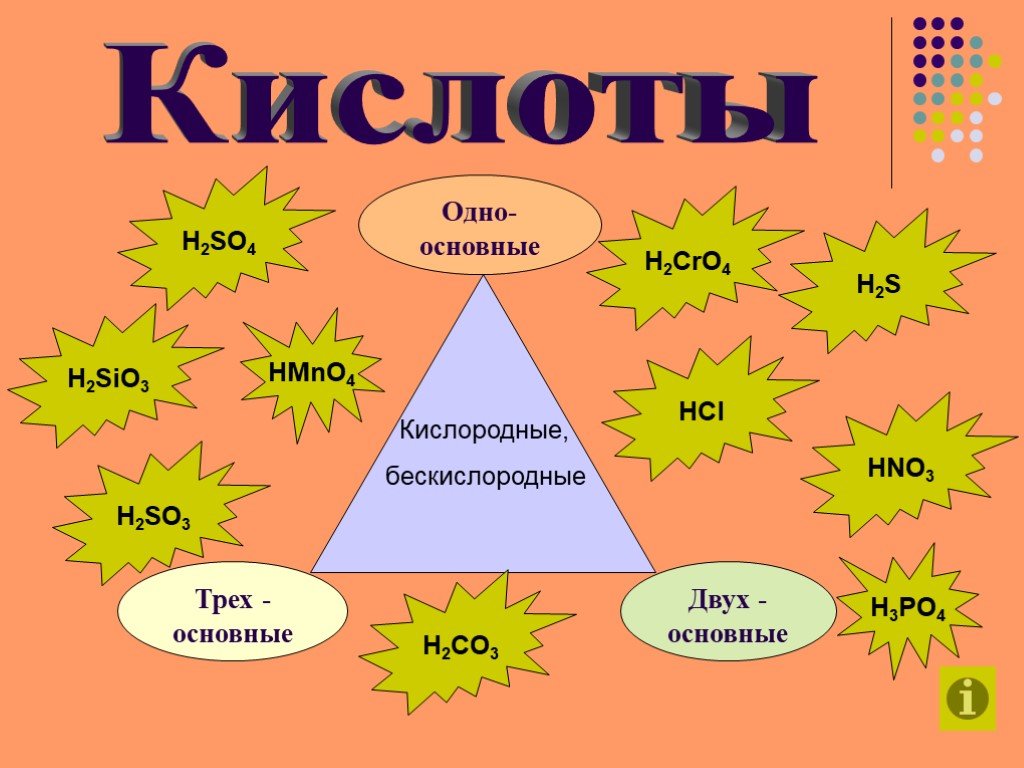
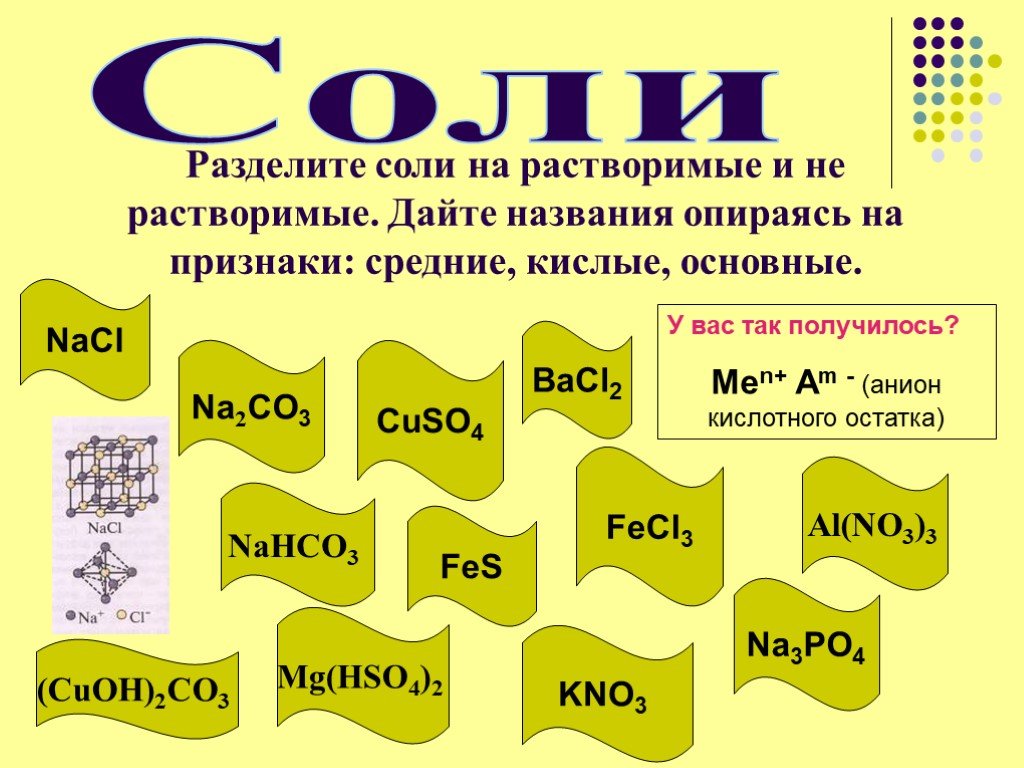
Чем объединены и чем отличаются перечисленные соединения:. Na SO ВаCl Cu(NO ) K PO K S CaSiO 3 4. Cоли – это сложные вещества, состоящие из атомов ...Взаимосвязь между классами неорганических соединений
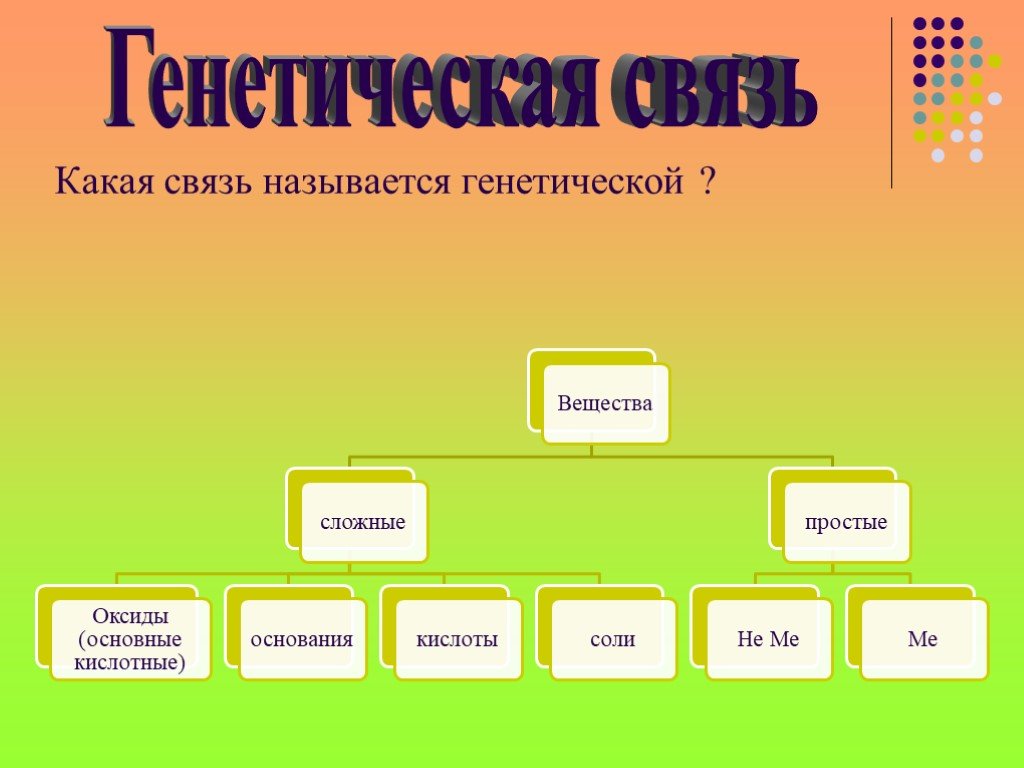
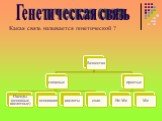
19.02.2019 Оськина Т.А. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Все знать, изведать, испытать! Путешествие на подводной лодке «Генезис". соляндия. основайские острова. кислотостан оксидония. Работа ...Классы неорганических соединений
Почему у фруктов кислый вкус? Вы любите фрукты? Что такое КИСЛОТА? Какие бывают КИСЛОТЫ? Кислоты. Состав и классификация. урок по химии 8 класс. Цель ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
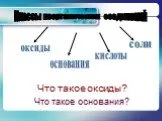
«ТРЕТИЙ ЛИШНИЙ». Поместите здесь ваш текст. Дайте название веществам и определите класс соединения:. Na OH SO2 Ca SO4 HCl. Проверка:. Классы неорганических ...Основные классы неорганических соединений
Классификация неорганических веществ; Классификация оксидов; Получение оксидов; Получение пероксида водорода; Химические свойства пероксида водорода. ...Генетические связи между важнейшими классами неорганических соединений
Тема. Генетические связи между важнейшими классами неорганических соединений. А. С. Макаренко: «Теория и практика неотъемлемы». . SO2 HCl H3PO4 H2O ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Думай, работай, ищи, трудно будет -не пищи! Путешествие на подводной лодке «Генезис". соляндия основайские оксидония кислотостан. Работа ...Основные классы неорганических соединений Соли
Классификация неорганических веществ 1.Определение 2.Классификация СОЛЕЙ; 3.НОМЕНКЛАТУРА. 4.Получение СОЛЕЙ; 5.Химические свойства СОЛЕЙ. Содержание:. ...Основные классы неорганических соединений
Основные классы неорганических соединений. ОКСИДЫ КИСЛОТЫ ОСНОВАНИЯ. ОПРЕДЕЛЕНИЕ НОМЕНКЛАТУРА. ФИЗИЧЕСКИЕ СВОЙСТВА. Важнейшие оксиды в природе и жизни ...Основные классы неорганических соединений
Многообразие веществ. Состав Сложные вещества, включающие в себя два химических элемента, причём один из них – кислород. Примеры Газы: CO2, SO2, NO2. ...Классификация и номенклатура неорганических соединений
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Класса неорганических соединений
Результат теста. Верно: 9 Ошибки: 1 Отметка: 4. Время: 0 мин. 33 сек. ещё исправить. Вопрос 1. 1. Образует щелочь при взаимодействии с водой. K2O ...Конспекты
Свойства основных классов неорганических соединений
. ПЛАН УРОКА « Свойства основных классов неорганических соединений». Учитель Ефименко З.А. Класс, профиль: 11 класс, базовый уровень. . Программно-методическое ...Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации
Конспект урока химии. . 9 класс. Тема : «Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации». ...Основные классы неорганических соединений. Генетическая связь классов неорганических соединений
Муниципальное бюджетное образовательное учреждение. «Жарынская средняя (полная) общеобразовательная школа». План-конспект открытого ...Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Обобщение сведений об основных классах неорганических веществ
Урок по химии в 8 классе. . Тема: «Обобщение сведений об основных классах неорганических веществ». . Цель:. обобщение и систематизация знаний ...Важнейшие классы неорганических соединений
ГБОУ СОШ пос. Сургут муниципального района Сергиевский Самарской области . . ПЛАН-КОНСПЕКТ УРОКА. . по химии в 8 классе Важнейшие ...Важнейшие классы неорганических соединений
МОУ Кинель – Черкасская средняя общеобразовательная школа № 1. «Образовательный центр». Конспект. . открытого урока по химии в 8 ...Важнейшие классы неорганических соединений
Урок – игра по теме: «Важнейшие классы неорганических соединений». Класс: 8. ФИО: Тимохина Алёна Владимировна. Должность: Учитель Химии. Место ...Обобщение знаний по классам неорганических соединений
Тема урока. . Обобщение знаний по классам неорганических соединений. ( урок для учащихся 8 классов по неорганической химии, изучаемый в разделе « ...Обобщение сведений об основных классах неорганических веществ
Стародубова Лилия Васильевна. Учитель химии. МБОУ СОШ №75, г. Нижний Новгород. Урок по химии в 8 классе. . Тема: «Обобщение сведений об основных ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 октября 2018
Категория:Химия
Содержит:33 слайд(ов)
Поделись с друзьями:
Скачать презентацию