Презентация "Классы неорганических соединений" по химии – проект, доклад
Презентацию на тему "Классы неорганических соединений" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Классы неорганических соединений
Чем объединены и чем отличаются перечисленные соединения:. Na SO ВаCl Cu(NO ) K PO K S CaSiO 3 4. Cоли – это сложные вещества, состоящие из атомов ...Классы неорганических соединений
1.Назовите известные вам классы неорганических соединений. Классы неорганических веществ. кислоты соли основания оксиды. 2. Из предложенного перечня ...Классы неорганических соединений
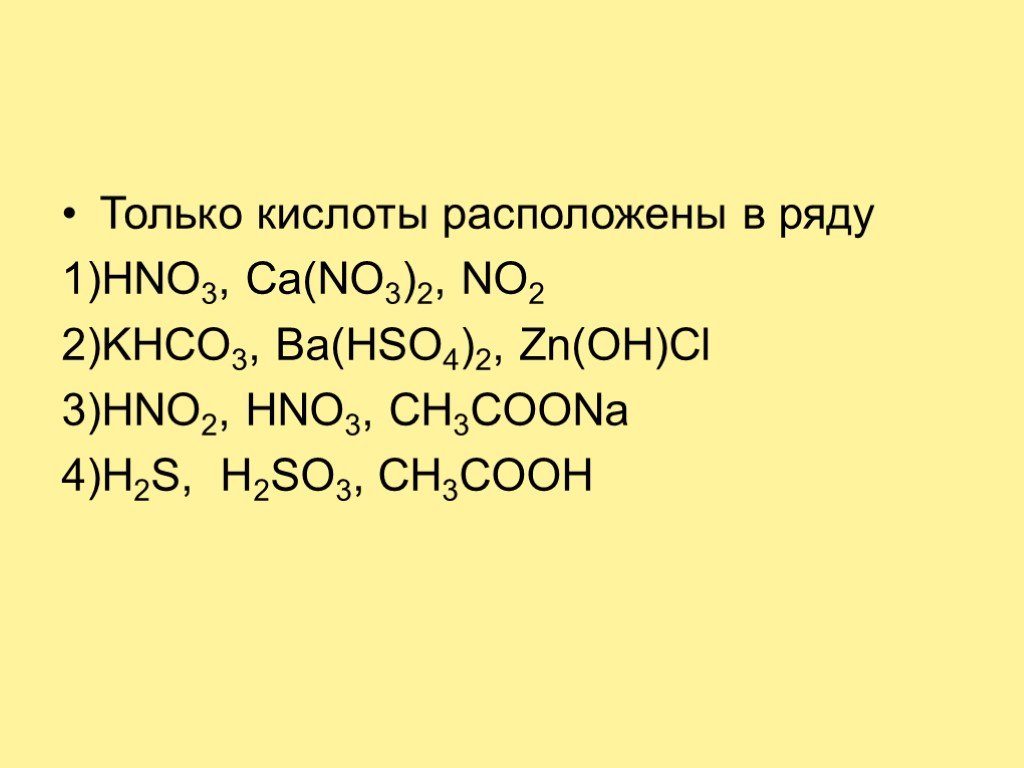
Почему у фруктов кислый вкус? Вы любите фрукты? Что такое КИСЛОТА? Какие бывают КИСЛОТЫ? Кислоты. Состав и классификация. урок по химии 8 класс. Цель ...Важнейшие классы неорганических соединений
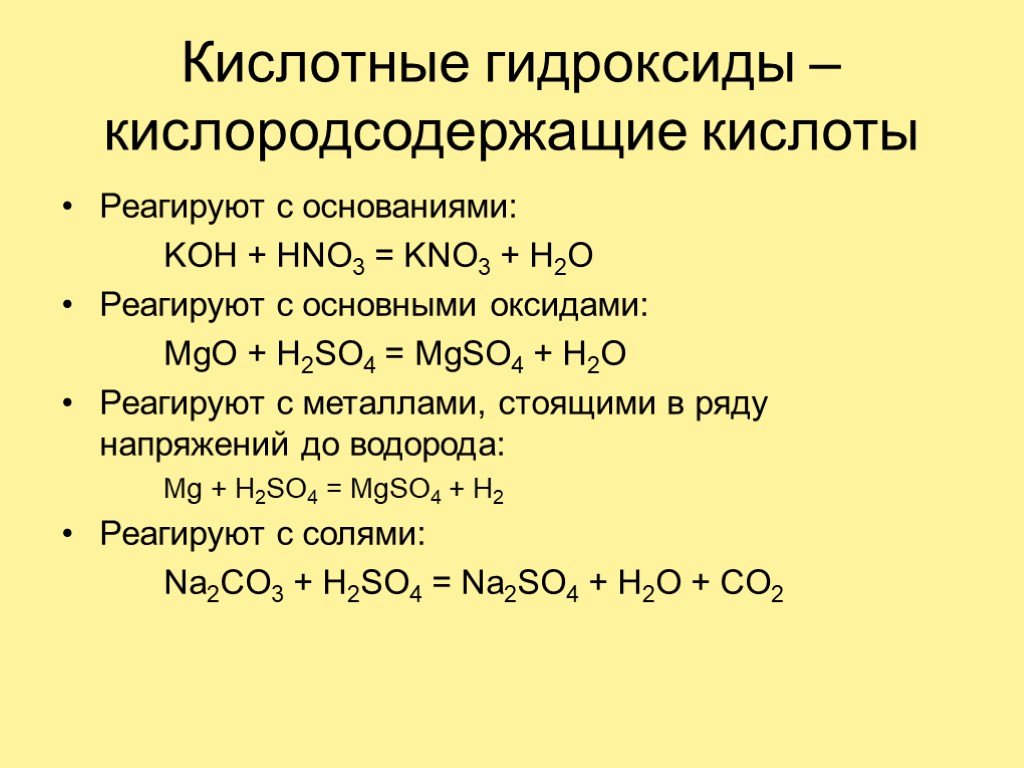
Оксид - сложное вещество, состоящее из атомов двух элементов, один из которых - кислород. Э Ме неМе + О2 ЭО-2. Гидроксиды — соединения оксидов химических ...Важнейшие классы неорганических соединений
Цели урока:. ВОСпитывающая. Формирование интереса к умению, создание положительной атмосферы, воспитание взаимного уважения между учащимися, для раскрытия ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
«ТРЕТИЙ ЛИШНИЙ». Поместите здесь ваш текст. Дайте название веществам и определите класс соединения:. Na OH SO2 Ca SO4 HCl. Проверка:. Классы неорганических ...Основные классы неорганических соединений
Классификация неорганических веществ. Сложные Н2О, НNО3 Соли NaCl. Неорганические вещества. Простые Cu, Н2, F2 Металлы Fe, Na Неметаллы С, О2 Основания ...Основные классы неорганических соединений
Цель: Обобщить и систематизировать знания учащихся о составе, строении и свойствах классов неорганических соединений. Задачи: Обучающие: закрепить ...Основные классы неорганических соединений
Основные классы неорганических соединений. ОКСИДЫ КИСЛОТЫ ОСНОВАНИЯ. ОПРЕДЕЛЕНИЕ НОМЕНКЛАТУРА. ФИЗИЧЕСКИЕ СВОЙСТВА. Важнейшие оксиды в природе и жизни ...Основные классы неорганических соединений
Вопрос 1. Укажите формулу основного оксида. А) HCI Б) K2O В)NaOH. Молодец ! следующий вопрос. Вы ошиблись ! Подумайте еще! Вопрос 2. Укажите формулу ...Основные классы неорганических соединений
Многообразие веществ. Состав Сложные вещества, включающие в себя два химических элемента, причём один из них – кислород. Примеры Газы: CO2, SO2, NO2. ...Основные классы неорганических соединений
Классификация неорганических веществ; Классификация оксидов; Получение оксидов; Получение пероксида водорода; Химические свойства пероксида водорода. ...Основные классы неорганических соединений Соли
Классификация неорганических веществ 1.Определение 2.Классификация СОЛЕЙ; 3.НОМЕНКЛАТУРА. 4.Получение СОЛЕЙ; 5.Химические свойства СОЛЕЙ. Содержание:. ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Думай, работай, ищи, трудно будет -не пищи! Путешествие на подводной лодке «Генезис". соляндия основайские оксидония кислотостан. Работа ...Основные классы неорганических соединений. Генетическая связь между классами неорганических соединений
Девиз урока! Все знать, изведать, испытать! Путешествие на подводной лодке «Генезис". соляндия. основайские острова. кислотостан оксидония. Работа ...Классификация и номенклатура неорганических соединений
ОТВЕТИТЬ НА ПРЕДЛОЖЕННЫЕ ВОПРОСЫ В ПОРЯДКЕ ИХ ПОСТАНОВКИ. Вариант 1 Основания – это… Кислотные оксиды – это … С водой реагирую только оксиды металлов ...Класса неорганических соединений
Результат теста. Верно: 9 Ошибки: 1 Отметка: 4. Время: 0 мин. 33 сек. ещё исправить. Вопрос 1. 1. Образует щелочь при взаимодействии с водой. K2O ...Знаешь ли ты классы неорганических веществ
И Г Р А 9 К Л А С С ЗНАЕШЬ ЛИ ТЫ КЛАССЫ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ? Я с вами пройду весь химический путь, отыщим мы с вами ответы! Я не дам на пути вам ...Важнейшие классы неорганических веществ
Неорганические вещества. Простые Сложные. Простые вещества Металлы Неметаллы. Сложные вещества. Оксиды - сложные вещества, состоящие из двух химических ...Взаимосвязь между классами неорганических соединений
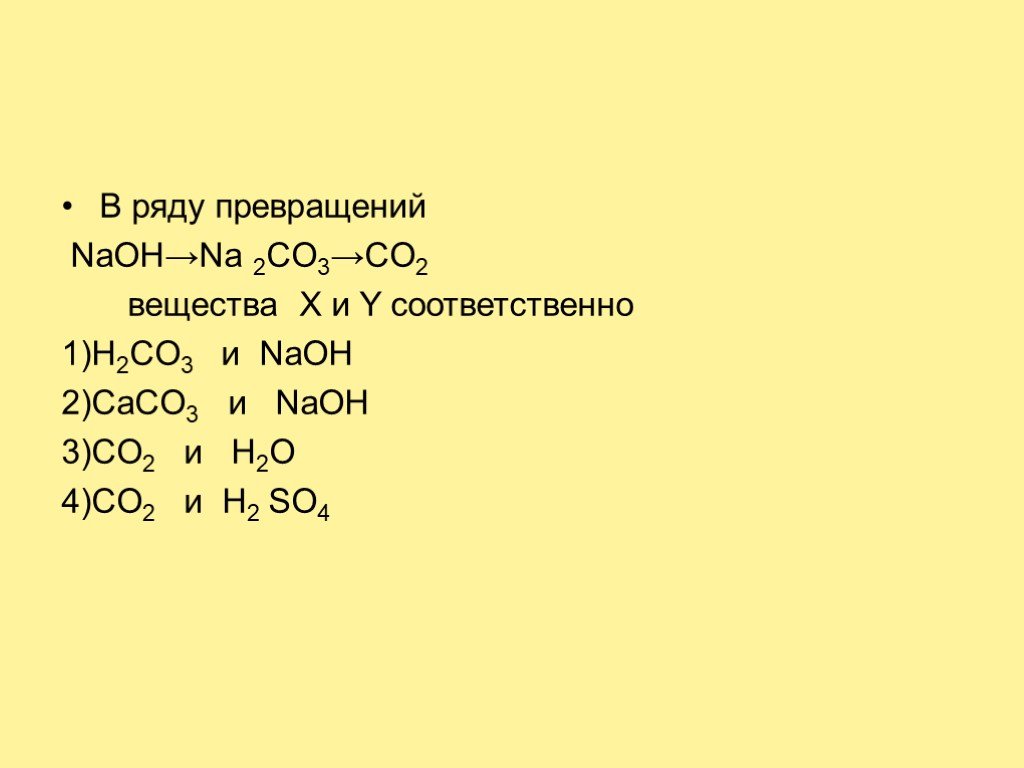
19.02.2019 Оськина Т.А. Даны схемы превращений. Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. ...Конспекты
Повторение. Классы неорганических соединений
Урок – игра. «Звёздный час в химии». 8 класс. Тема:. Повторение. Классы неорганических соединений.. Цель: повышение познавательного интереса ...Классы неорганических соединений . Кислоты
Муниципальное бюджетное общеобразовательное учреждение « Средняя общеобразовательная школа №29» г. Нижнекамска, Республика Татарстан. . ...Классы неорганических соединений
Тема: Классы неорганических соединений. Цель:. повторение, . обобщение и систематизация . знаний. Задачи. . . Образовательные:. повторить ...Основные классы неорганических соединений
Муниципальное общеобразовательное учреждение. «Стрелецкая средняя общеобразовательная школа. Белгородского района Белгородской области имени Героя ...Основные классы неорганических соединений
План-конспект учебного занятия по химии. Автор:. Серова Елена Петровна. Класс:. 8. Тема:. Основные классы неорганических соединений. Форма ...Основные классы неорганических соединений
Урок-соревнование по химии в 8-м классе. . . Обобщение и закрепление знаний по теме "Основные классы неорганических соединений". . Казаковцева ...Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций
Дата ____________ Класс _____________. Тема: Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций. ...Основные классы неорганических соединений
Урок-повторение по теме. «Основные классы неорганических соединений». Цель урока:. систематизировать знания учащихся по теме «Основные классы ...Важнейшие классы неорганических соединений
Урок – игра по теме: «Важнейшие классы неорганических соединений». Класс: 8. ФИО: Тимохина Алёна Владимировна. Должность: Учитель Химии. Место ...Основные классы неорганических соединений. Генетическая связь классов неорганических соединений
Муниципальное бюджетное образовательное учреждение. «Жарынская средняя (полная) общеобразовательная школа». План-конспект открытого ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:19 февраля 2019
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию





































![Свойства амфотерных оксидов. Амфотерность – двойственность свойств Реагируют с кислотами, проявляя свойства основных оксидов: Al2O3 + 6HCl = 2AlCl3 + 3H2O Реагируют со щелочами, проявляя свойства кислотных оксидов: Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4] Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении) Свойства амфотерных оксидов. Амфотерность – двойственность свойств Реагируют с кислотами, проявляя свойства основных оксидов: Al2O3 + 6HCl = 2AlCl3 + 3H2O Реагируют со щелочами, проявляя свойства кислотных оксидов: Al2O3 + 2NaOH + 3H2O= 2Na[Al(OH)4] Al2O3 + 2NaOH = 2NaAlO2 + H2O (при сплавлении)](https://prezentacii.org/upload/cloud/19/02/124454/images/thumbs/screen10.jpg)











![Амфотерные гидроксиды. Реагируют с кислотами, проявляя свойства оснований: Al(OH)3 + 3HCl = AlCl3 + 3H2O Реагируют со щелочами, проявляя свойства кислот: Al(OH)3 + NaOH = Na[Al(OH)4] Амфотерные гидроксиды. Реагируют с кислотами, проявляя свойства оснований: Al(OH)3 + 3HCl = AlCl3 + 3H2O Реагируют со щелочами, проявляя свойства кислот: Al(OH)3 + NaOH = Na[Al(OH)4]](https://prezentacii.org/upload/cloud/19/02/124454/images/thumbs/screen22.jpg)






![При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH)2 3) Na2ZnO2 4)Na2[Zn(OH)4] При действии избытка раствора гидроксида натрия на раствор сульфата цинка образуется 1) ZnO 2) Zn(OH)2 3) Na2ZnO2 4)Na2[Zn(OH)4]](https://prezentacii.org/upload/cloud/19/02/124454/images/thumbs/screen29.jpg)