Презентация "Кристаллические решетки" (9 класс) по химии – проект, доклад
Презентацию на тему "Кристаллические решетки" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Кристаллические решетки
Составьте формулы веществ и укажите вид химической связи:. Водород, кислород, вода, оксид углерода(), хлорид кальция, гидроксид бария, оксид кремния, ...Кристаллические решетки
Цели урока:. 1)Познакомить учащихся с различными типами кристаллических решеток; 2)рассмотреть пример веществ с различными типами кристаллических ...Кристаллические решетки
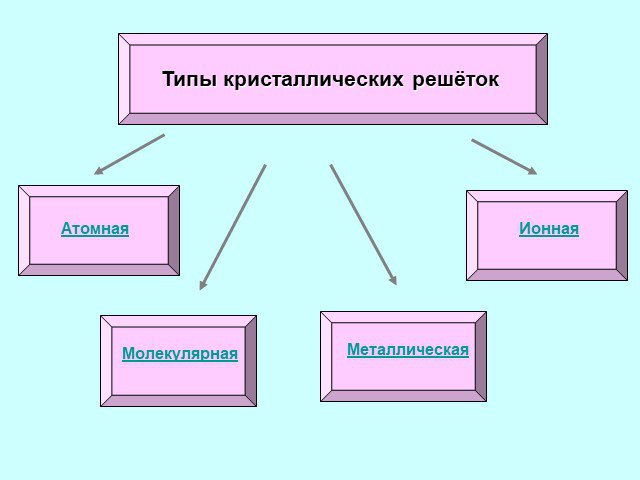
Вещества Аморфные Кристаллические. Кристаллическая решетка. Узел решетки. Атомные решетки. В узлах решетки - атомы. Примеры веществ: кварц, кремний, ...Кристаллические решетки
Твёрдые вещества. Аморфные Кристаллические. Аморфные вещества. Не имеют определённой температуры плавления При нагревании размягчаются и переходят ...Кристаллические решетки
Как известно вещество может состоять в трех агрегатных состояниях: газообразном жидком твердом Твердые вещества делятся на кристаллические и аморфные. ...Кристаллические решётки
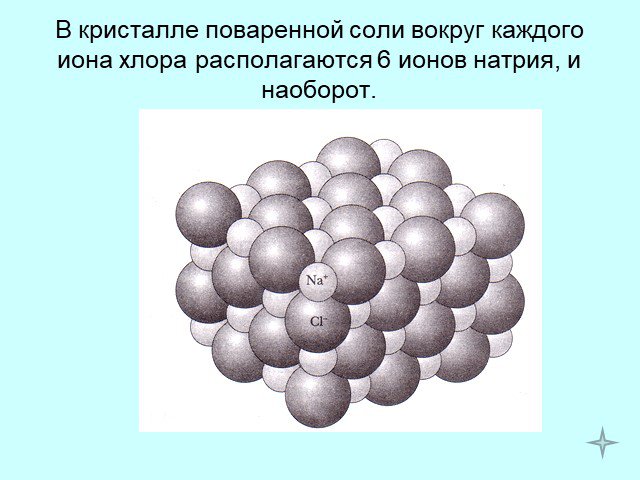
Кристаллические решётки. Кристаллической решёткой называют совокупность точек пространства, в котором располагаются частицы, образующие кристалл. ...Кристаллические и аморфные тела
Свойства твердых тел. Сохранение формы и объема. Наличие постоянной температуры плавления. Упорядоченное внутреннее строение. Кристаллическая решетка. ...Кристаллические и аморфные тела
Цели урока: Расширить знания о твёрдых телах. Рассмотреть строение тел и влияние химической связи на свойства твердых тел. Раскрыть основные свойства ...Кристаллические и аморфные тела
Твёрдые тела. Мы живем на поверхности твердого тела – земного шара, в сооружениях, построенных из твердых тел. Наше тело, хотя и содержит 65% воды, ...Кристаллические и аморфные вещества
Агрегатное состояние вещества (на примере кислорода О2). - 218,8° - 194° 0° t°, C Т пл Т кип твердое жидкое газ. Особенности кристаллических веществ. ...Конспекты
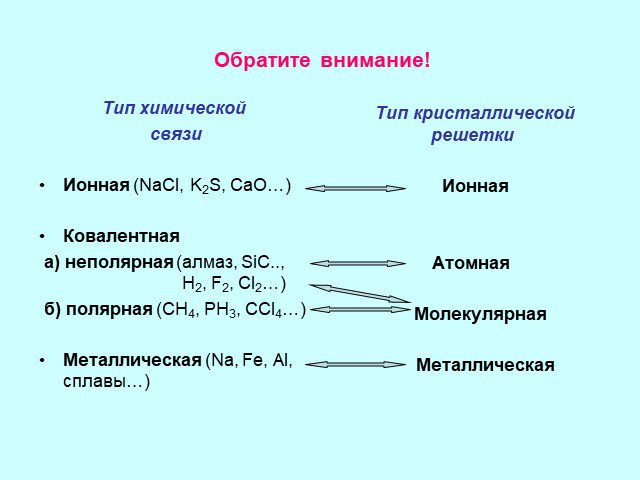
Химическая связь. Строение вещества. Кристаллические решетки
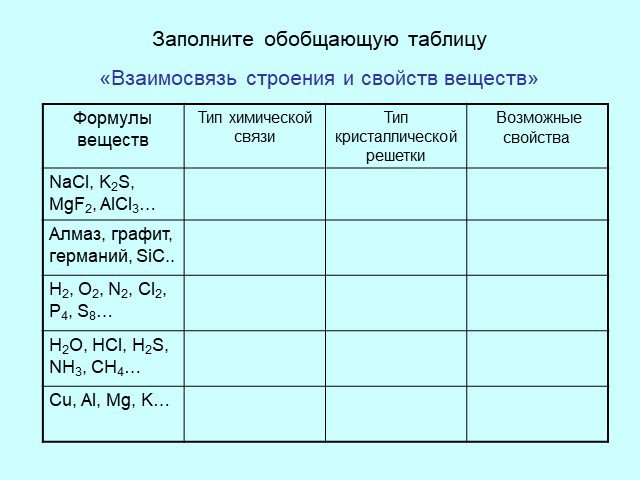
Дата ____________ Класс _____________. Тема: Химическая связь. Строение вещества. Кристаллические решетки. Цели урока:. закрепить и повторить ...Кристаллические решетки
. Технологическая карта урока. Предмет. – Химия. Уровень образования. – основное общее образование. Тема урока. « Кристаллические решетки». ...Кристаллические решетки
Дьячук Елена Юрьевна. . Учитель химии. . МБОУ СОШ №1 г.Оха, Сахалинская область. Методическая разработка модульного урока. «Кристаллические ...Кристаллические решётки
План-конспект урока химии в 8 классе по теме:. «Кристаллические решётки». Это урок изучения нового материала. Урок – исследование. Дидактические ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Треногина Надежда Григорьевна, учитель химии
Классы:
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию