Презентация "Свойства альдегидов, их применение." по химии – проект, доклад
Презентацию на тему "Свойства альдегидов, их применение." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Нефть, состав и свойства. Переработка нефти. Нефтепродукты, их применение.
Залежи нефти находятся в недрах Земли на разной глубине, где нефть заполняет свободное пространство между некоторыми породами. Сегодня нефть является ...Жиры и их свойства
Цель занятия: создать условия для осознания и осмысления блока новой информации посредством системы вопросов и нестандартных заданий для самостоятельной ...«Твердые тела и их свойства»
Твердые тела – тела, сохраняющие форму и объем в течение длительного времени. Аморфные тела. Кристаллические тела. Монокристаллы Поликристаллы. Кристаллические ...Альдегиды, свойства, получение, применение
Цели урока.Продолжить знакомить учащихся с кислородсодержащими органическими соединениями на примере альдегидов. Познакомить учащихся с применением ...
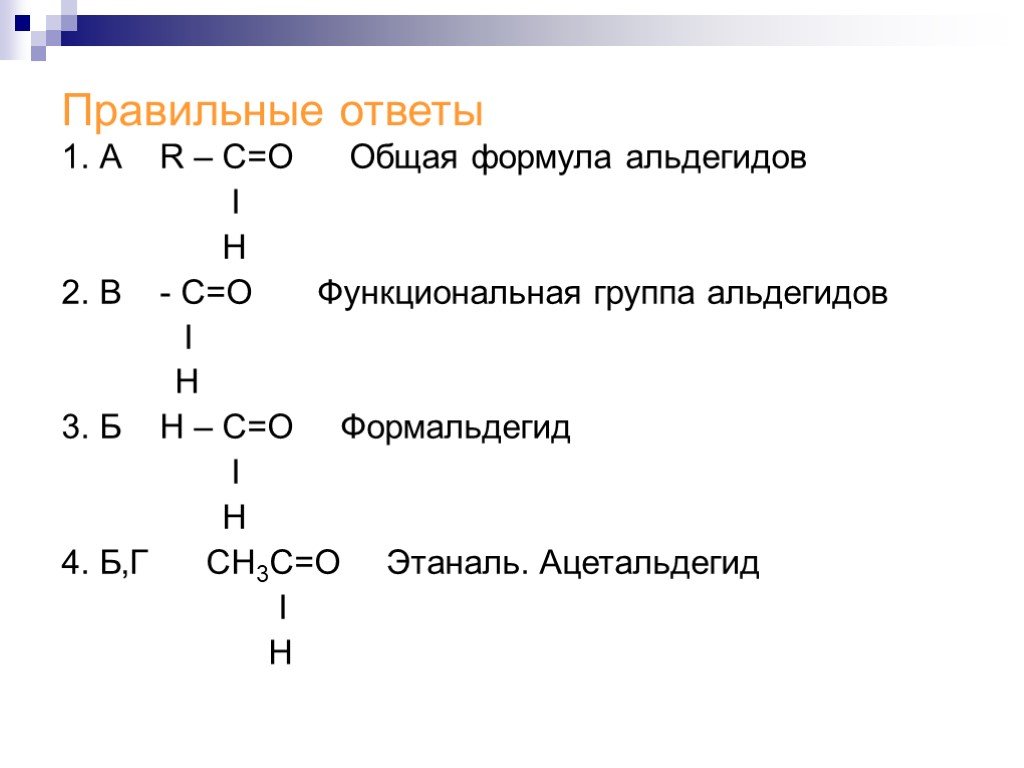
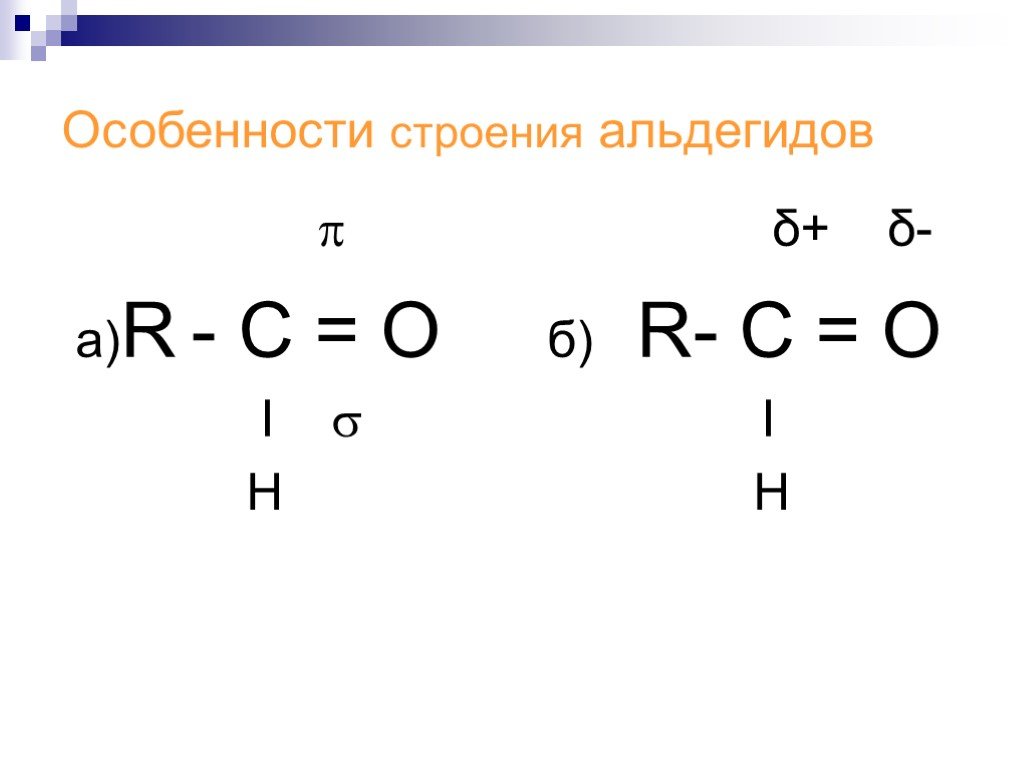
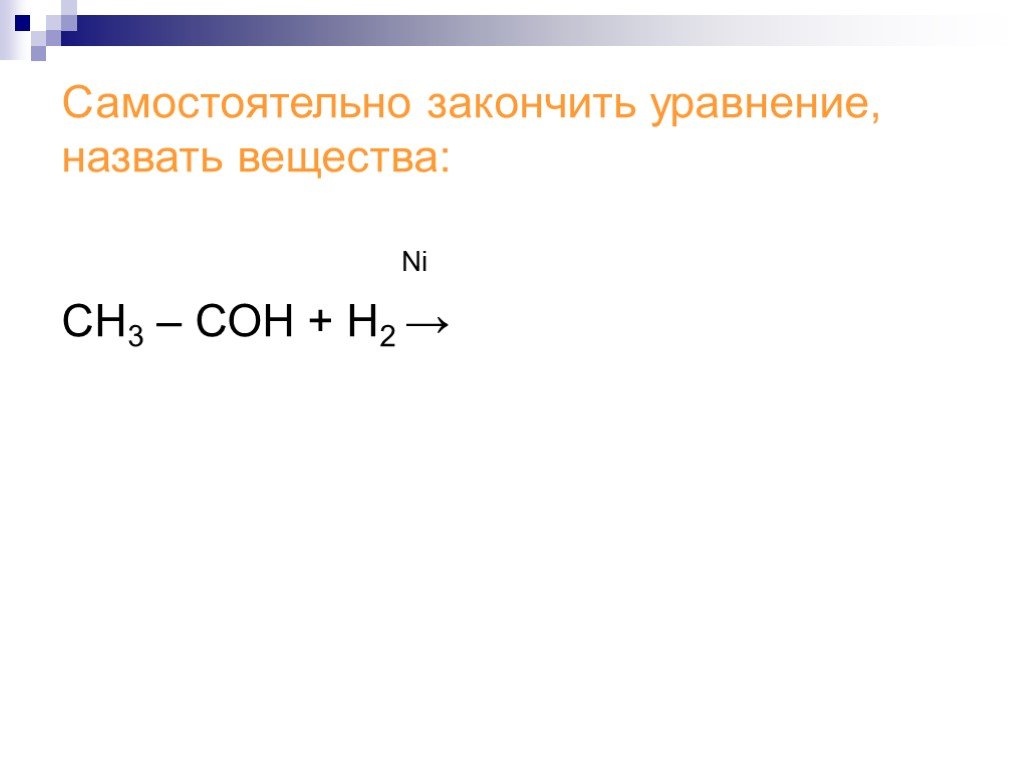
Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Альдегиды и их свойства
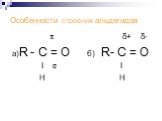
Содержание Строение молекул Изомерия и номенклатура Физические свойства Получение Химические свойства Применение Контрольные вопросы. Альдегиды – ...«Циклоалканы, их строение. Свойства циклоалканов.»
Цель: Изучить строение, состав, физические свойства и тип гибридизации электронных облаков атома углерода в циклоалканах. Общая формула - СnH2n. Циклоалканы ...Жиры, их строение и свойства
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Аммиак: состав, строение, свойства, применение
История названия. Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Кислородные соединения азота и их свойства
Цель урока:. Расширить, обобщить, закрепить, оценить знания по теме: «Кислородные соединения азота» Повторить свойства азотной кислоты Закрепить особенности ...Кислоты, их классификация и свойства
images.yandex.ru. Дайте характеристику оксидам. Металла(неметалла) Солеобразующий (несолеобразующий) Кислотный (основный). MgO CO SiO2 CO2 N2O5 Li2O. ...Кетоны и их свойства
Строение кетонов. Кетоны - органические вещества, в молекулах которых карбонильная группа связана с двумя углеводородными радикалами. Общая формула ...Алкины и их свойства
Непредельные углеводороды с тройной связью С=С в молекулах. Простейший представитель ряда – ацетилен С2Н2, общая формула СnH2n-2 (n>2). Атомы углерода ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Вещества и их свойства
Физические тела – любые предметы, имеющие форму и объем. Например, физическими телами являются самые разнообразные предметы: алюминиевая ложка, гвоздь, ...Конспекты
Альдегиды. Их строение, свойства, получение, применение
Мультимедийный урок по теме: "Альдегиды. Их строение, свойства, получение, применение". . Цели:. 1.Организовать деятельность учащихся по восприятию, ...Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров
Тема:. Жиры, их состав и свойства. Биологическая роль жиров. Получение и применение жиров. Цель:. Формировать знания учащихся о составе жиров, ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Белки, их строение, свойства, биологические функции
Ущербова Любовь Владимировна, ГБОУ СОШ № 519, города Москвы,. . учитель химии. Тема урока в 10 классе «Белки, их строение, свойства, биологические ...Белки, их строение и свойства
Тема урока: Белки, их строение и свойства. Цель урока:. . Обучающие:. . Актуализировать знания, необходимые для изучения темы. . Познакомить ...Аммиак. Физические и химические свойства. Получение, применение
Конспект урока по химии. Учитель: Сапрыкина Людмила Анатольевна. Предмет: химия класс: 9. Тема урока: «. Аммиак. Физические и химические свойства. ...Аммиак. Физические и химические свойства аммиака, получение, применение
Дата_____________ Класс_______________. Тема:. . Аммиак. Физические и химические свойства аммиака, получение, применение. Цели урока:. знать ...Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение
ПЛАН-КОНСПЕКТ УРОКА Аммиак. Строение молекулы. Физические и химические свойства. Получение, применение. ФИО:. Исмаилова Венера Владимировна. ...Алканы, получения, свойства и применение
Муниципальное бюджетное образовательное учреждение «Актанышская средняя общеобразовательная школа №1». Актанышского муниципального района Республики ...Азотная кислота строение, свойстваи применение
Открытый урок по химии в 9 классе по теме:. . . « Азотная кислота строение, свойстваи применение». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 июня 2018
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию











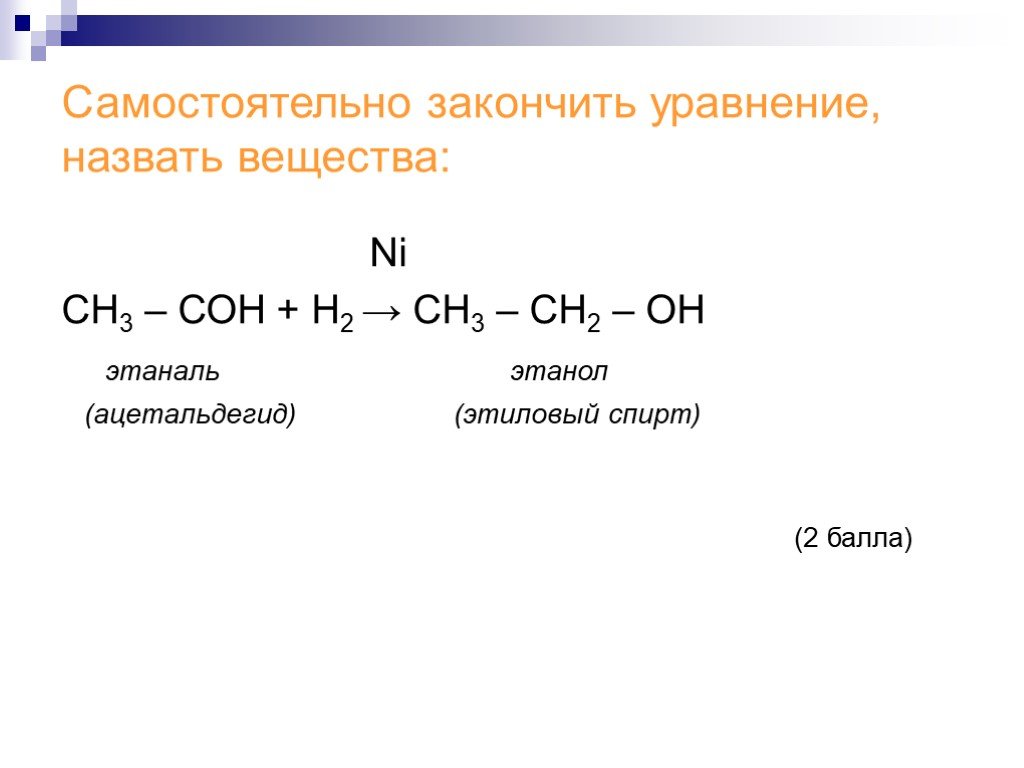

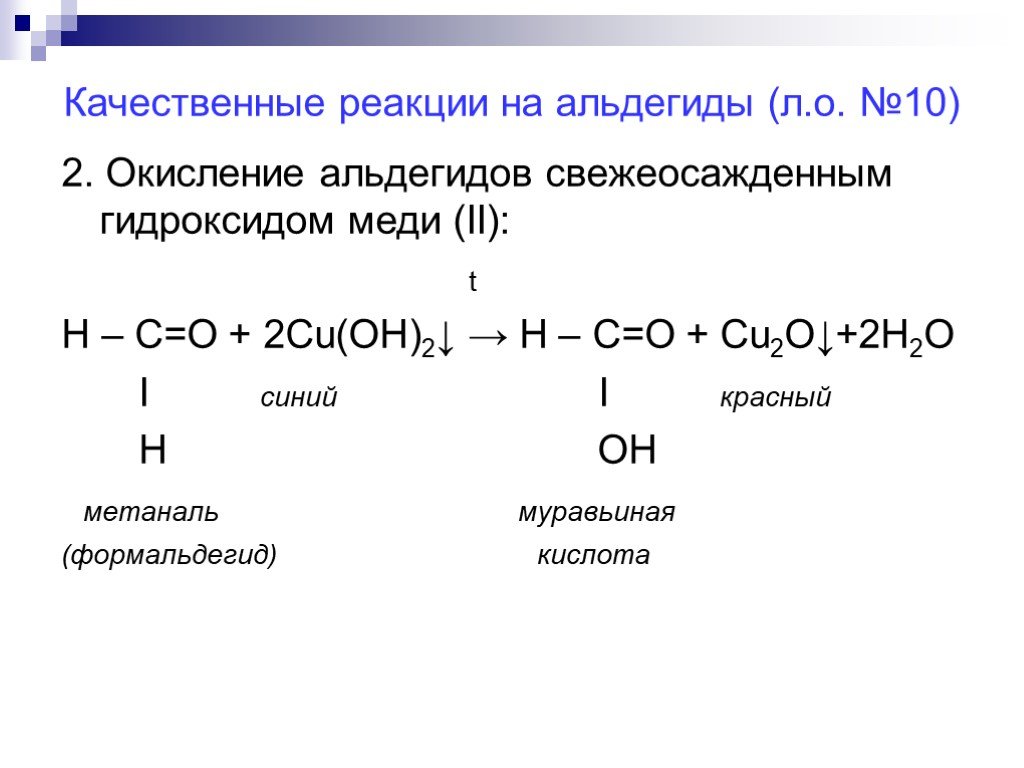















![Химические свойства альдегидов. 1. Реакция восстановления 2. Реакции окисления. Окислители: кислород [О], аммиачный раствор оксида серебра Ag2O, свежеосажденный гидроксид меди [II] Cu(OH)2. 3. Реакции поликонденсации с фенолом С6Н5ОН Химические свойства альдегидов. 1. Реакция восстановления 2. Реакции окисления. Окислители: кислород [О], аммиачный раствор оксида серебра Ag2O, свежеосажденный гидроксид меди [II] Cu(OH)2. 3. Реакции поликонденсации с фенолом С6Н5ОН](https://prezentacii.org/upload/cloud/18/06/48027/images/thumbs/screen11.jpg)



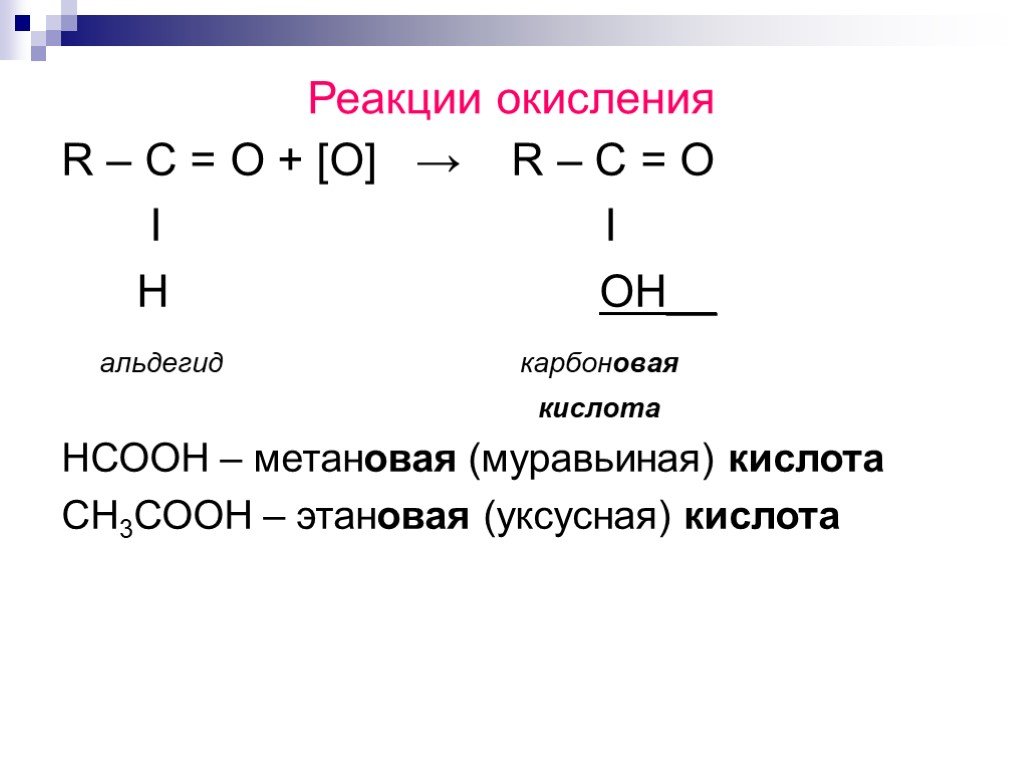
![Реакции окисления. R – C = O + [O] → R – C = O Ι Ι H OH__ альдегид карбоновая кислота НСООН – метановая (муравьиная) кислота СН3СООН – этановая (уксусная) кислота Реакции окисления. R – C = O + [O] → R – C = O Ι Ι H OH__ альдегид карбоновая кислота НСООН – метановая (муравьиная) кислота СН3СООН – этановая (уксусная) кислота](https://prezentacii.org/upload/cloud/18/06/48027/images/thumbs/screen15.jpg)
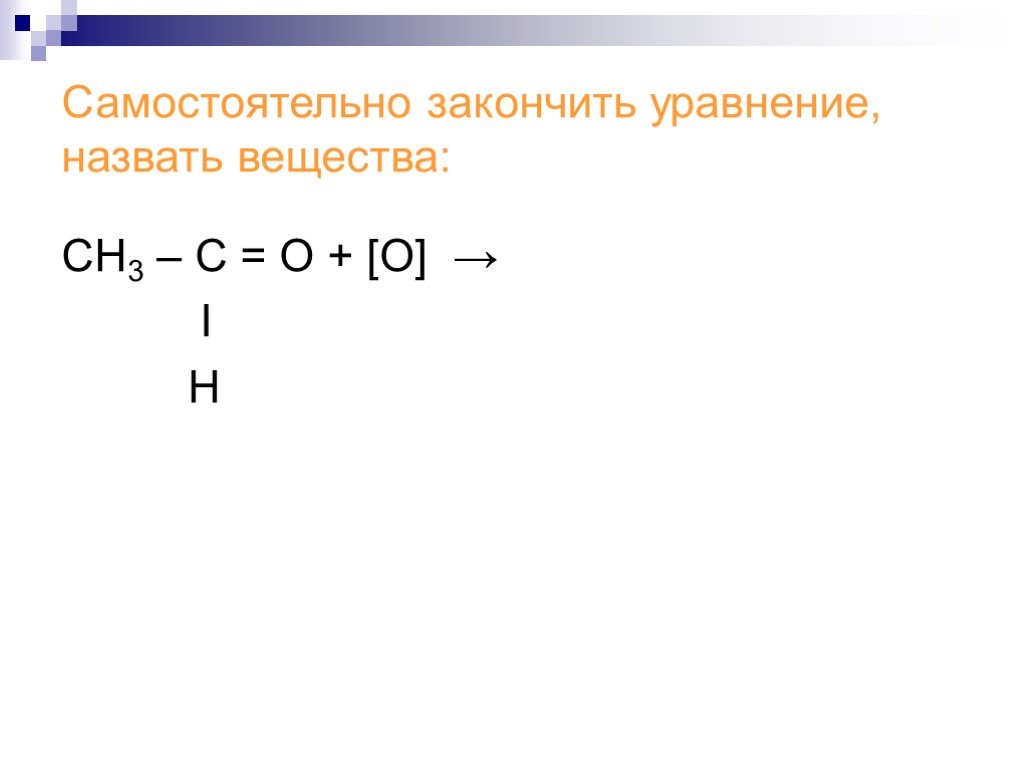
![СН3 – С = О + [О] → Ι Н СН3 – С = О + [О] → Ι Н](https://prezentacii.org/upload/cloud/18/06/48027/images/thumbs/screen16.jpg)
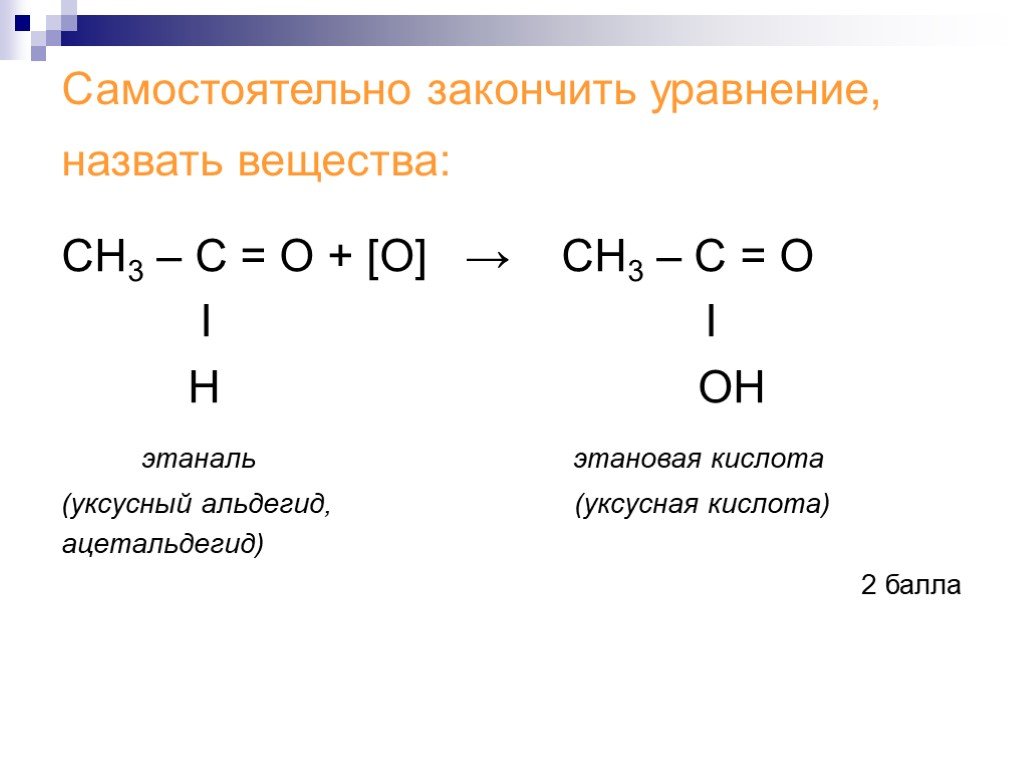
![СН3 – С = О + [О] → СН3 – С = О Ι Ι Н ОН этаналь этановая кислота (уксусный альдегид, (уксусная кислота) ацетальдегид) 2 балла СН3 – С = О + [О] → СН3 – С = О Ι Ι Н ОН этаналь этановая кислота (уксусный альдегид, (уксусная кислота) ацетальдегид) 2 балла](https://prezentacii.org/upload/cloud/18/06/48027/images/thumbs/screen17.jpg)


![Реакция поликонденсации. (n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O фенол формаль- фенолформальдегидная дегид смола Реакция поликонденсации. (n+1)С6Н5ОН+nНСОН→[-CH2–C6H3OH - ]n-1+nH2O фенол формаль- фенолформальдегидная дегид смола](https://prezentacii.org/upload/cloud/18/06/48027/images/thumbs/screen20.jpg)