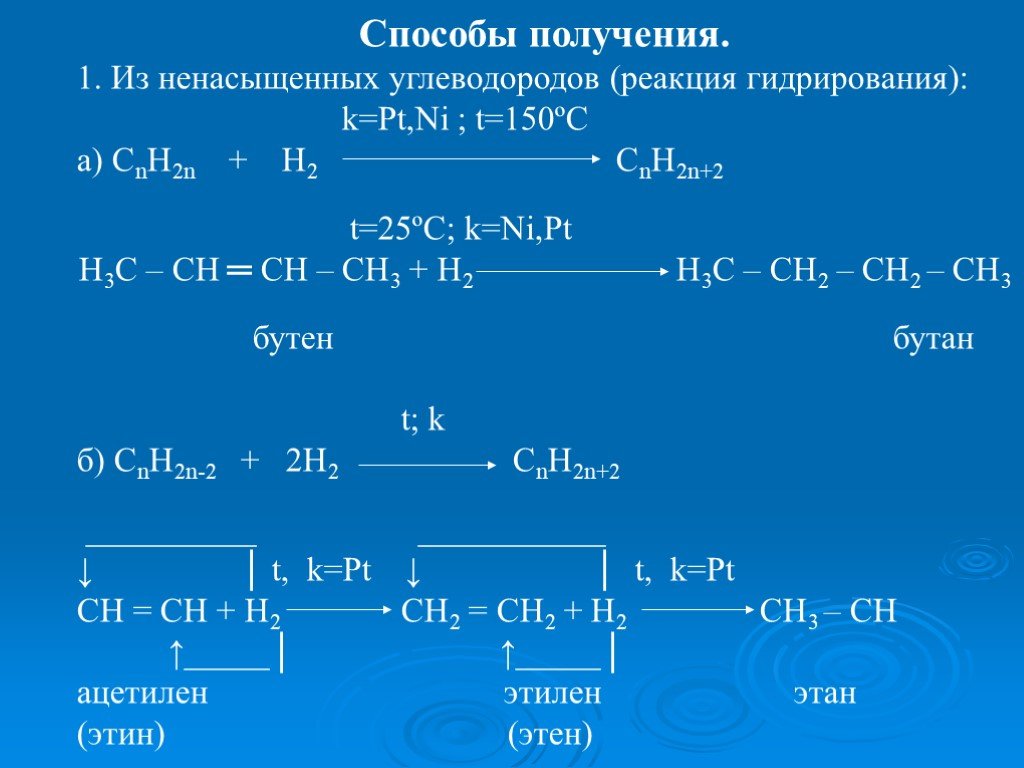
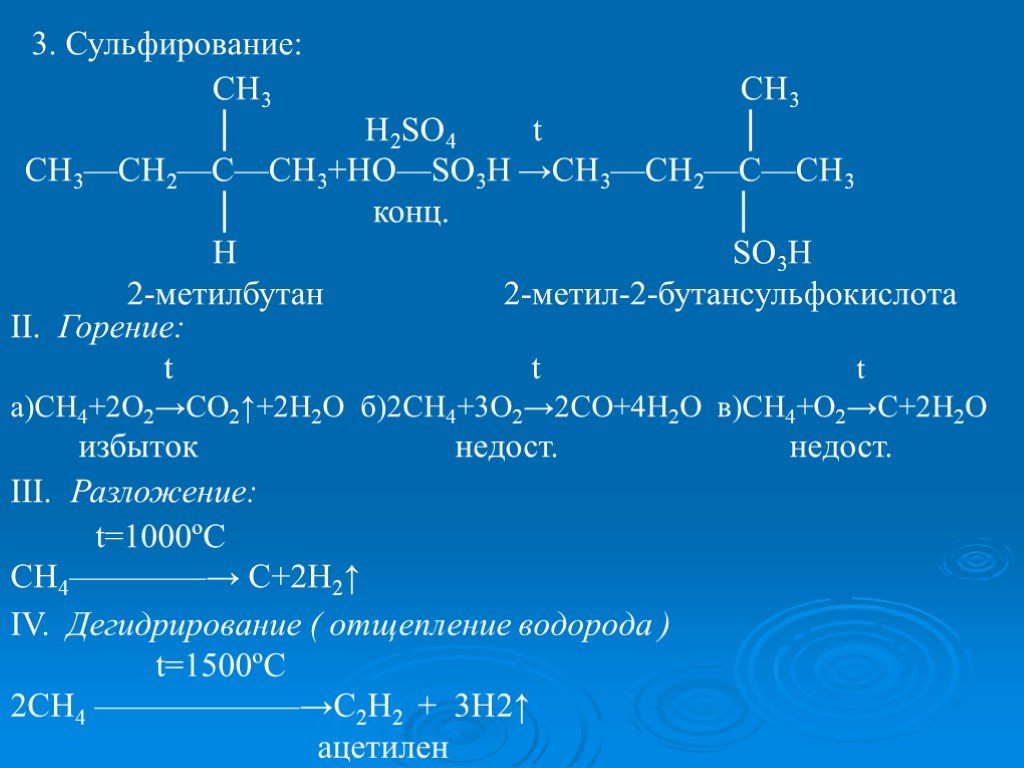
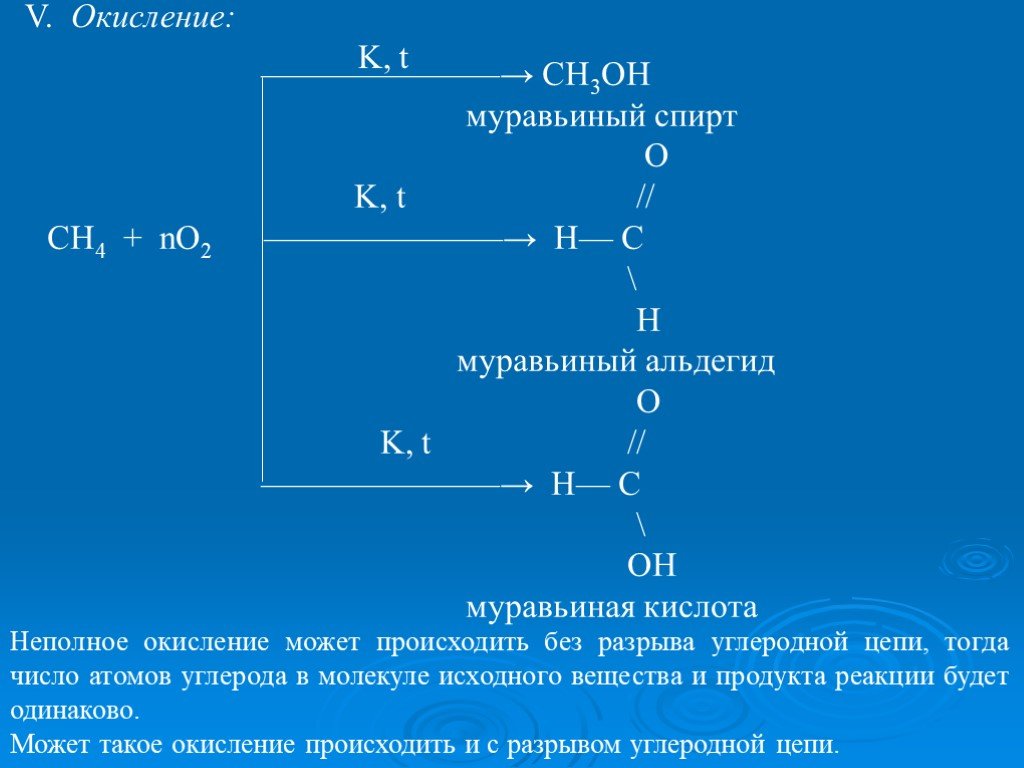
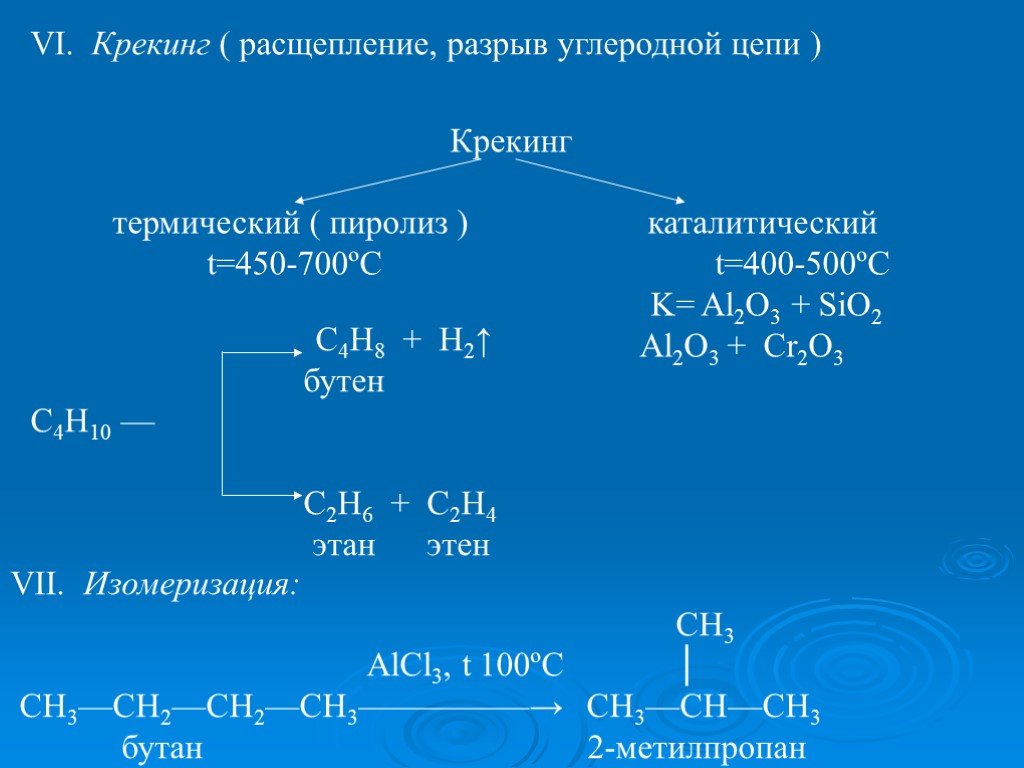
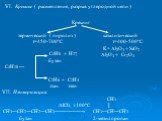
Презентация "ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ." по химии – проект, доклад
Презентацию на тему "ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 10 слайд(ов).
Слайды презентации
Список похожих презентаций
ОКСИДЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА
Классификация оксидов. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. ...Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
«Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного ...СВОЙСТВА ДРЕВЕСИНЫ И ПЛАСТМАСС
2.1 Физические свойства древесины. Плотность: древесины, защищенной от увлажнения (кг/м3) Хвойные: лиственница 650 сосна, ель, кедр, пихта 500 Твердые ...БЕНЗОЛ: ОСОБЕННОСТИ СТРОЕНИЯ, СВОЙСТВА
Эпиграф. А.Дистеверг:«Не в количестве знаний заключается образование, но в полном понимании и искусном применении всего того, что знаешь». Девиз : ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия
история развития органической химии предмет органической химии особенности органических веществ Бутлеров теория строения органических соединений Бутлерова ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Незнайка в стране химия
Я – известный химик Незнайка. Я знаю все и все могу. Сейчас я взмахну волшебной палочкой и начнется извержение вулкана. Смотри! А теперь все за мной ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Зеленая химия и проблемы устойчивого развития
• Атмосфера (загрязнение, фотохимический смог, кислотные выпадения, деградация озонового слоя, глобальное изменение климата) • Гидросфера (загрязнение, ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...алюминий химия
получение алюминия. Применение алюминия. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
ПОЛУЧЕНИЕ ЭТИЛЕНА И ОПЫТЫ С НИМ
ПРАКТИЧЕСКАЯ РАБОТА. . “ПОЛУЧЕНИЕ ЭТИЛЕНА И ОПЫТЫ С НИМ”. . . / 11 класс, естественно- математическое направление/. Цель:. выявление уровня ...СЕРНАЯ КИСЛОТА И ЕЁ СВОЙСТВА
МОУ «СОШ села Рыбушка Саратовского района Саратовской области». Урок с использованием электронных образовательных ресурсов. ...КИСЛОТЫ ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
КИСЛОТЫ ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА. Цели и задачи:. сформировать представление о кислотах, как классе неорганических соединений изучив их состав, ...ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
Иванова Анна Владимировна. ГБОУ СОШ №1909 ЮВАО г. Москвы. Учитель химии. ДИФФЕРЕНЦИРОВАННЫЙ ЗАЧЕТ С ИСПОЛЬЗОВАНИЕМ ЭЛЕМЕНТОВ ИГРОВЫХ ТЕХНОЛОГИЙ ...ЖЕЛЕЗО; СТРОЕНИЕ, СВОЙСТВА
1001 идея интересного занятия с детьми. . ПЛАН-КОНСПЕКТ ОТКРЫТОГО УРОКА:. «ЖЕЛЕЗО; СТРОЕНИЕ, СВОЙСТВА». Богомолова Светлана Михайловна, Муниципальное ...Железо, ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ
Государственное бюджетное общеобразовательное учреждение. Центр образования №80. Центрального района города Санкт-Петербурга. Методическое объединение ...ГЛЮКОЗА, СТРОЕНИЕ, СВОЙСТВА
Муниципальное бюджетное общеобразовательное учреждение Каринская средняя общеобразовательная школа. Урок на тему. ГЛЮКОЗА, СТРОЕНИЕ, ...ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ: СТРОЕНИЕ, СВОЙСТВА
Тема. :. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ: СТРОЕНИЕ, СВОЙСТВА. Цель. :. Установить зависимость свойств высокомолекулярных соединений (ВМС) от строения ...АЛЮМИНИЙ, ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ
План-конспект урока. АЛЮМИНИЙ,. . ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ. Евтушенко Елена Михайловна. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 февраля 2019
Категория:Химия
Содержит:10 слайд(ов)
Поделись с друзьями:
Скачать презентацию