Презентация "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" по химии – проект, доклад
Презентацию на тему "Железо: ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
ПОЛУЧЕНИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ.
Способы получения. 1. Из ненасыщенных углеводородов (реакция гидрирования): k=Pt,Ni ; t=150ºC а) CnH2n + H2 CnH2n+2 t=25ºC; k=Ni,Pt Н3С – СН ═ СН ...Железо, его соединения и их свойства
Задачи:. Проверить знание основных теоретических вопросов темы “Железо и его соединения”; Развивать умения составлять электронный баланс и уравнения, ...Железо и его свойства
Химический элемент. Химический элемент VIII гр. Периодической системы Д.И. Менделеева. Атомный номер 26 Атомная масса 55.847. Факты. В земной коре ...ОКСИДЫ. КЛАССИФИКАЦИЯ. ПОЛУЧЕНИЕ. СВОЙСТВА
Классификация оксидов. Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, со степенью окисления -2. ...Железо элемент побочной подгруппы
Цель:. 1. Вводная тема для формирования и развития познавательного интереса к материалу. 2. Осознания учащимися исторического значения освоения железа ...Железо и его соединения
Желе́зо — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева с атомным номером ...Железо и его соединения
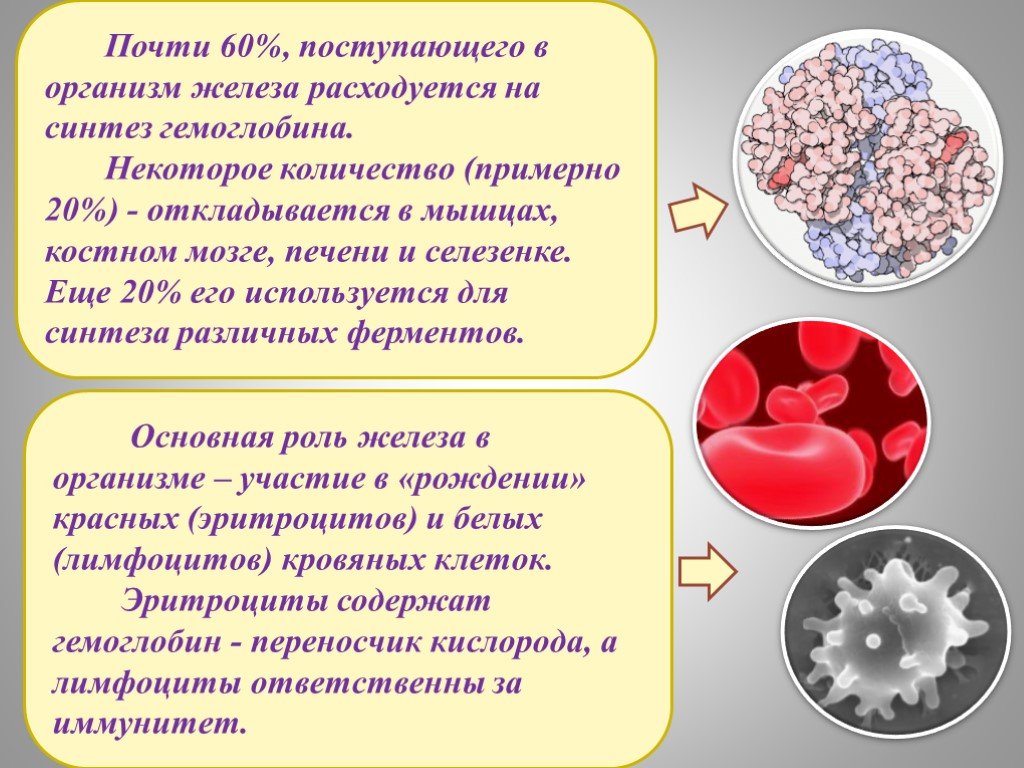
С О Д Е Р Ж А Н И Е. Положение В периодической системе. НАХОЖДЕНИЕ В ПРИРОДЕ. ОТКРЫТИЕ И ПОЛУЧЕНИЕ. ХИМИЧЕСКИЕ СВОЙСТВА. ЖЕЛЕЗО В ОРГАНИЗМЕ И ЕГО ...Железо и его соединения
Закрепление и обобщение материала по теме: «Железо и его соединения». 9 класс. Путешествие по стране химических вопросов. ЗНАНИЯ - ЭТО ИСТИННЫЕ СОКРОВИЩА, ...Железо и его соединения
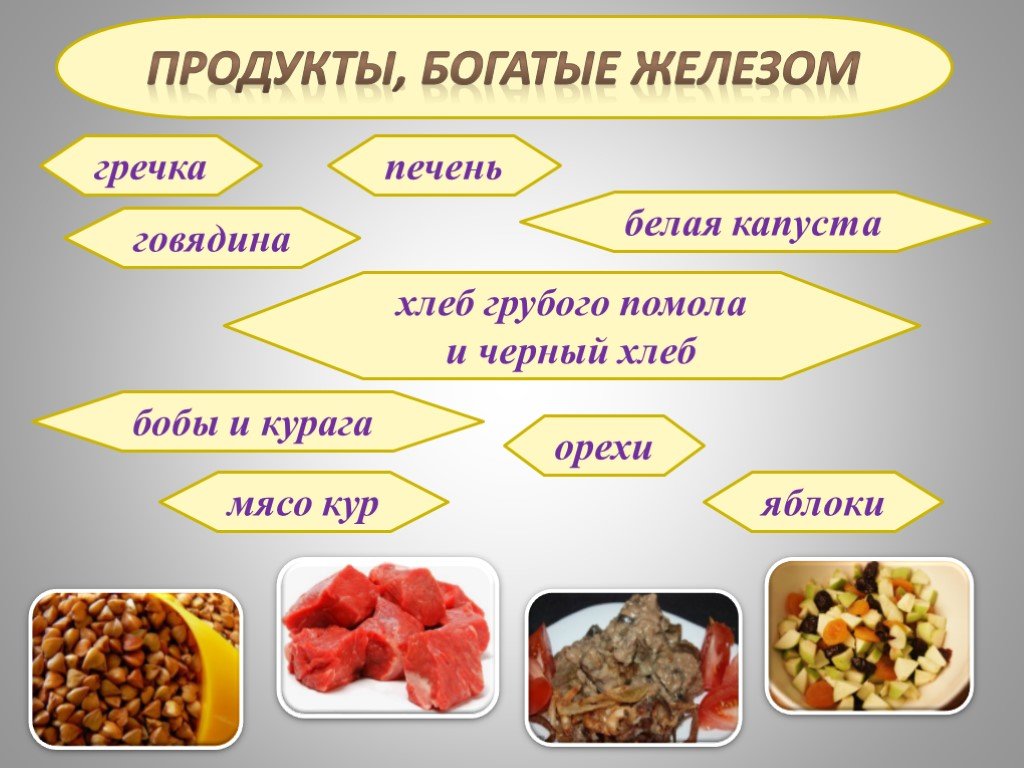
Загадка Очень древний я металл, Счёт столетьям потерял. Был нескромным я не в меру, Тысячи лет до нашей эры. А за блеск, мерцавший холодом, Люди там ...Железо в продуктах питания
Цели и задачи. Железо, как элемент таблицы Д. И. Менделеева. Полезные свойства железа. Содержание железа в продуктах питания. Железо. Железо — элемент ...Железо – элемент побочной подгруппы
Общая характеристика железа. Нахождение в природе. Fe ХАЛЬКОПИРИТ ПИРИТ ЧЁРНЫЙ ПИРИТ ГЕМАТИТ. 1s2 2s2 2p6 3s2 3p6. Краткая электронная формула. Валентные ...Железо
Fe Это элемент № 26. Это элемент 4- ого периода. Четвертый по распространенности элемент в земной коре, второй среди металлов. Это элемент 8 группы ...Железо
Проверка домашнего задания. Упражнение №5 Al2 (SO4)3+ KOH(нед) = Al 2(SO4)3+ KOH(изб.) = Упражнение №6 Al AlCl3 Al(OH)2 Al2 O3 NaAlO2 Al ...Железо
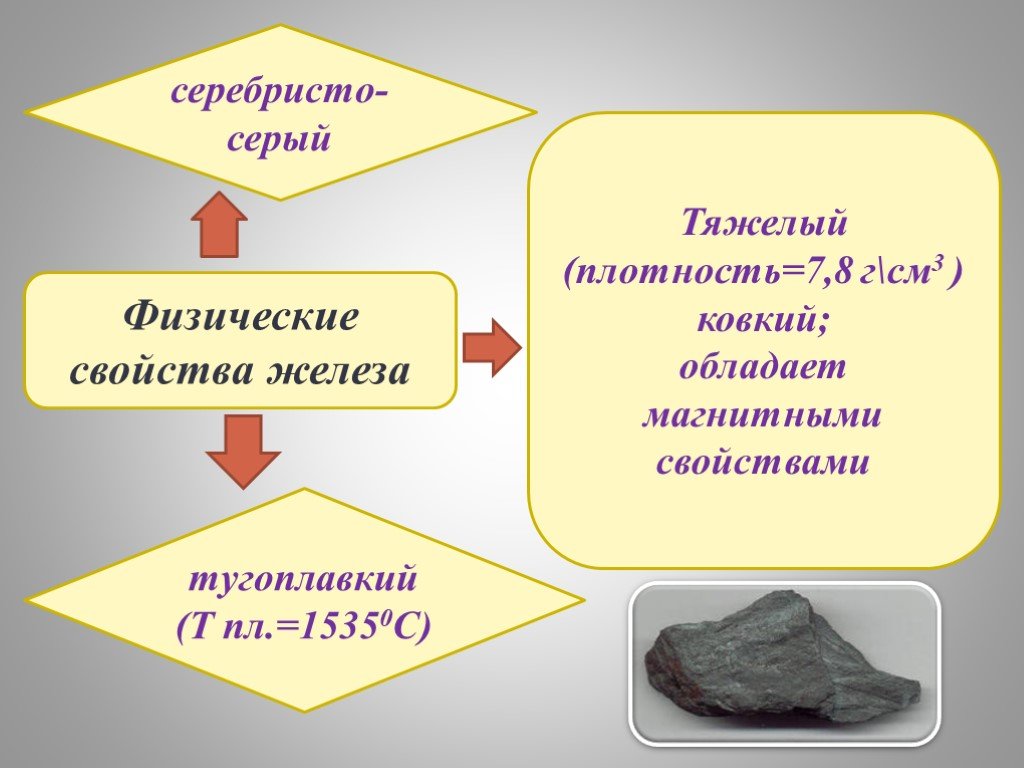
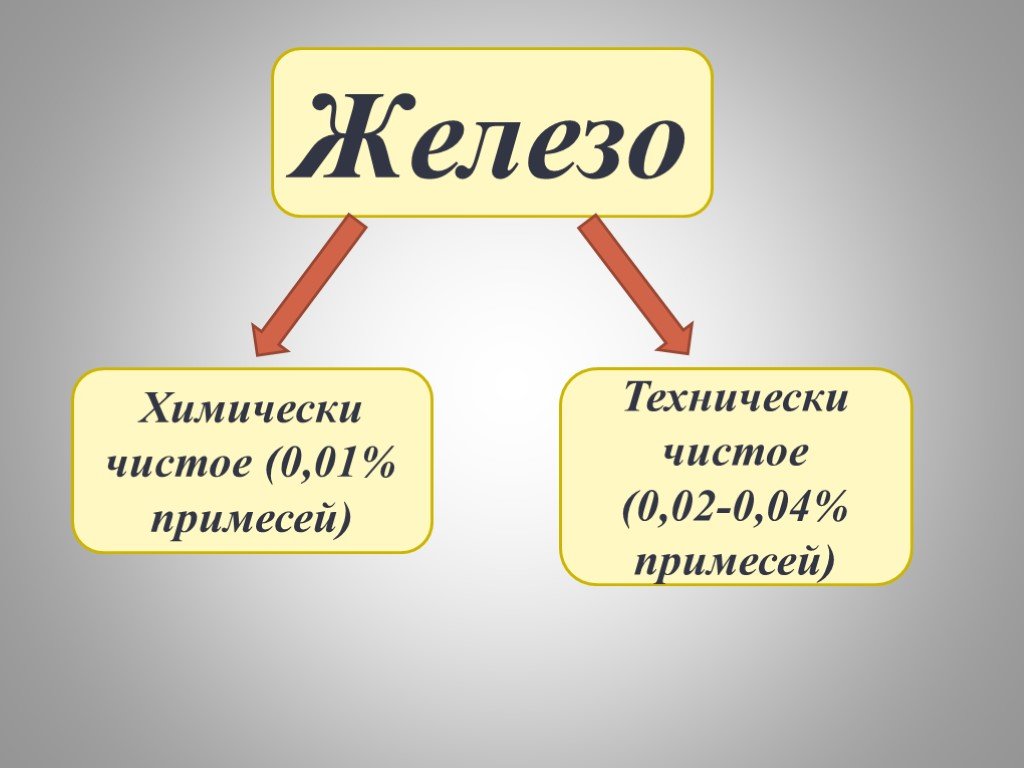
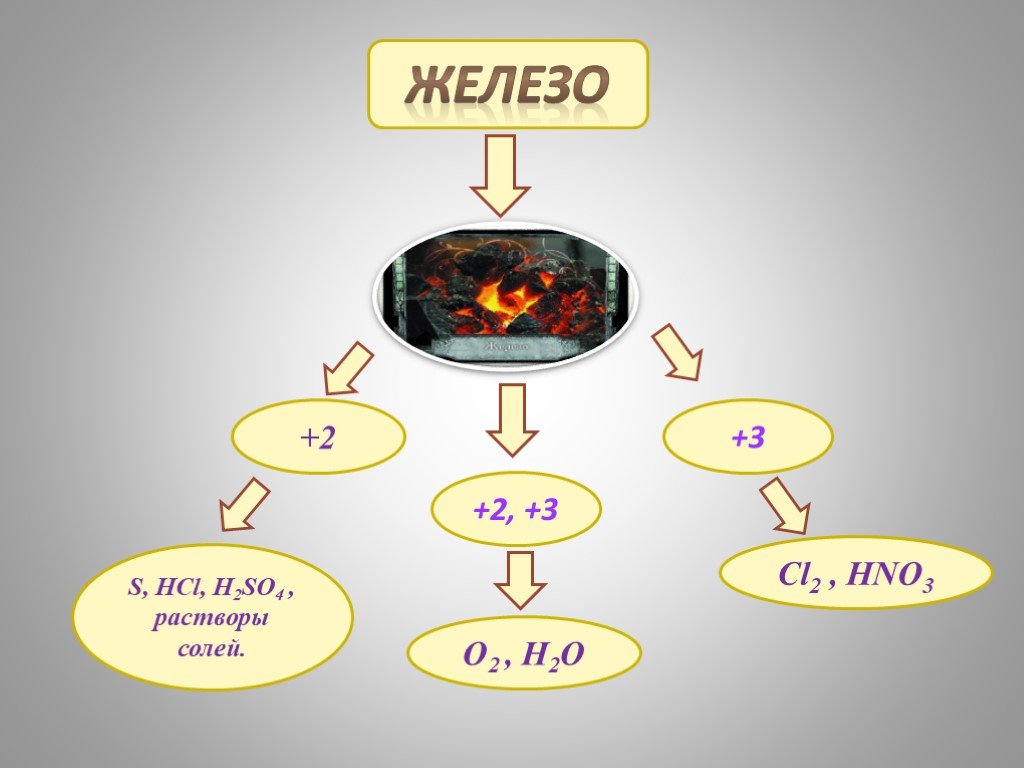
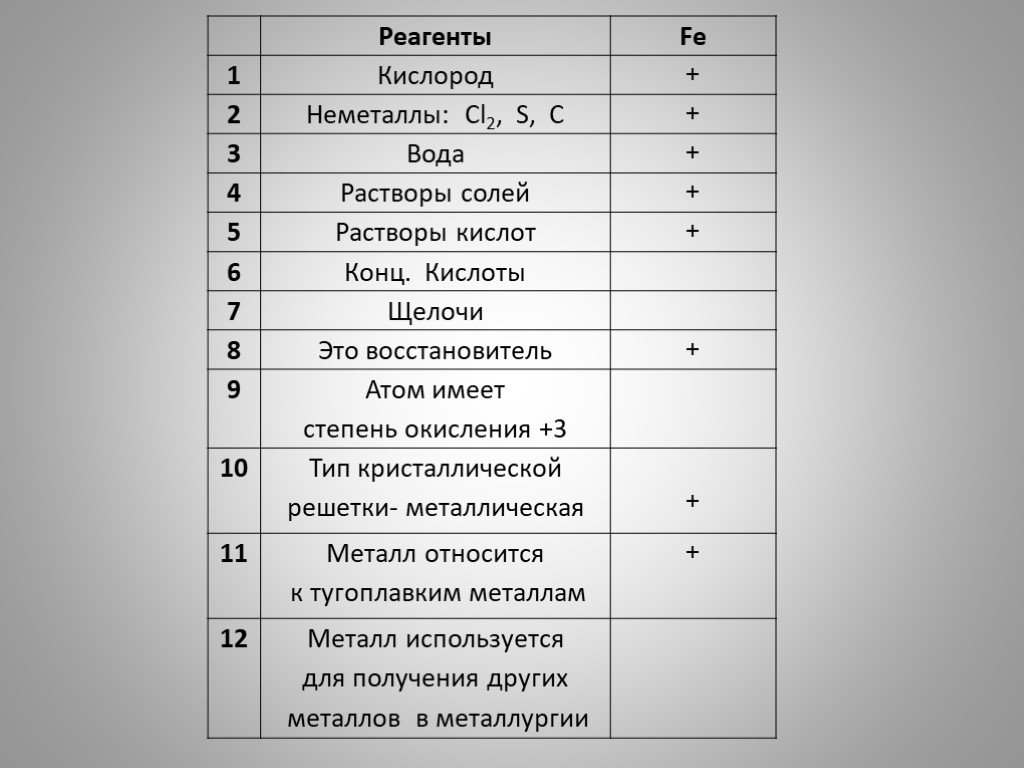
План:. I. ЖЕЛЕЗО КАК ХИМИЧЕСКИЙ ЭЛЕМЕНТ. II. НАХОЖДЕНИЕ В ПРИРОДЕ И ПРИМЕНЕНИЕ ЖЕЛЕЗА III. ФИЗИЧЕСКИЕ СВОЙСТВА. IV. ХИМИЧЕСКИЕ СВОЙСТВА. i. как химический ...СВОЙСТВА ДРЕВЕСИНЫ И ПЛАСТМАСС
2.1 Физические свойства древесины. Плотность: древесины, защищенной от увлажнения (кг/м3) Хвойные: лиственница 650 сосна, ель, кедр, пихта 500 Твердые ...БЕНЗОЛ: ОСОБЕННОСТИ СТРОЕНИЯ, СВОЙСТВА
Эпиграф. А.Дистеверг:«Не в количестве знаний заключается образование, но в полном понимании и искусном применении всего того, что знаешь». Девиз : ...Его Величество Железо
ЦЕЛИ:. Ознакомиться с особенностями металлургического комплекса России Изучить химические и физические свойства простого вещества - железа, ознакомиться ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Конспекты
ЖЕЛЕЗО; СТРОЕНИЕ, СВОЙСТВА
1001 идея интересного занятия с детьми. . ПЛАН-КОНСПЕКТ ОТКРЫТОГО УРОКА:. «ЖЕЛЕЗО; СТРОЕНИЕ, СВОЙСТВА». Богомолова Светлана Михайловна, Муниципальное ...Железо, ЕГО СТРОЕНИЕ, СВОЙСТВА И ПРИМЕНЕНИЕ
Государственное бюджетное общеобразовательное учреждение. Центр образования №80. Центрального района города Санкт-Петербурга. Методическое объединение ...Железо и его соединения
Тема:. Задачи:. Образовательные:. Воспитательные:. Развивающие:. Тип урока:. Методы и методические приёмы:. Оборудование:. ...Железо и его соединения
Железо и его соединения. МБУ лицей № 51 г.о.Тольятти. . 9 класс. . Тип урока:. урок формирования новых знаний и умений с использованием групповых ...Железо и его соединения
ТЕМА: «Железо и его соединения». . Цель:. . . Изучить физические свойства железа. Охарактеризовать место. Fe. в П.С.Х.Э. изучить химические ...Железо и его соединения
Начальное профессиональное образование. Профессиональное училище №63. Г. Гуково Ростовской области. Конспект урока по химии. . 9 класс. ...Алюминий. Железо
План учебного занятия № 12. Дата Предмет. химия. группа. Ф.И.О. преподавателя:. Кайырбекова И.А. . І. Тема занятия:. Алюминий. Железо. Тип занятия:. ...ПЕРВОНАЧАЛЬНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ
Иванова Анна Владимировна. ГБОУ СОШ №1909 ЮВАО г. Москвы. Учитель химии. ДИФФЕРЕНЦИРОВАННЫЙ ЗАЧЕТ С ИСПОЛЬЗОВАНИЕМ ЭЛЕМЕНТОВ ИГРОВЫХ ТЕХНОЛОГИЙ ...Железо
...Железо
ПЛАН-КОНСПЕКТ УРОКА Железо. . ФИО (полностью). . . Петухова Юлия Валентиновна. . . . Место работы. . МБОУ СОШ с. Георгиевка ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:5 декабря 2018
Категория:Химия
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию