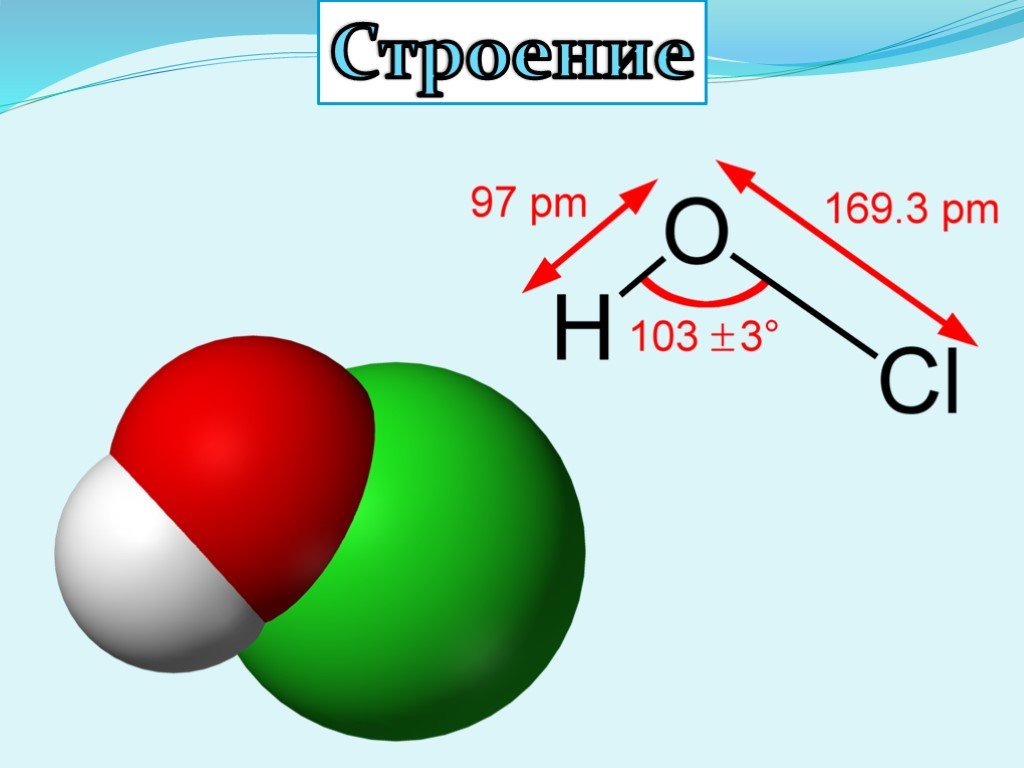
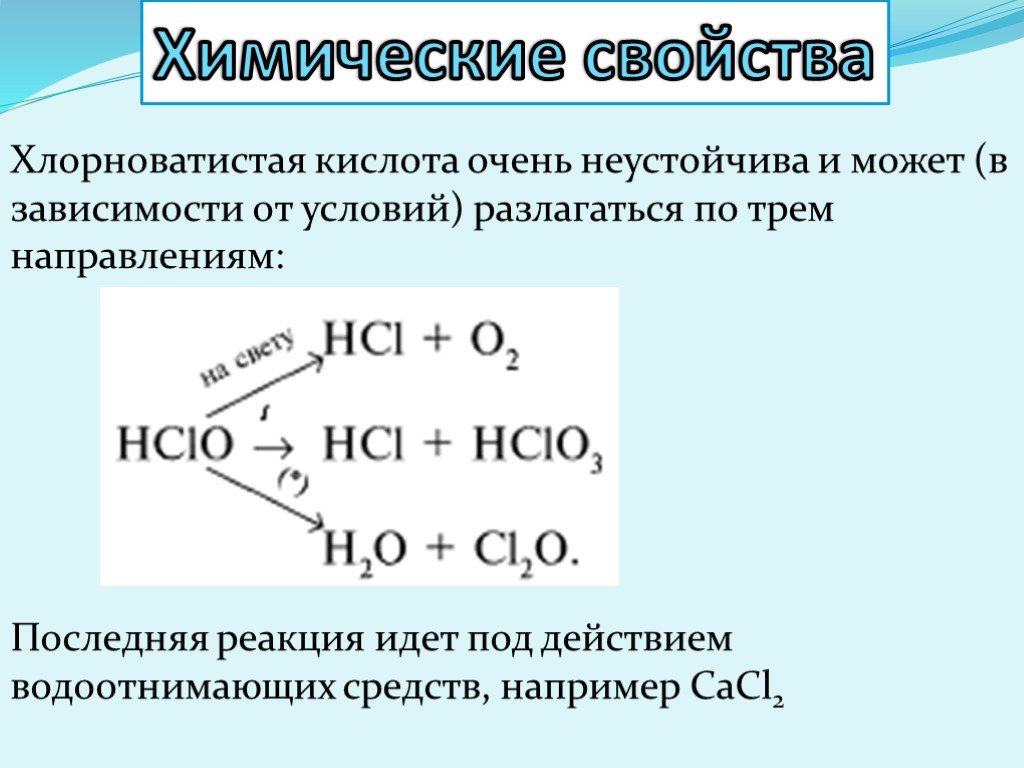
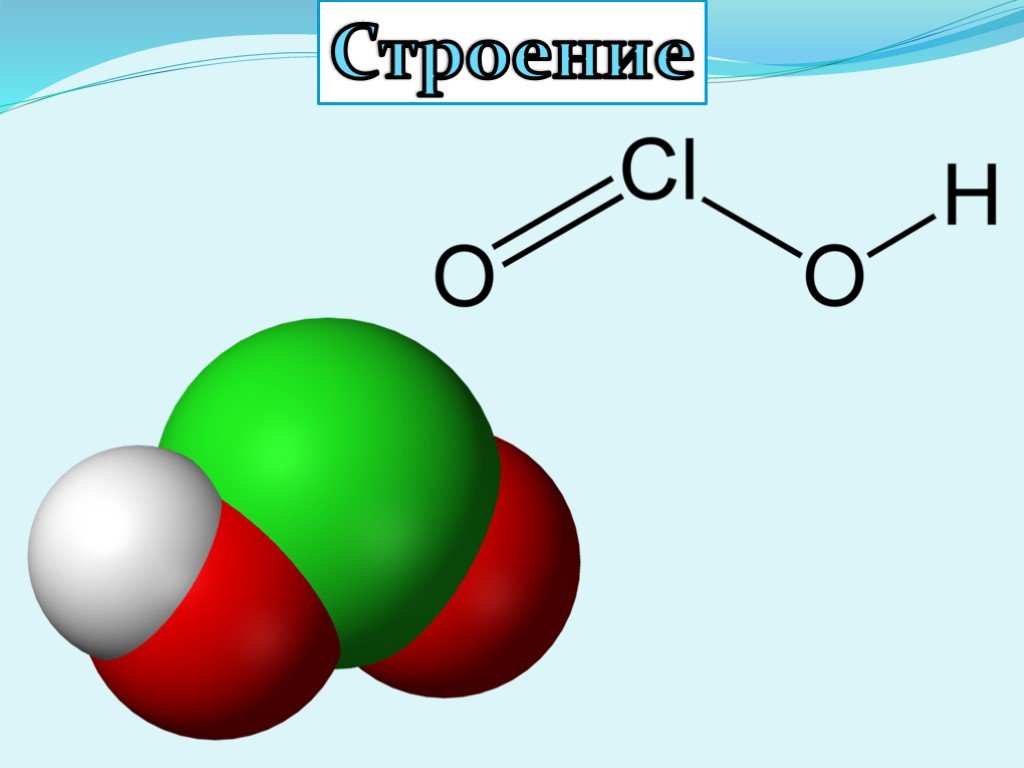
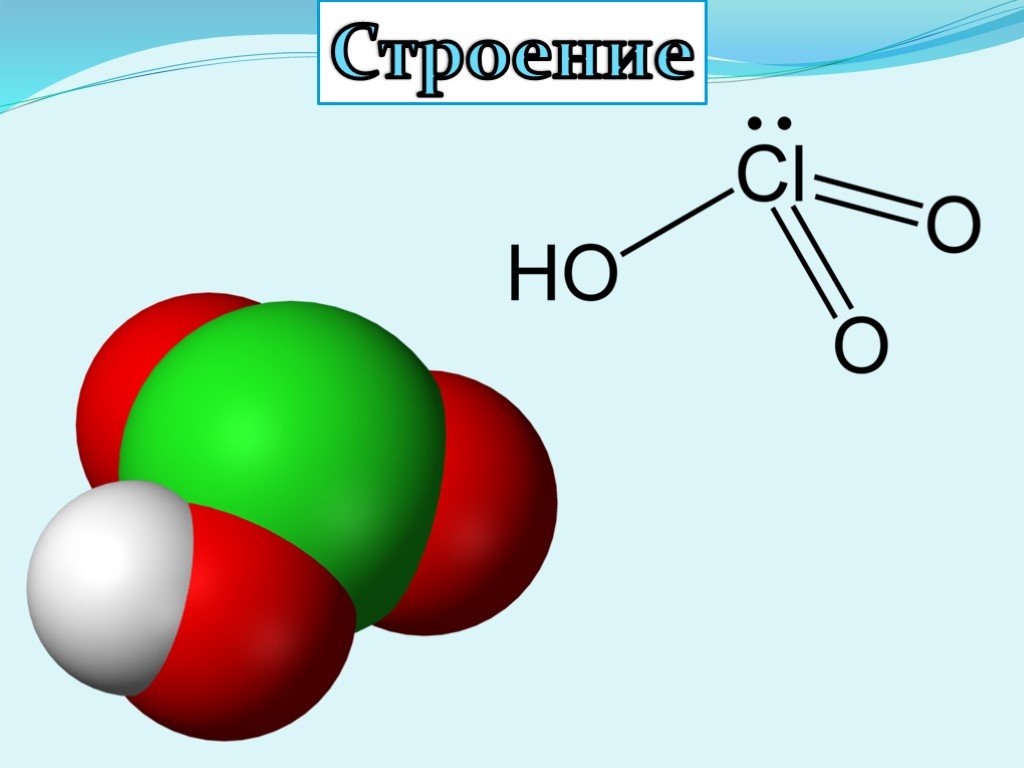
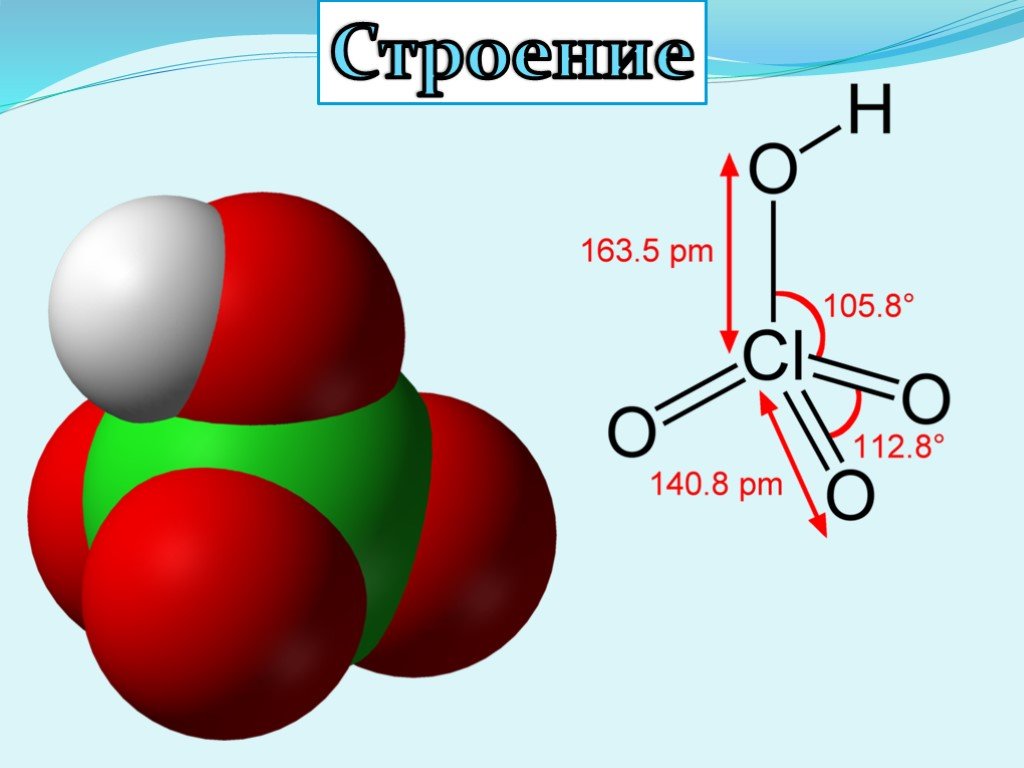
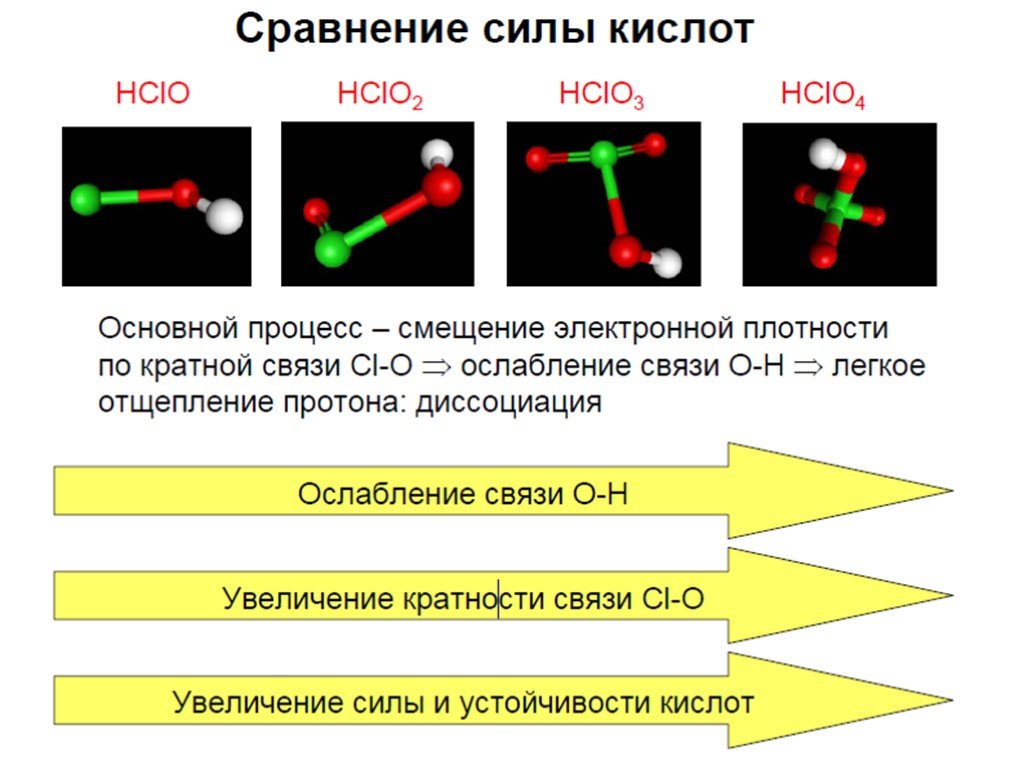
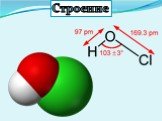
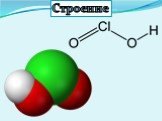
Презентация "Кислородсодержащие кислоты хлора" по химии – проект, доклад
Презентацию на тему "Кислородсодержащие кислоты хлора" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 29 слайд(ов).
Слайды презентации
Список похожих презентаций
Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Органические кислоты
Почти во всех продовольственных товарах содержатся кислоты или их кислые и средние соли. В продукты переработки кислоты переходят из сырья, они также ...Высшие природные полимеры - Белки и Нуклеиновые кислоты
Цель урока: Закрепить и углубить представления учащихся о природных полимерах на примере белков и нуклеиновых кислот. Систематизировать знания о составе, ...Соль азотной кислоты
знать и уметь. называть соли азотной кислоты, определять какие свойства окислительные или и восстановительные характерны для них; определять: степень ...Серная кислота, свойства серной кислоты
Состав. Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R, где R-кислотный остаток При электролитической ...Производство серной кислоты (польза и вред)
Цель работы:. Узнать: из чего получают серную кислоту; как получают серную кислоту; для чего получают серную кислоту; вредно ли производство серной ...Производство серной кислоты
Сернокислотные заводы. Пирит обыкновенный. Черный пирит. Самородная сера. Сероводород. Сульфиды цветных металлов. Подготовка сырья. Измельчение пирита. ...Предельные одноосновные карбоновые кислоты
Назовите вещества. СН3-СН2-ОН. Соотнесите формулу вещества и его название. Формула 1) СН3-СН2-ОН 2) С3Н8 3) СН3-ОН 4). Название а) пропан б) метанол ...Карбоновые кислоты
Классификация карбоновых кислот. По числу карбоксильных групп. непредельные ароматические одноосновные двухосновные многоосновные предельные. По типу ...Карбоновые кислоты
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН(карбоксил). Формулы и названия некоторых распространённых ...Карбоновые кислоты
План изучения темы:. Определение. Классификация карбоновых кислот. Номенклатура . Изомерия. Физические свойства. 6. Химические свойства. 7. Получение. ...Карбоновые кислоты
Цель урока. Дать понятие о карбоновых кислотах и их классификации. Рассмотреть основы международной и тривиальных номенклатур, применение карбоновых ...Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых ...Карбоновые кислоты
Карбоновые кислоты. Карбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH). Классификация карбоновых ...Пищевые кислоты
Виды пищевых кислот. Самые распространённые виды кислот: лимонная, виннокаменная, молочная, яблочная, уксусная. Лимонная кислота. Лимо́нная кислота́ ...Получение уксусной кислоты и опыты с ней
Техника безопасности. Помните, что любое вещество может быть опасным, если обращаться с ним неправильно. Вещества не должны храниться вместе с пищевыми ...Карбоновые кислоты
Метановая кислота, НСООН. Муравьиная кислота В природе: хвоя, крапива, фрукты, выделения пчёл и муравьёв Применение: заготовка корма - антибактериальное ...Применение кислоты
Царская водка-это не алкогольный напиток, а весьма сильный растворитель. Он состоит из смеси концентрированных кислот: азотной HNO3 (1 объём) и соляной ...Карбоновые кислоты
Тема урока: Карбоновые кислоты. Цели урока: рассмотреть строение молекул карбоновых кислот и карбоксильной группы; познакомиться с классификацией ...Производство серной кислоты
Цель: обобщить сведения о стадиях и принципах, используемых при промышленном производстве серной кислоты. Рифмованные строчки. Для закрепления сейчас ...Конспекты
Пути познания серной кислоты
Пути познания. серной кислоты. Познание - это солнечный свет, без которого не может развиваться человечество. Н.Бердяев. «. О мощности государства ...Соли азотной кислоты
Петрова Марина Валериевна. МОУ «Кокшамарская средняя общеобразовательная школа им.И.С.Ключникова-Палантая» Звениговского района Республики Марий ...Приключения серной кислоты
Урок - сказка «Приключение Серной Кислоты». (9 класс). Цели урока: Закрепить и проверить знания учащихся по теме «Подгруппа кислорода», сравнить ...Производство серной кислоты
Производство серной кислоты. . Сырьё для получения:. самородная ромбическая сера, пирит (серный колчедан, железный колчедан), сульфиды цветных ...Окислительные свойства азотной кислоты
Дата_____________ Класс_______________. Тема:. . Окислительные свойства азотной кислоты. Цели урока:. знать строение, свойства и применение ...Окислительные свойства серной кислоты
Конспект урока. Данные об учителе: Загребина Анастасия Павловна. учитель МБОУ Июльской СОШ, 1 категория, запрашиваемая 1 категория. Предмет. : химия. ...Карбоновые кислоты
Проект конспекта урока. Педагог:. Корепанова Светлана Вячеславовна, учитель химии и биологии МБОУ Игринская СОШ № 2 Удмуртской Республики. Категория ...Азотная кислота и ее соли. Окислительные свойства азотной кислоты
Урок 21. Азотная кислота и ее соли. Окислительные свойства азотной кислоты. Цели урока:. 1. Охарактеризовать азотную кислоту по следующей схеме: ...Карбоновые кислоты
Тема №4, Урок №8 (1ч) Утверждаю_______________. « Карбоновые кислоты». Тип урока:. урок формирования новых знаний. Форма урока:. комбинированная. ...Карбоновые кислоты
Войстрик Т.И. учитель химии, биологии. Белагашская школа-сад. Жаксынского района. Акмолинской области. Урок химии в 9 классе. Тема: Карбоновые ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Содержит:29 слайд(ов)
Поделись с друзьями:
Скачать презентацию