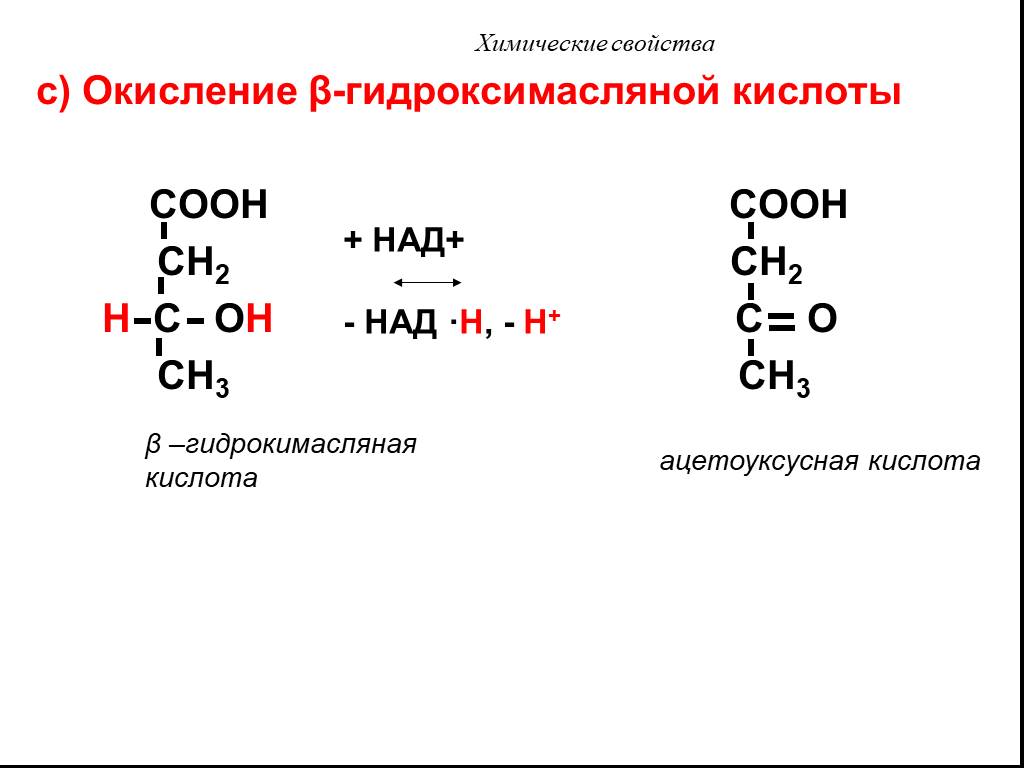
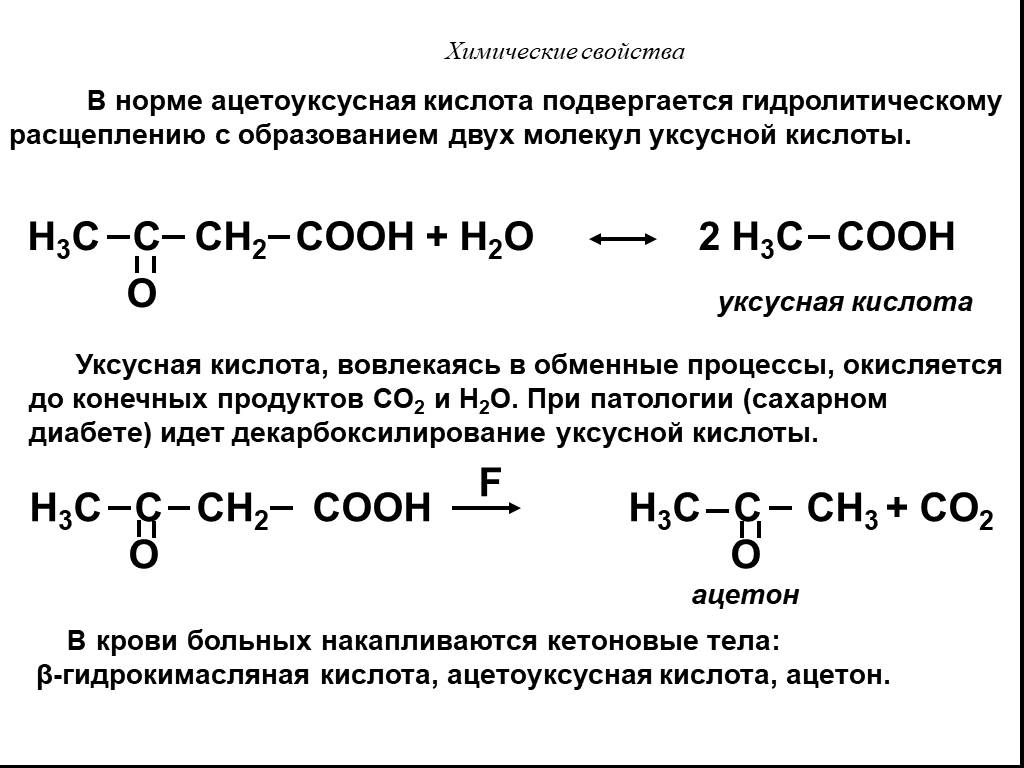
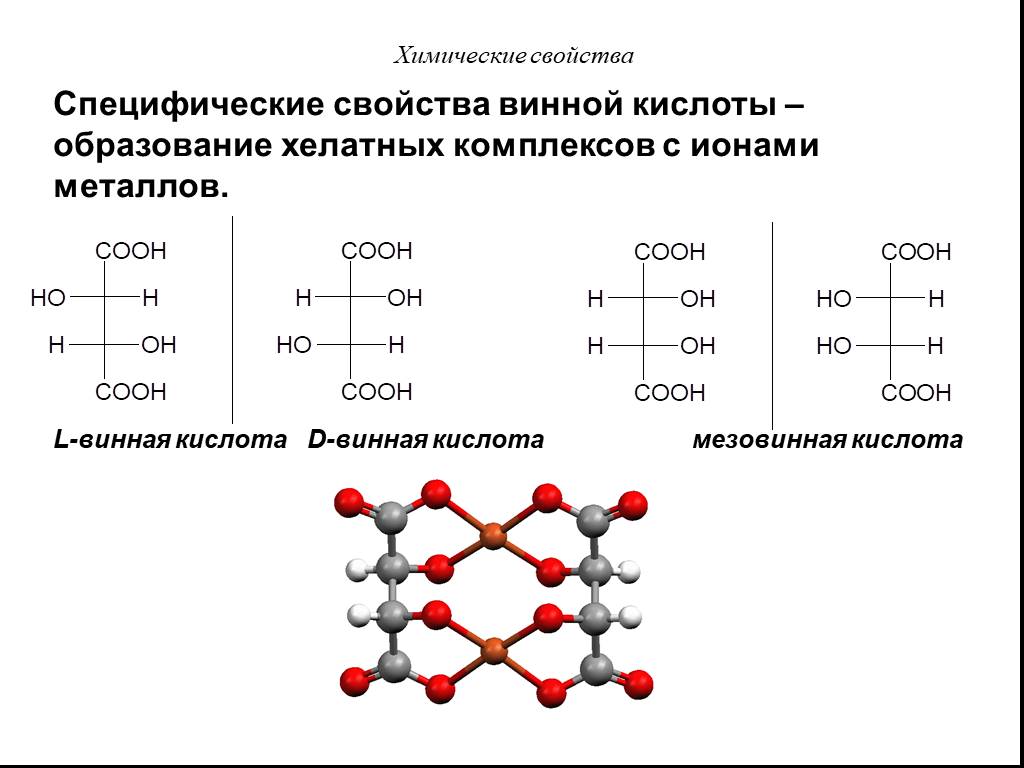
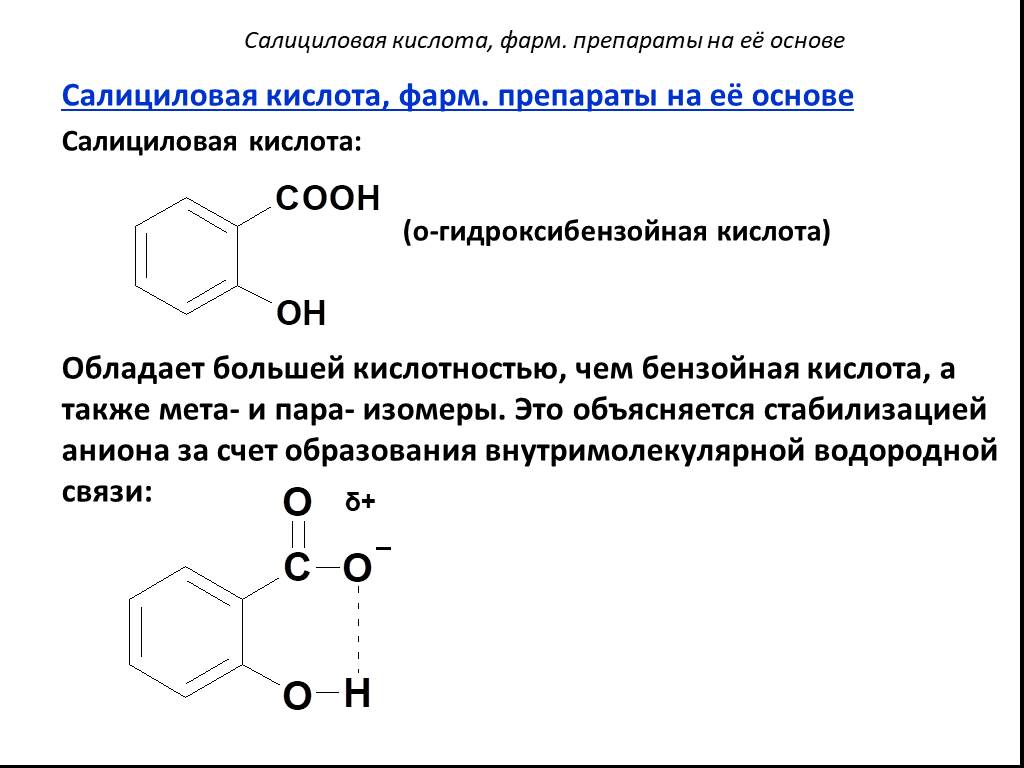
Презентация "Карбоновые кислоты" по химии – проект, доклад
Презентацию на тему "Карбоновые кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 54 слайд(ов).
Слайды презентации
Список похожих презентаций
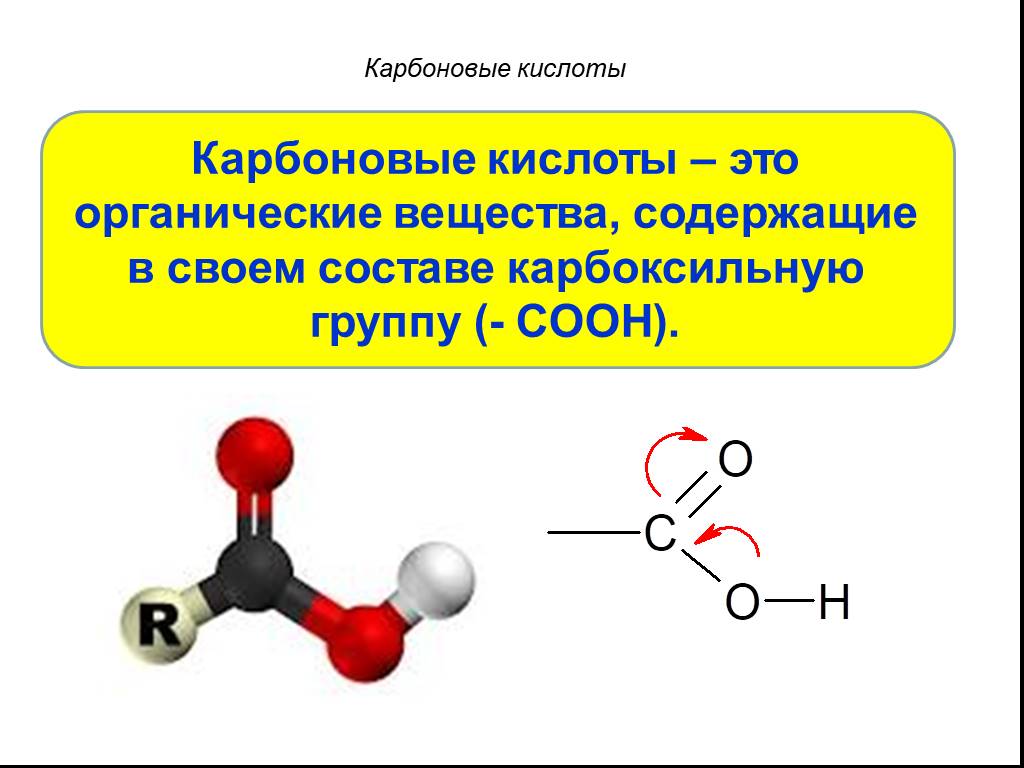
Карбоновые кислоты
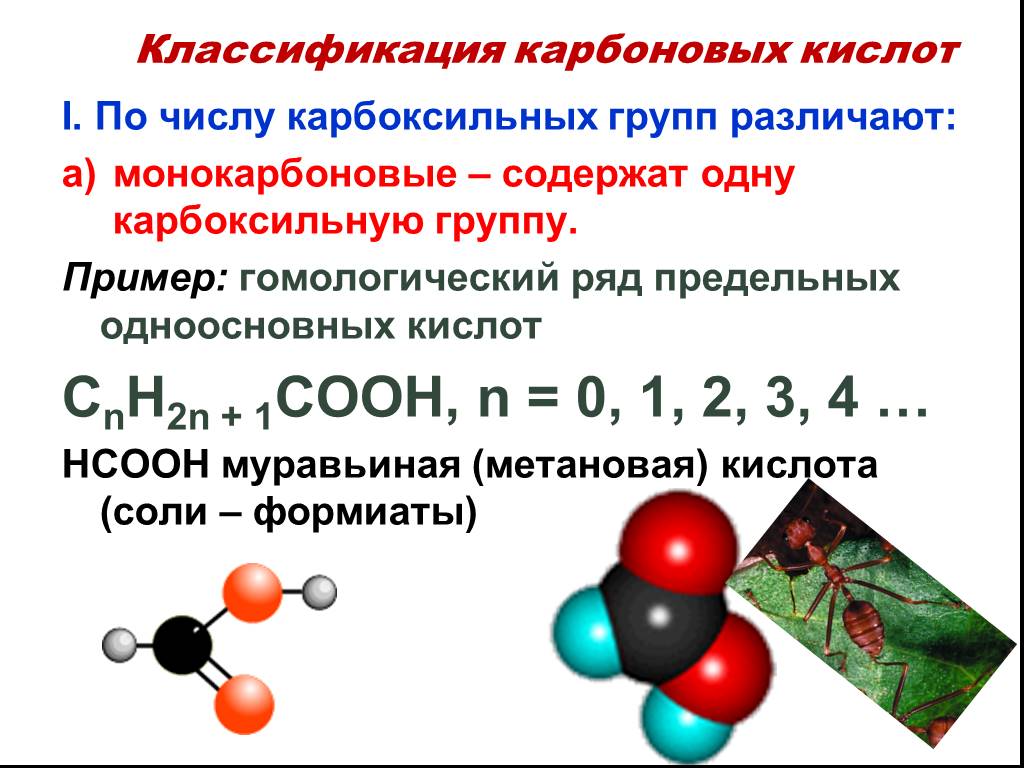
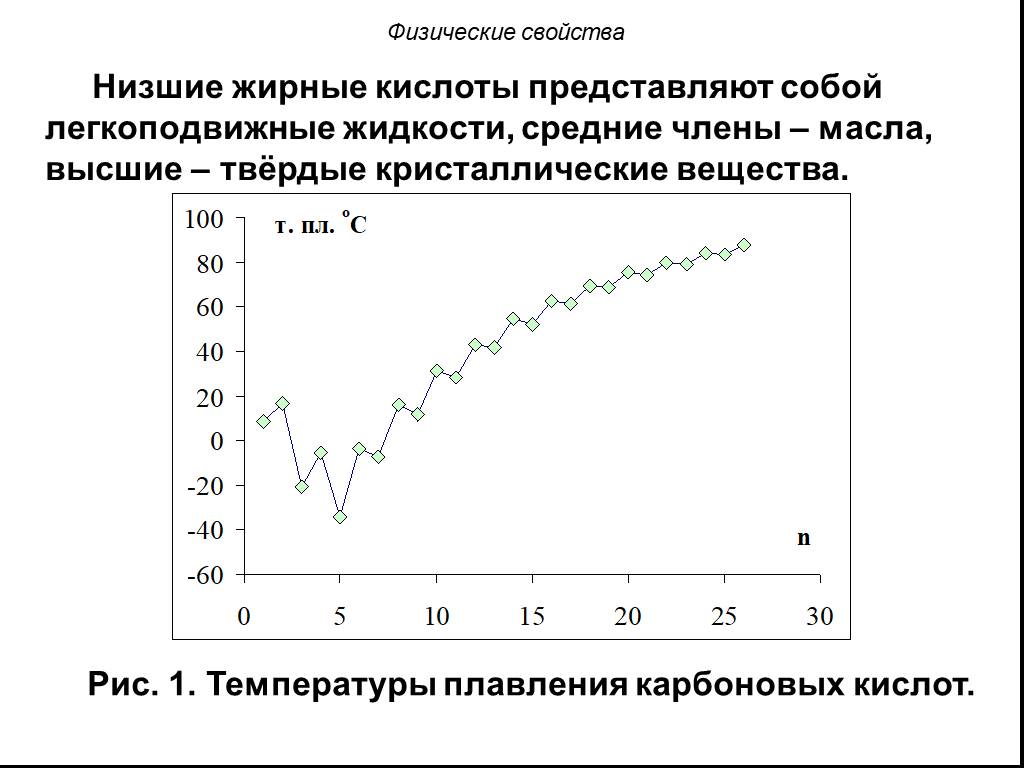
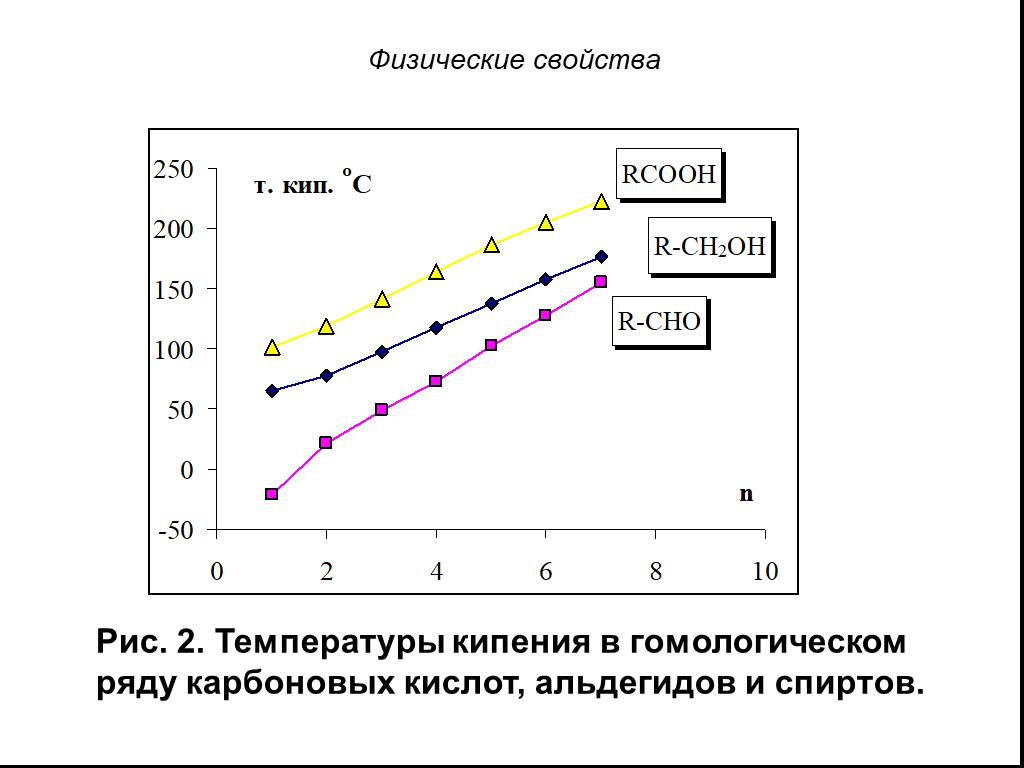
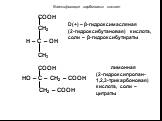
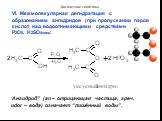
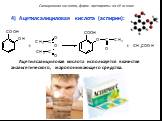
Метановая кислота, НСООН. Муравьиная кислота В природе: хвоя, крапива, фрукты, выделения пчёл и муравьёв Применение: заготовка корма - антибактериальное ...Карбоновые кислоты
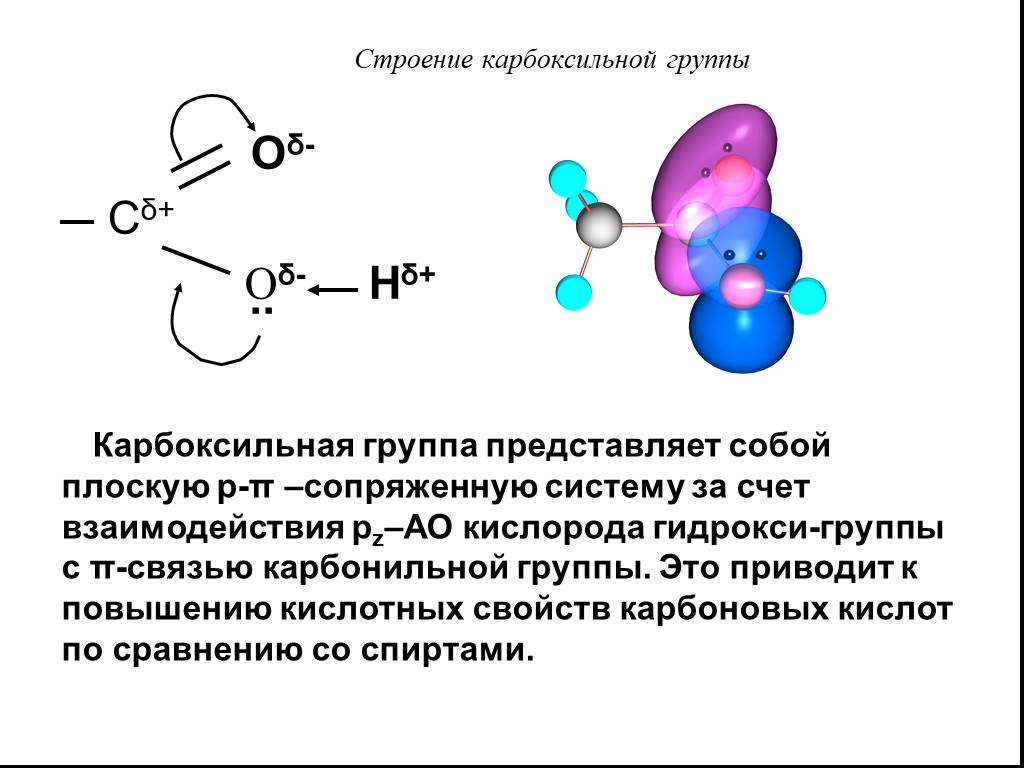
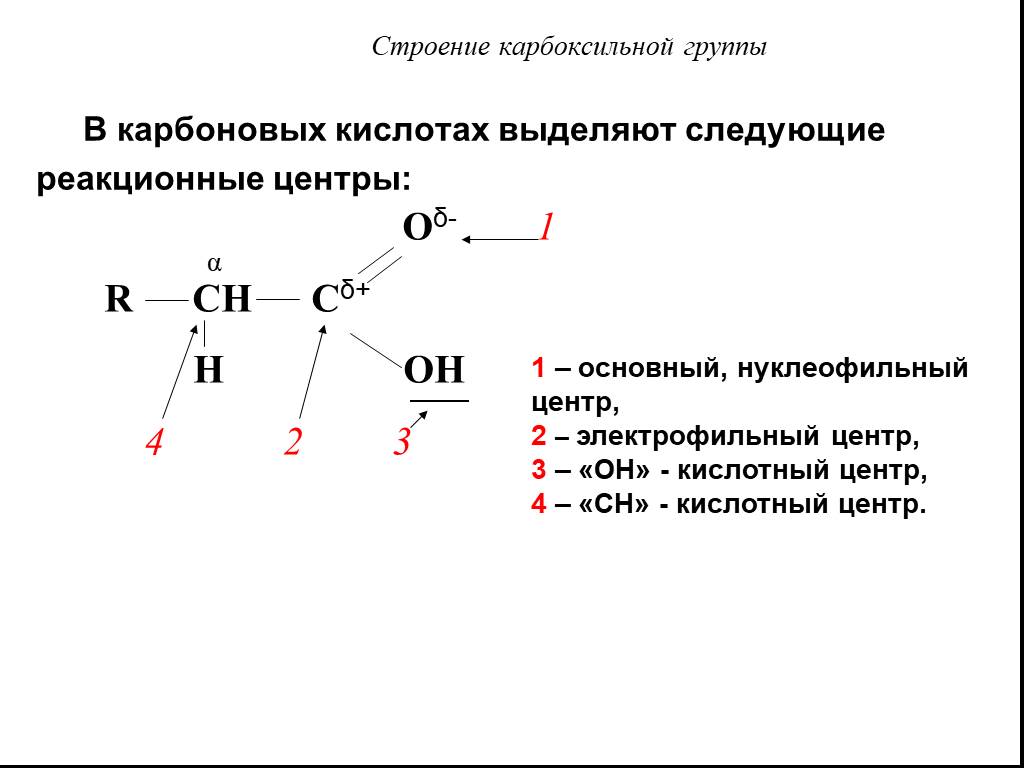
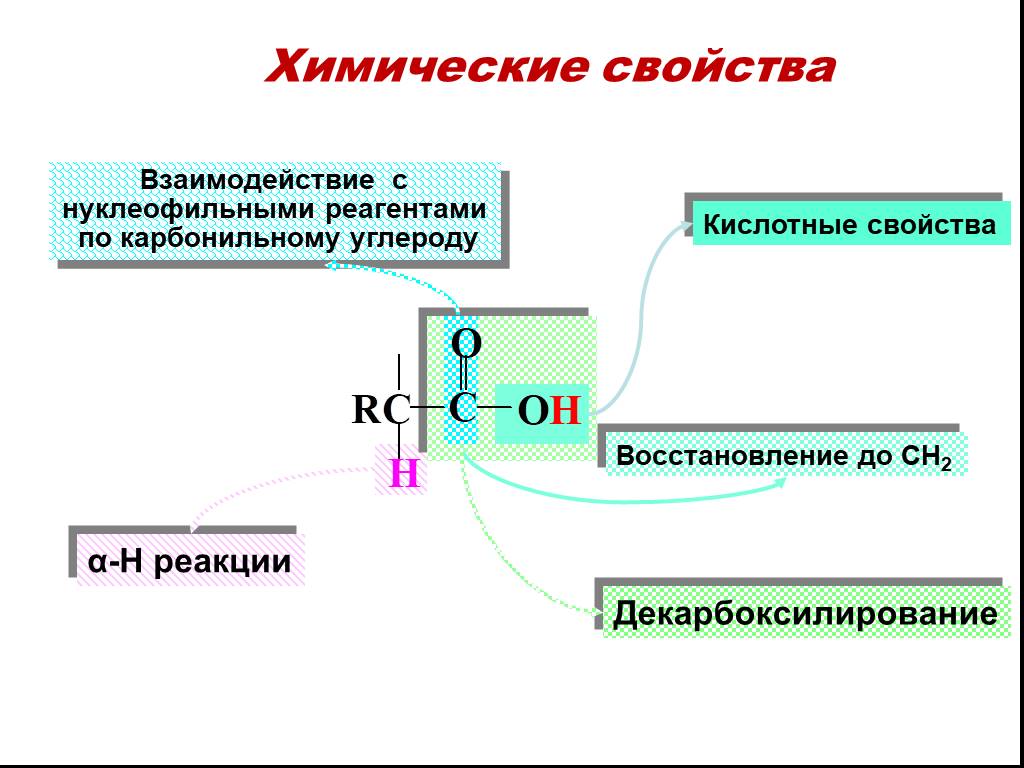
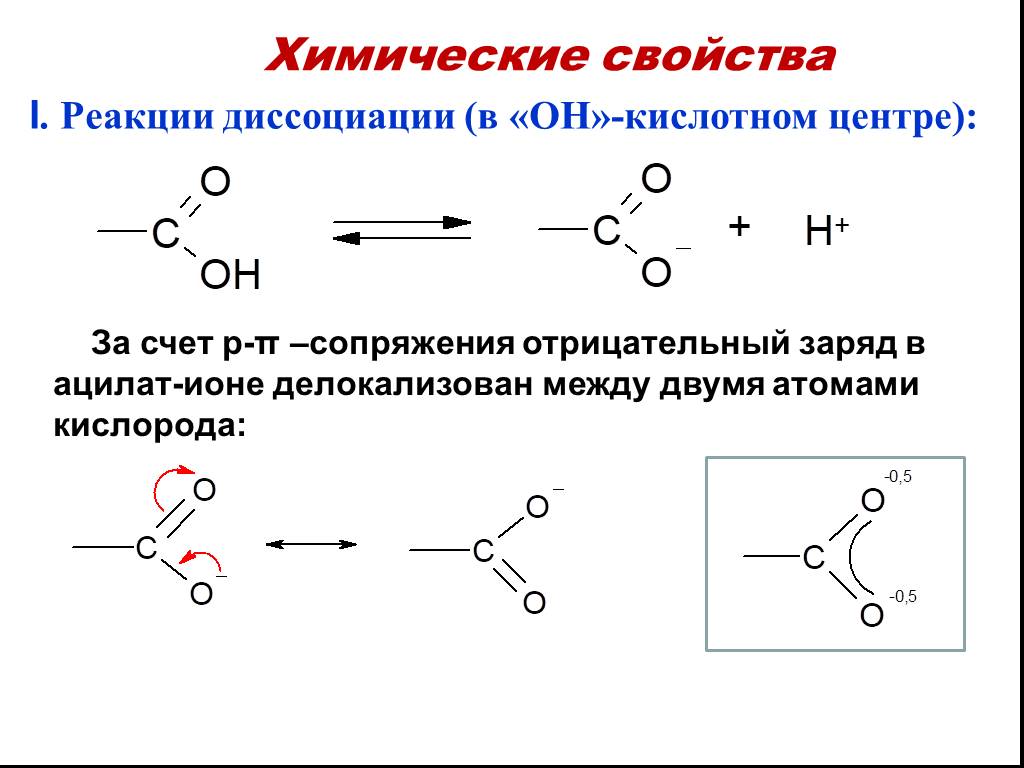
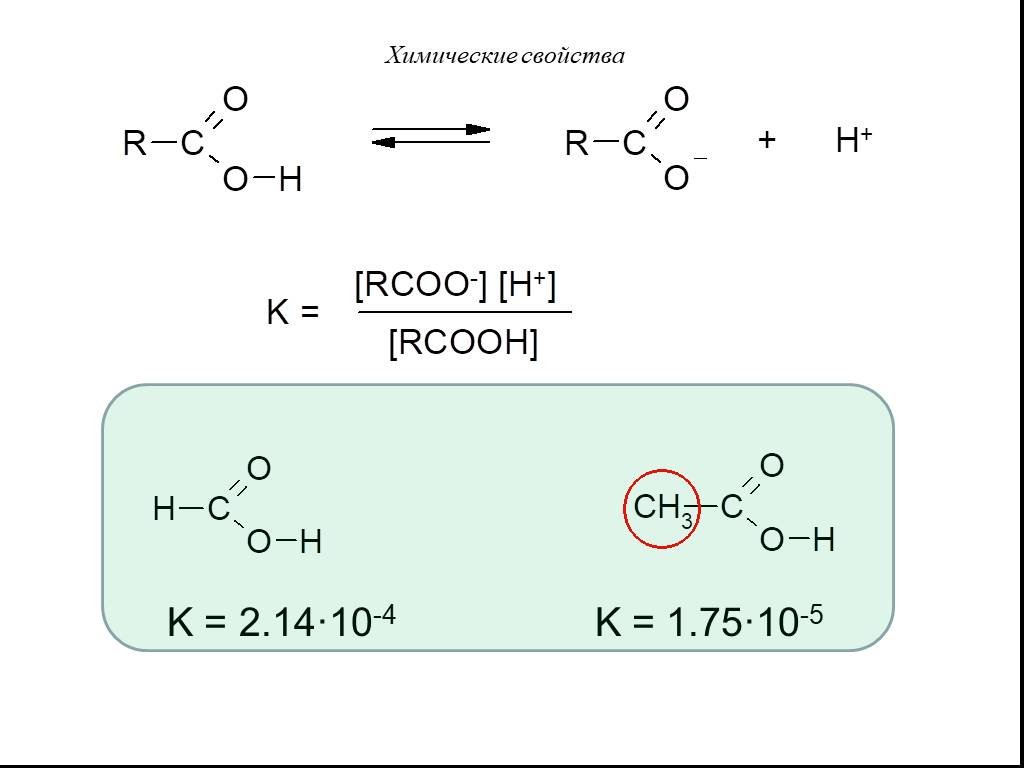
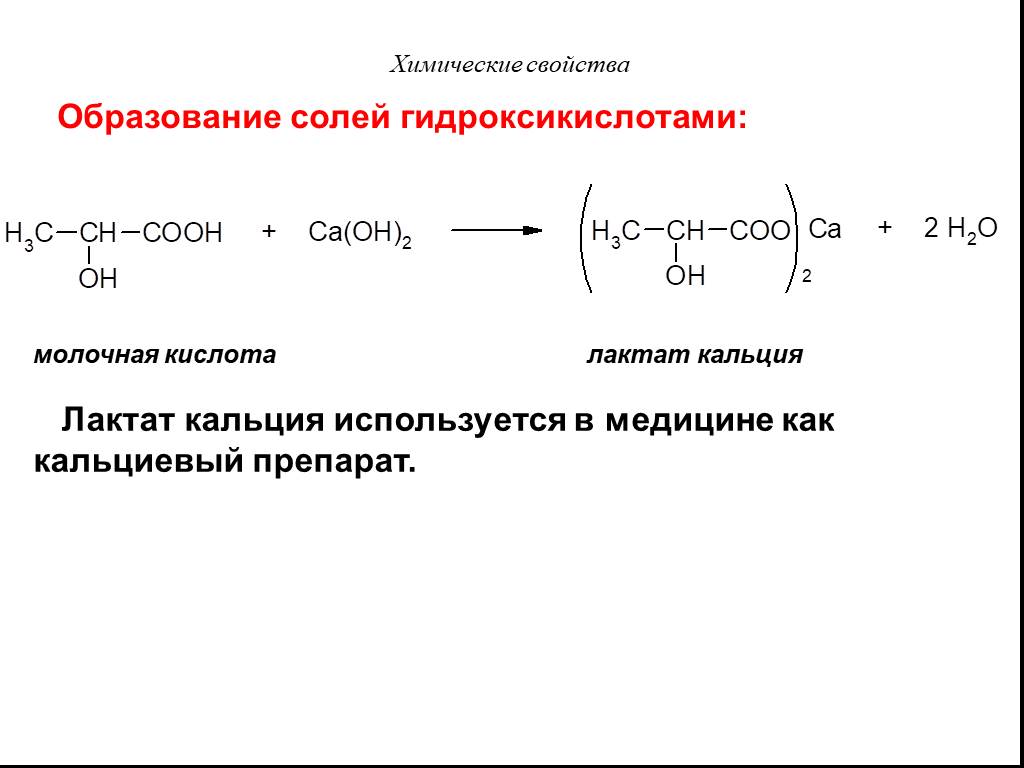
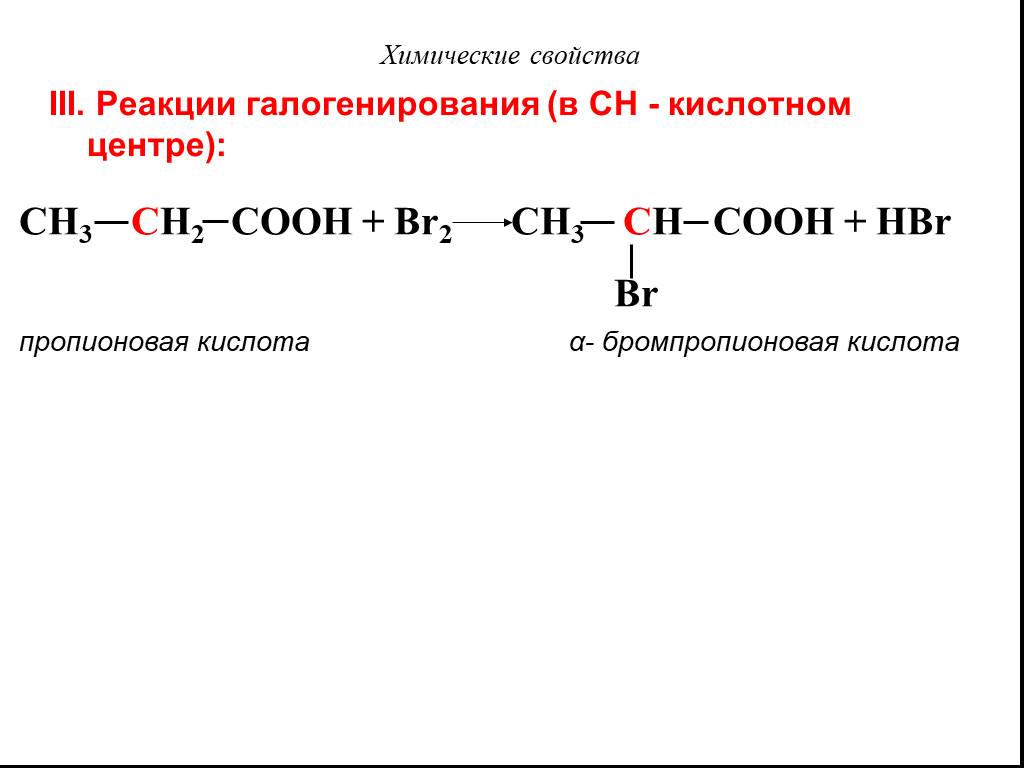
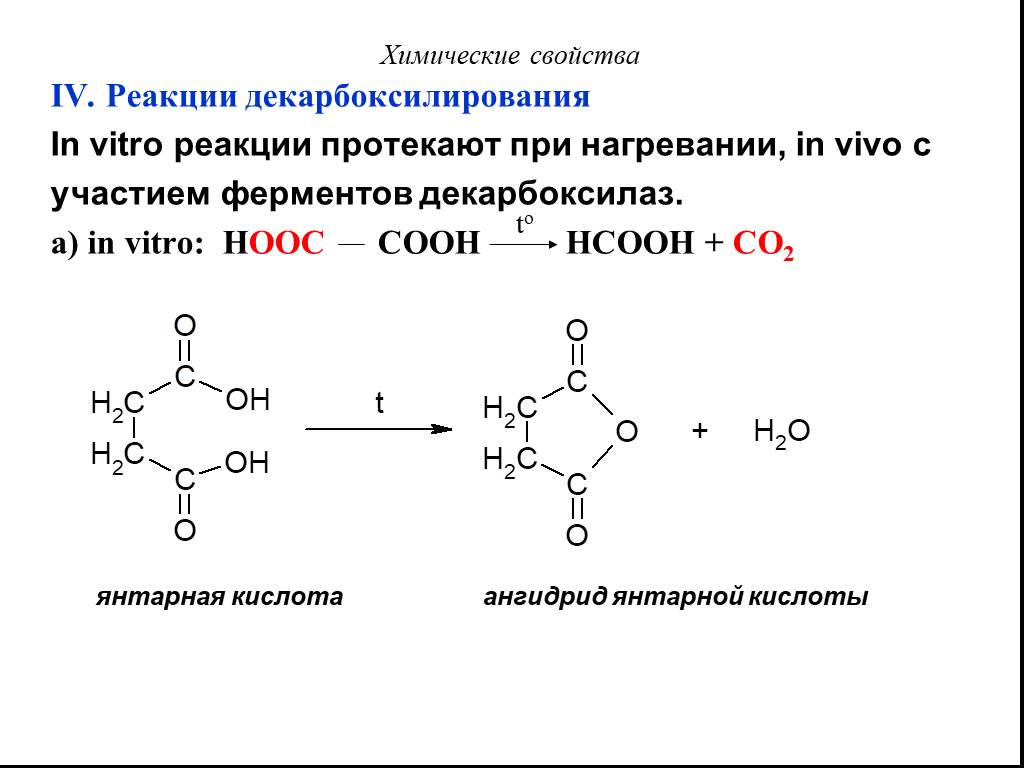
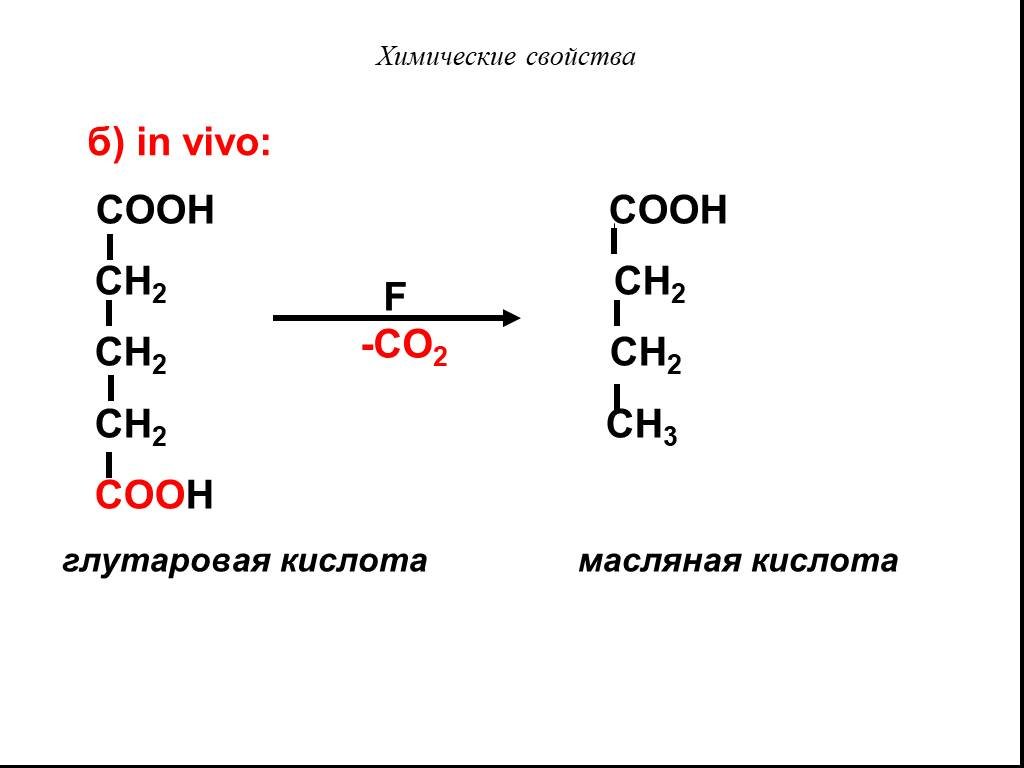
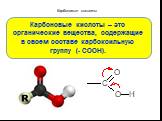
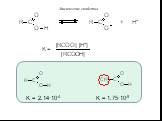
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН(карбоксил). Формулы и названия некоторых распространённых ...Карбоновые кислоты
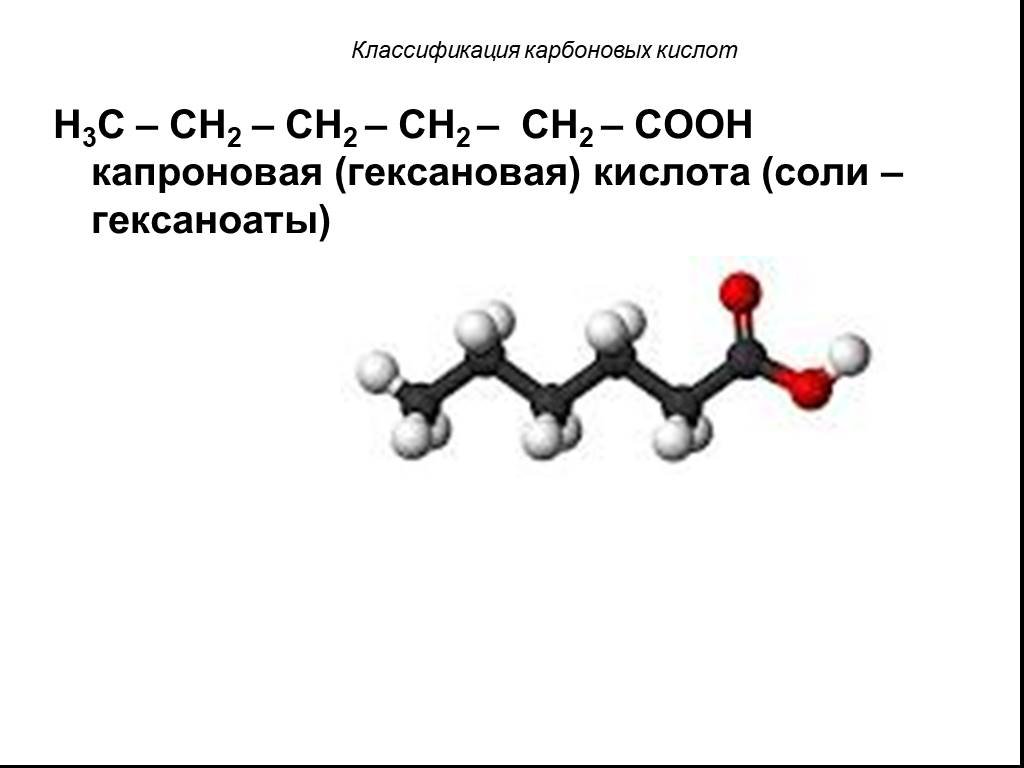
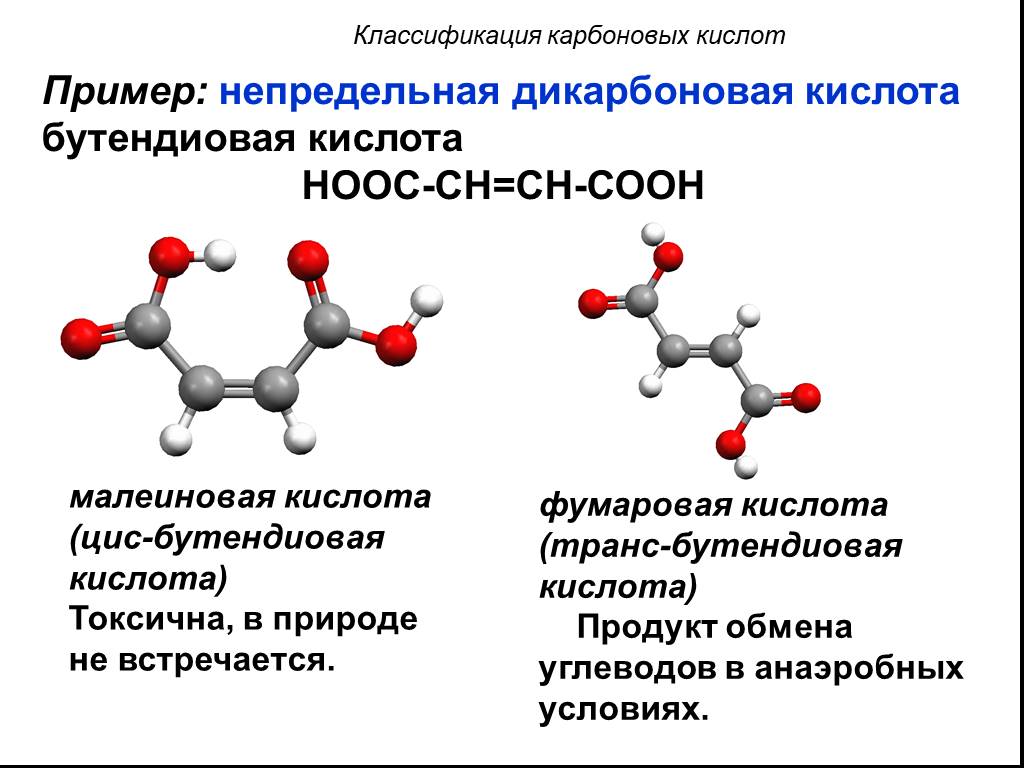
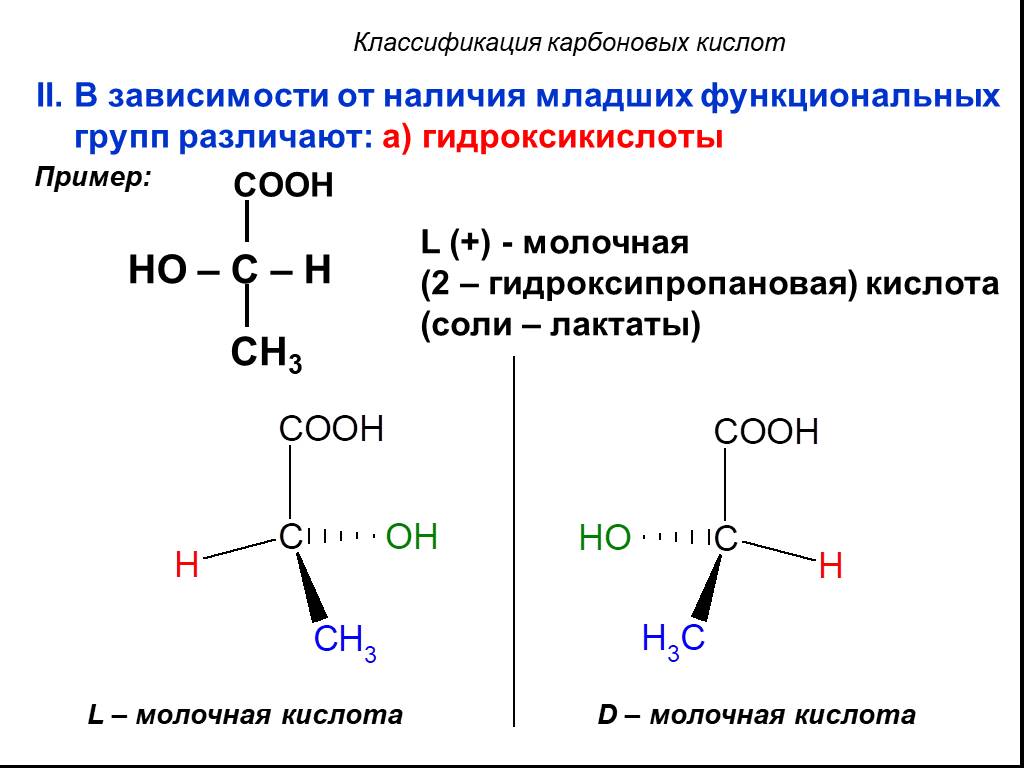
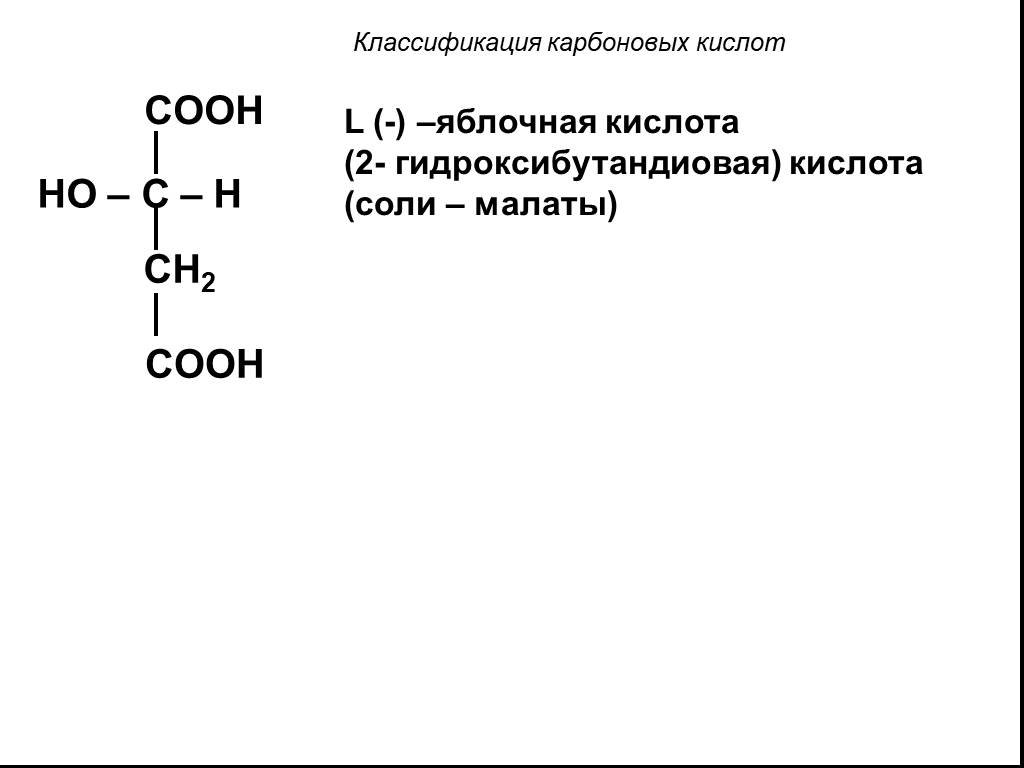
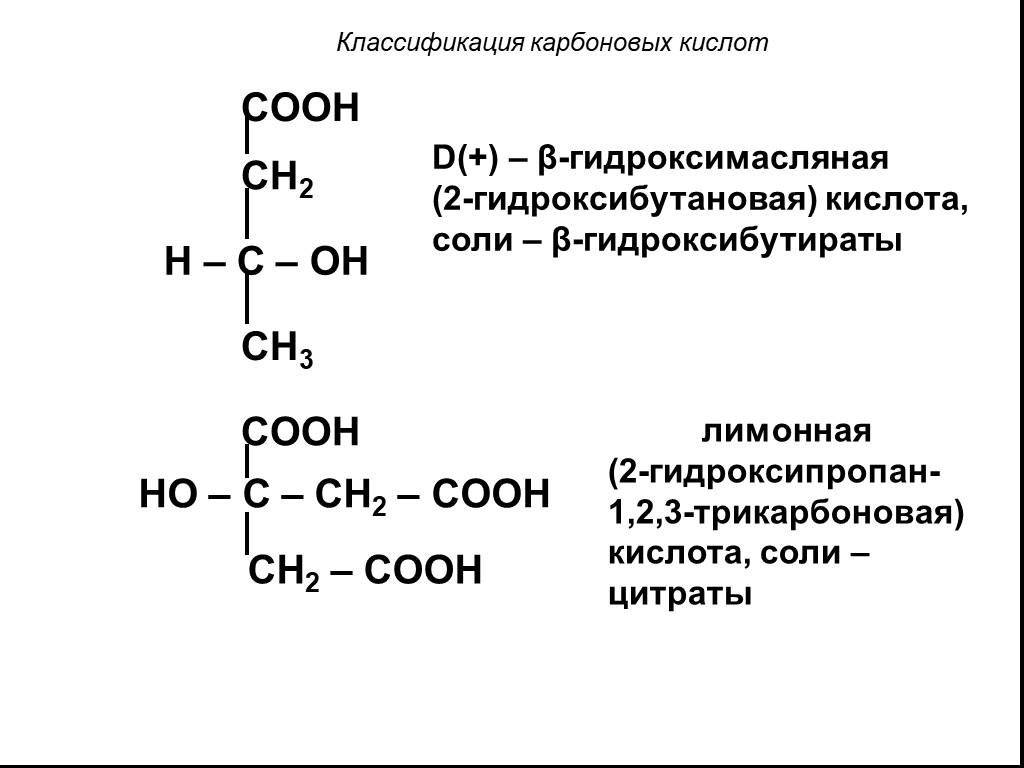
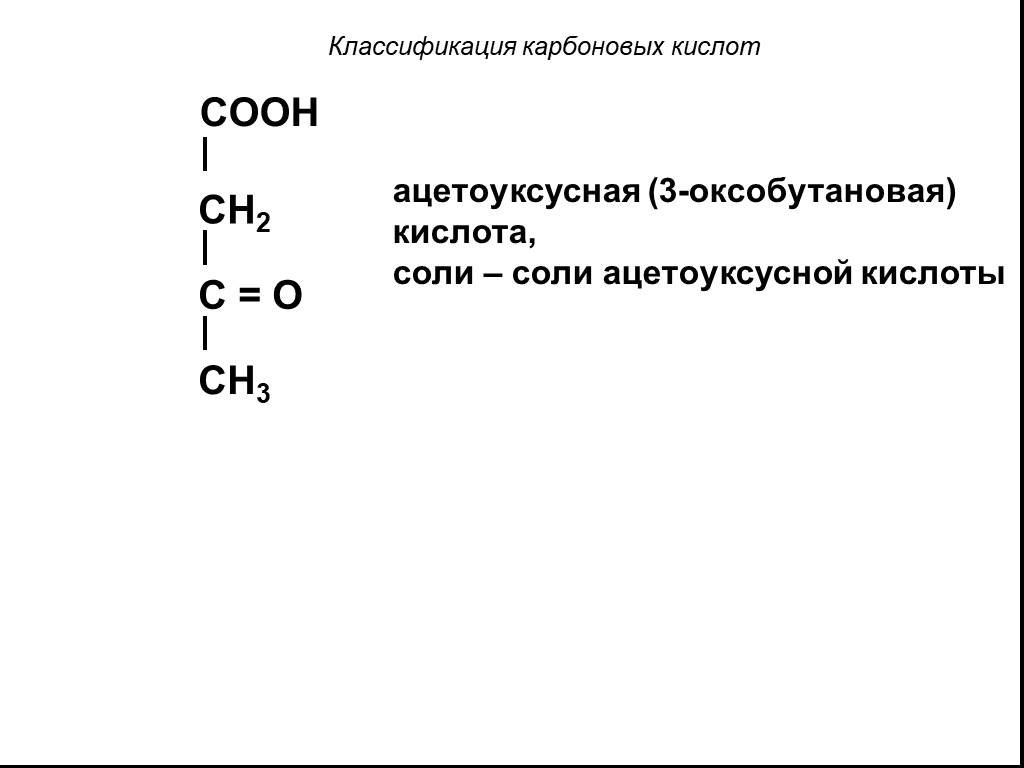
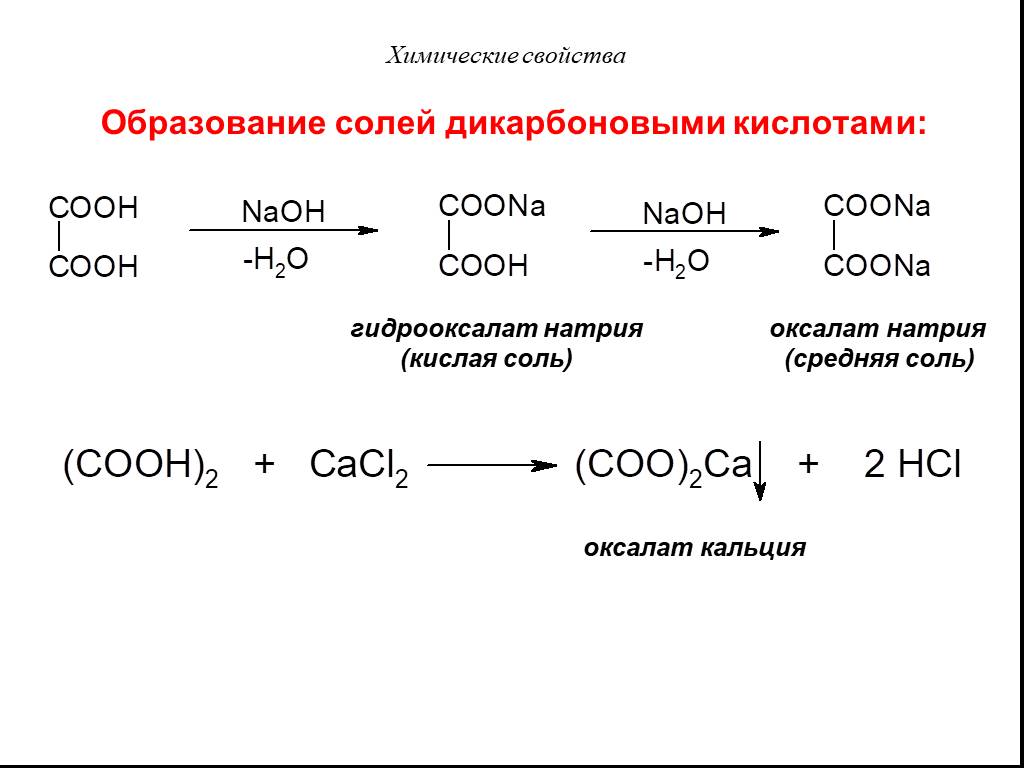
Классификация карбоновых кислот. По числу карбоксильных групп. непредельные ароматические одноосновные двухосновные многоосновные предельные. По типу ...Карбоновые кислоты
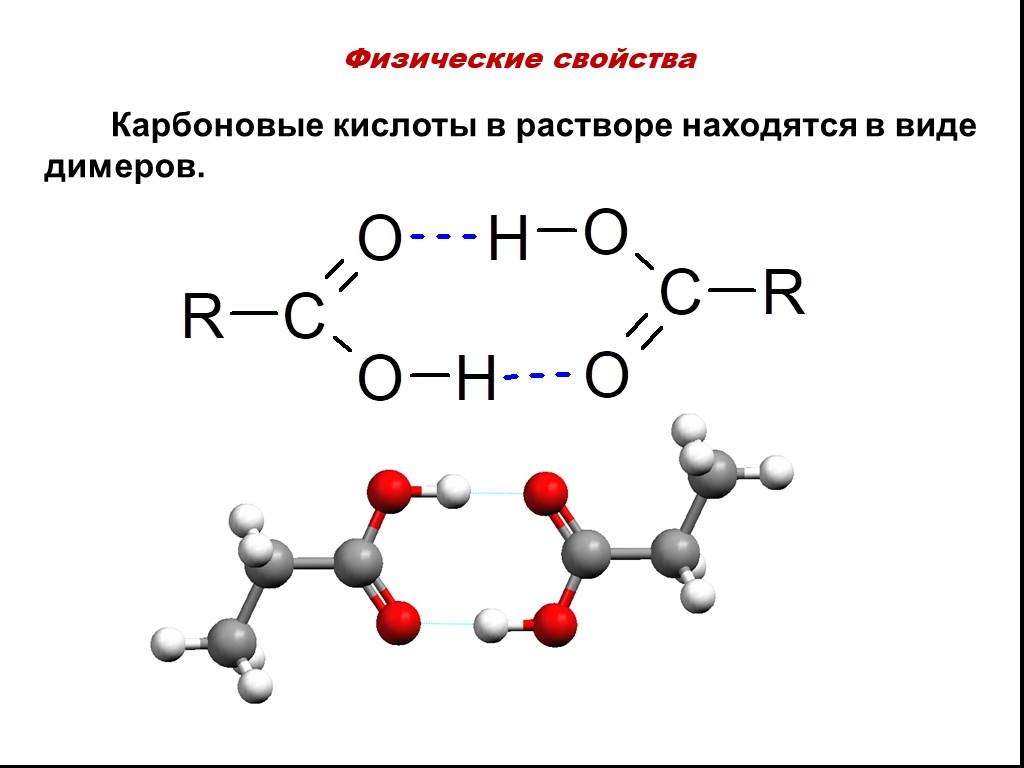
План изучения темы:. Определение. Классификация карбоновых кислот. Номенклатура . Изомерия. Физические свойства. 6. Химические свойства. 7. Получение. ...Карбоновые кислоты
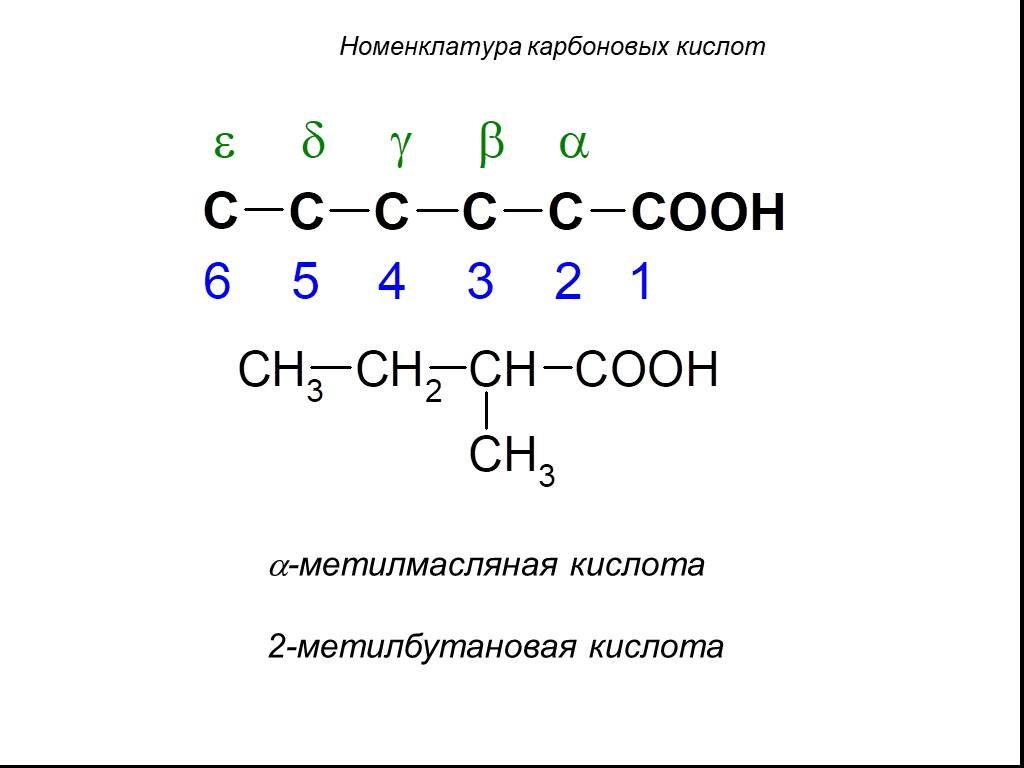
Цель урока. Дать понятие о карбоновых кислотах и их классификации. Рассмотреть основы международной и тривиальных номенклатур, применение карбоновых ...Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых ...Карбоновые кислоты
Тема урока: Карбоновые кислоты. Цели урока: рассмотреть строение молекул карбоновых кислот и карбоксильной группы; познакомиться с классификацией ...Карбоновые кислоты
Цель урока. Дать понятие о карбоновых кислотах и их классификации. Рассмотреть основы международной и тривиальных номенклатур, применение карбоновых ...Карбоновые кислоты-викторина
Цели: Воспитание позитивного отношения к химии. Развитие у учащихся творческого начала. Формирование умения работать в коллективе. Обучение применению ...Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
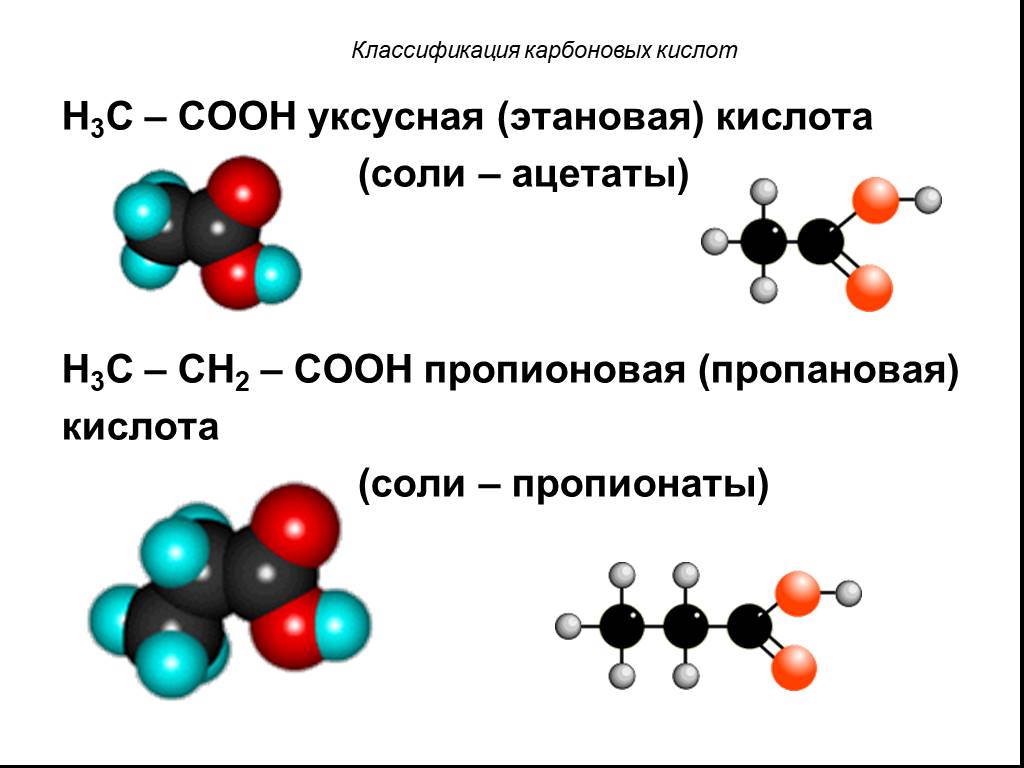
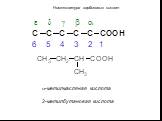
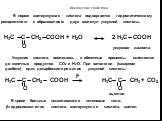
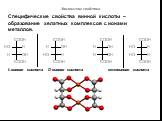
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Карбоновые кислоты и их производные
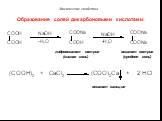
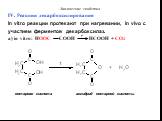
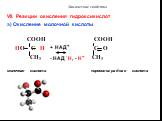
Функциональные производные карбоновых кислот. Образование сложных эфиров R'–COOR":. Реакция образования сложного эфира из кислоты и спирта называется ...Карбоновые кислоты и их строение
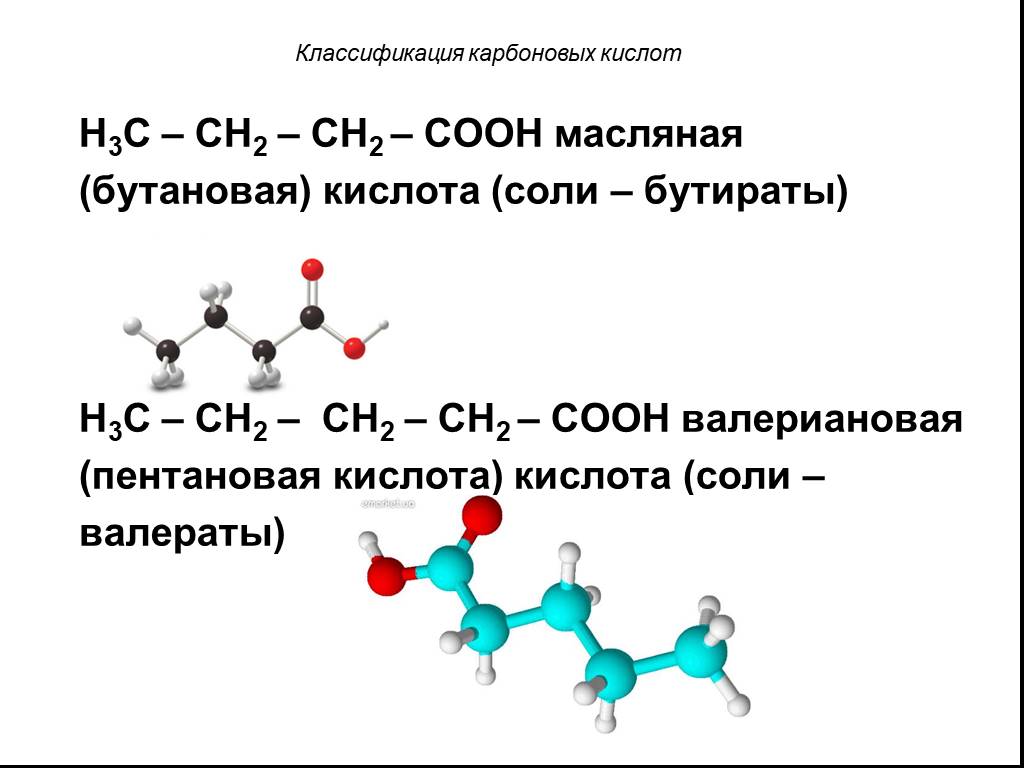
Назовите:. Н-СООН СН3-СООН СН3-СН2-СООН СН3-СН2-СН2-СООН СН3-СН2-СН2-СН2-СООН O R-C CnH2nO2 OH. Выберите изомеры и гомологи. а)СН3-СН-СООН б) СН3 ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Карбоновые кислоты 4
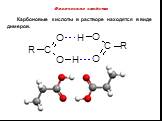
Строение. Карбоновые кислоты – это вещества, содержащие в молекуле одну или несколько карбоксильных групп. Карбоксильная группа – группа атомов Состав ...Карбоновые кислоты
Общая формула карбоновых кислот: 1) R – СНО 2) R – СООН 3) R – СН2 – ОН 4) R – СО – О – R΄. Карбоксильную группу содержат молекулы: 1) сложных эфиров ...Карбоновые кислоты
Лекция. 1.Определение кислот. 2.Гомологический ряд. Номенклатура. 3.Общий способ получения кислот. 4.Свойства карбоновых кислот. 5.Особенности муравьиной ...Предельные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Предельные одноосновные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Предельные одноосновные карбоновые кислоты
Назовите вещества. СН3-СН2-ОН. Соотнесите формулу вещества и его название. Формула 1) СН3-СН2-ОН 2) С3Н8 3) СН3-ОН 4). Название а) пропан б) метанол ...Органические кислоты
Выберите раздел Лимонная кислота. Муравьиная кислота. Ацетилсалициловая кислота. Молочная кислота Яблочная кислота. Высшие жирные кислоты. Уксусная ...Конспекты
Карбоновые кислоты
Проект конспекта урока. Педагог:. Корепанова Светлана Вячеславовна, учитель химии и биологии МБОУ Игринская СОШ № 2 Удмуртской Республики. Категория ...Карбоновые кислоты – союз двух групп
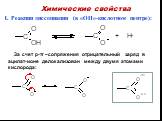
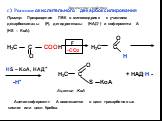
7. . «Карбоновые кислоты – союз двух групп». (урок – исследование. . химических свойств карбоновых кислот). Цели:. Образовательные:. сформировать ...Карбоновые кислоты
Тема №4, Урок №8 (1ч) Утверждаю_______________. « Карбоновые кислоты». Тип урока:. урок формирования новых знаний. Форма урока:. комбинированная. ...Карбоновые кислоты
Войстрик Т.И. учитель химии, биологии. Белагашская школа-сад. Жаксынского района. Акмолинской области. Урок химии в 9 классе. Тема: Карбоновые ...Карбоновые кислоты
«Карбоновые кислоты». Цель урока:. познакомить учащихся с новым классом кислородосодержащих соединений – карбоновыми кислотами. Задачи:. Обучающие. ...Карбоновые кислоты: состав, строение, номенклатура, изомерия, физические свойства
Урок химии в 10 классе. Тема: Карбоновые кислоты: состав, строение, номенклатура, изомерия, физические свойства. . . Тип урока:. урок ознакомления ...Карбоновые кислоты: строение, номенклатура, изомерия
Урок: Карбоновые кислоты: строение,. . номенклатура, изомерия. Цель:. познакомить учащихся с новым классом кислородосодержащих соединений – ...Карбоновые кислоты: классификация, номенклатура, изомерия
ПЛАН-КОНСПЕКТ УРОКА Тема урока:. . «Карбоновые кислоты: классификация, номенклатура, изомерия». 1. ФИО. . Шишкина Алла Владимировна. ...Спирты. Альдегиды. Карбоновые кислоты
Увеличение умственной нагрузки на уроках заставляет задуматься над тем, как поддержать интерес у учащихся к изучаемому материалу, их активность на ...Насыщенные одноосновные карбоновые кислоты
СПЕЦИАЛИЗИРОВАННАЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА I-III СТУПЕНЕЙ № 24 СИМФЕРОПОЛЬСКОГО ГОРОДСКОГО СОВЕТА РЕСПУБЛИКИ КРЫМ. ПЛАН - КОНСПЕКТ. урока в ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 января 2019
Категория:Химия
Содержит:54 слайд(ов)
Поделись с друзьями:
Скачать презентацию