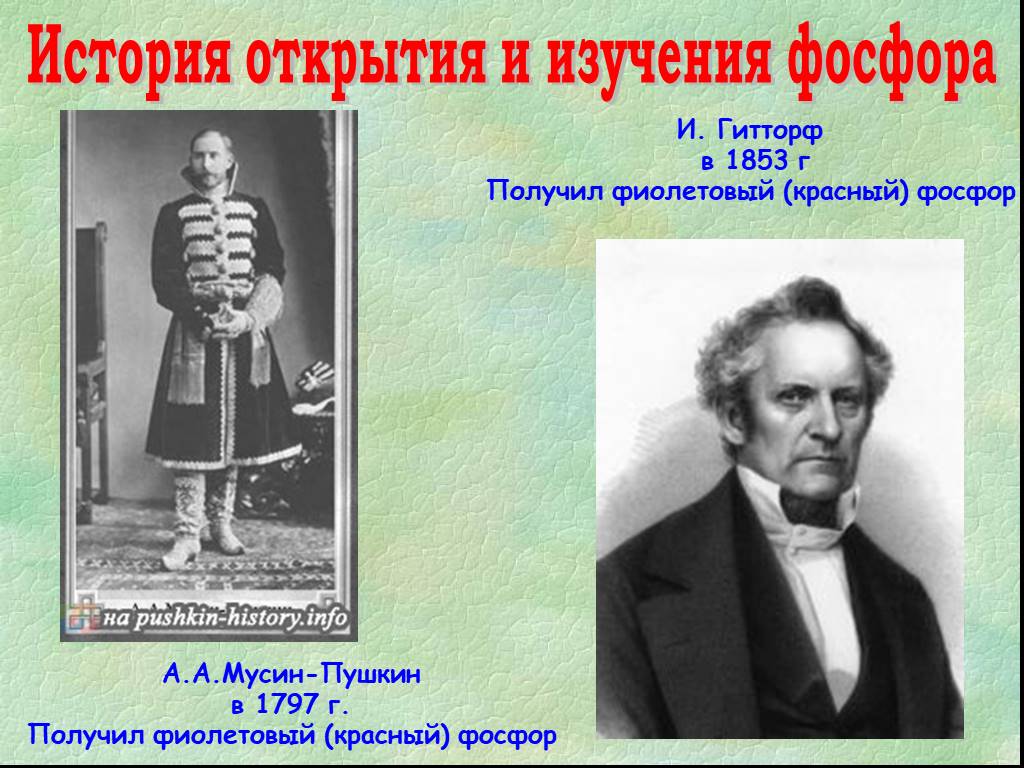
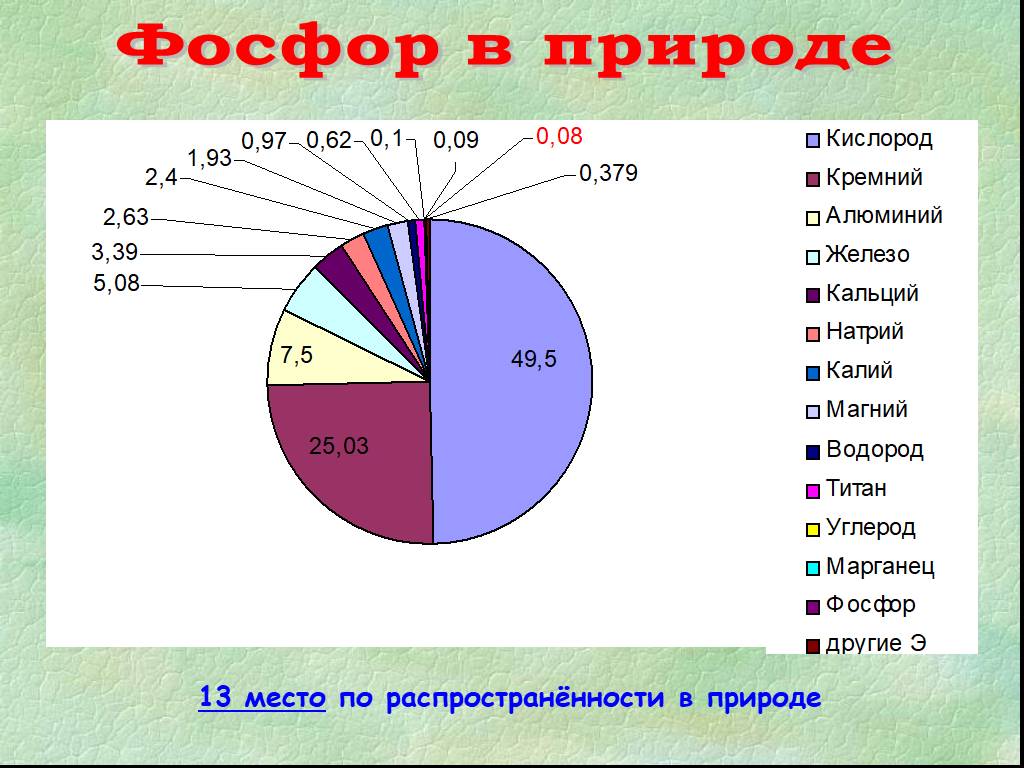
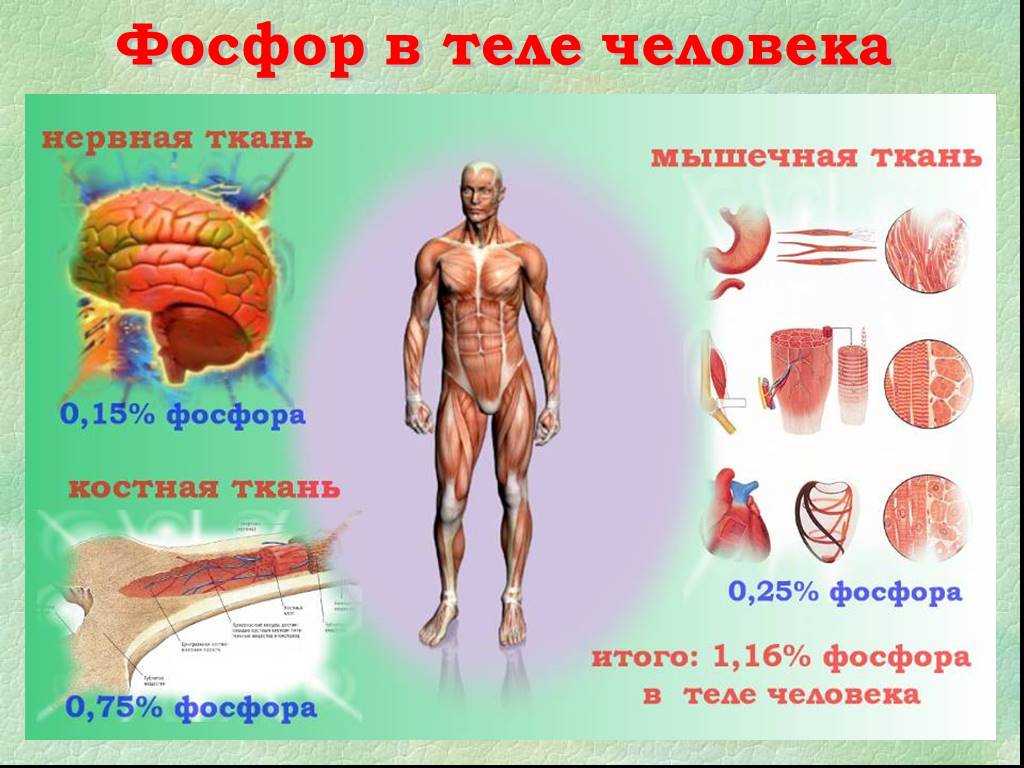
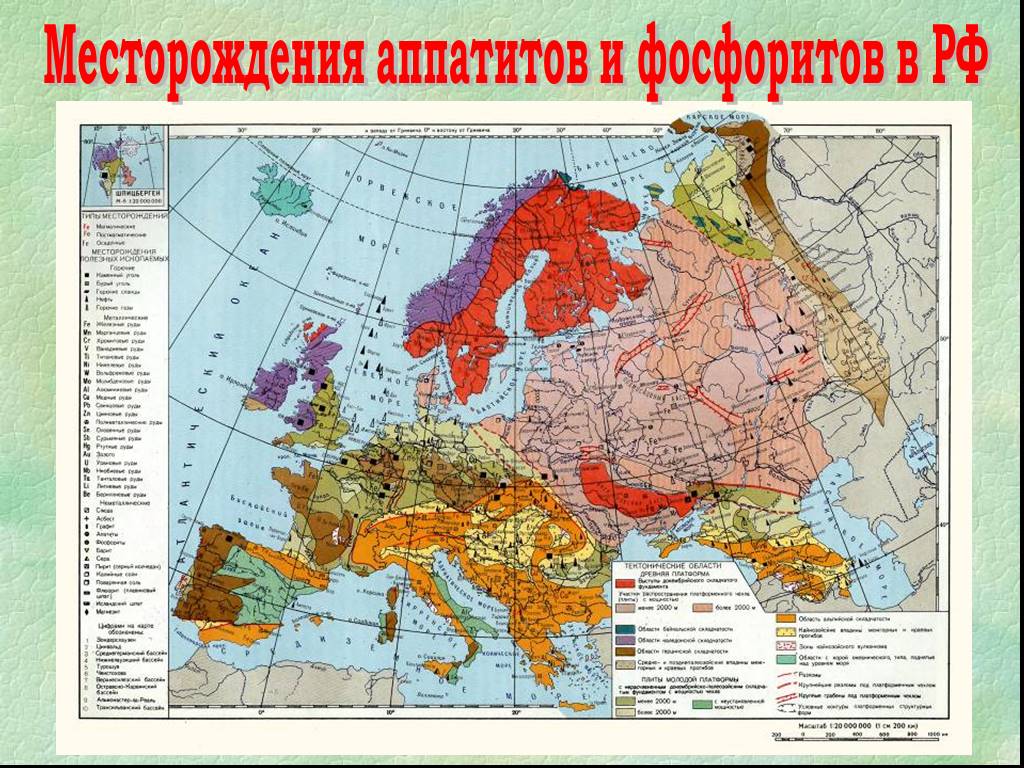
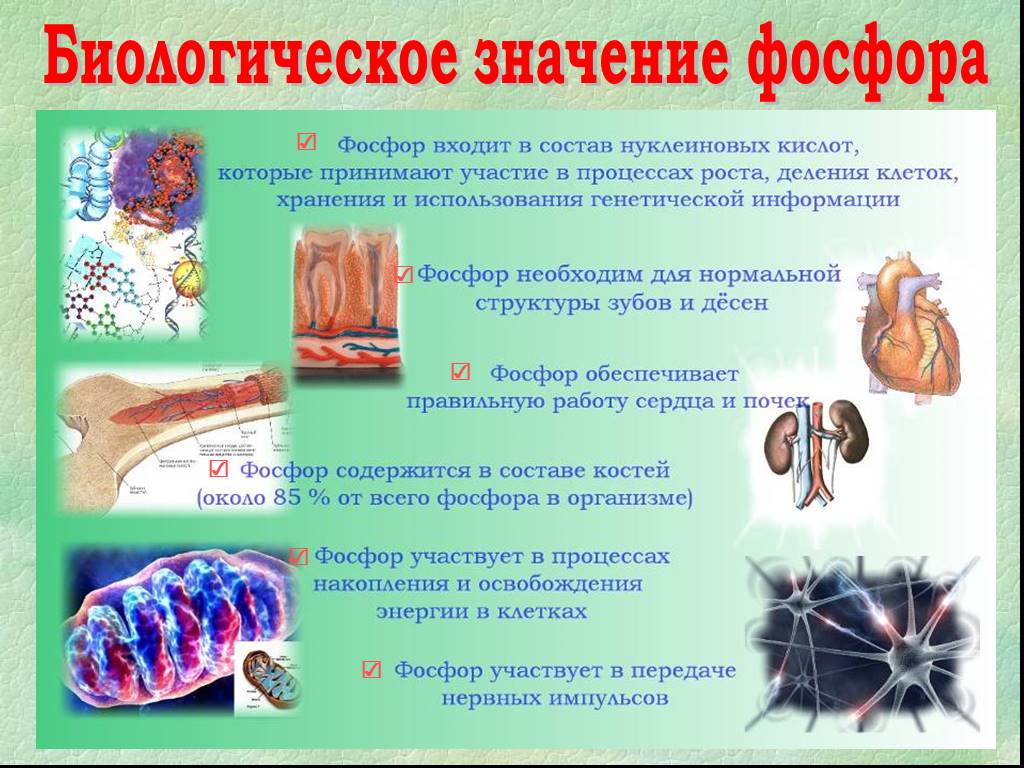
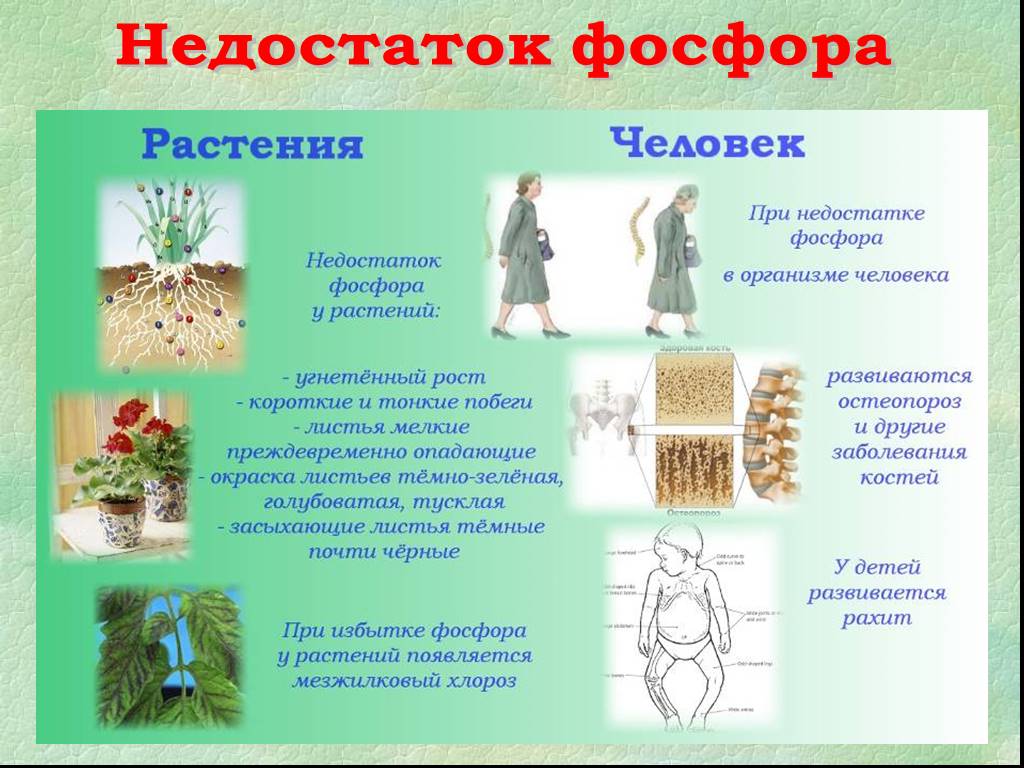
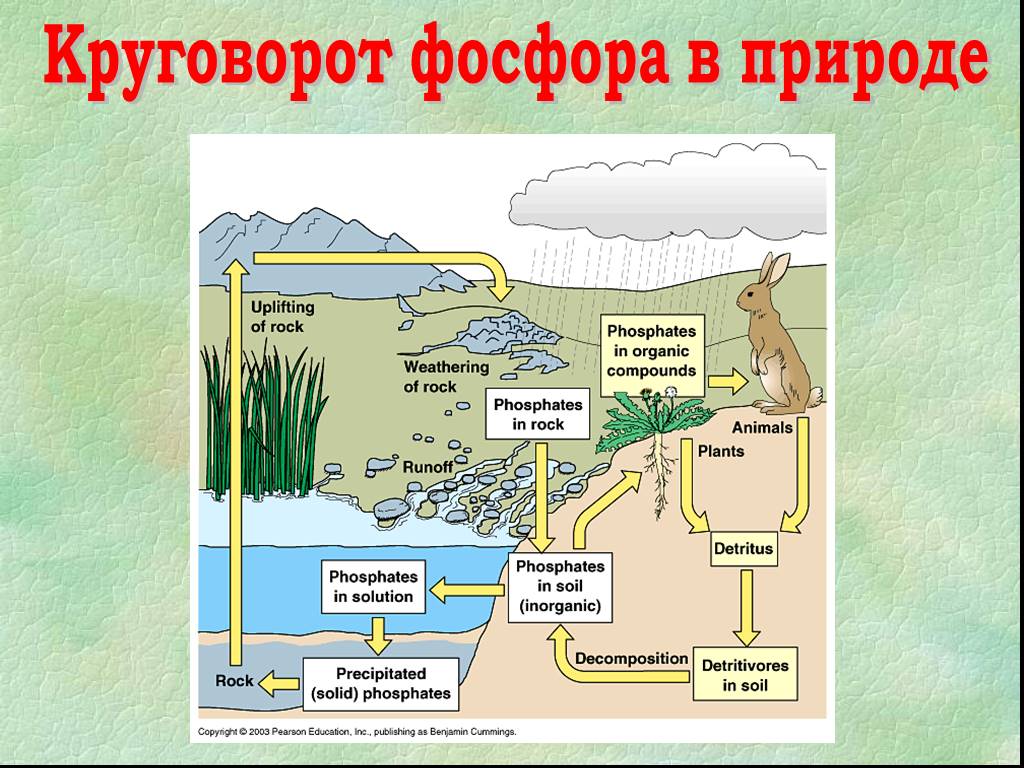
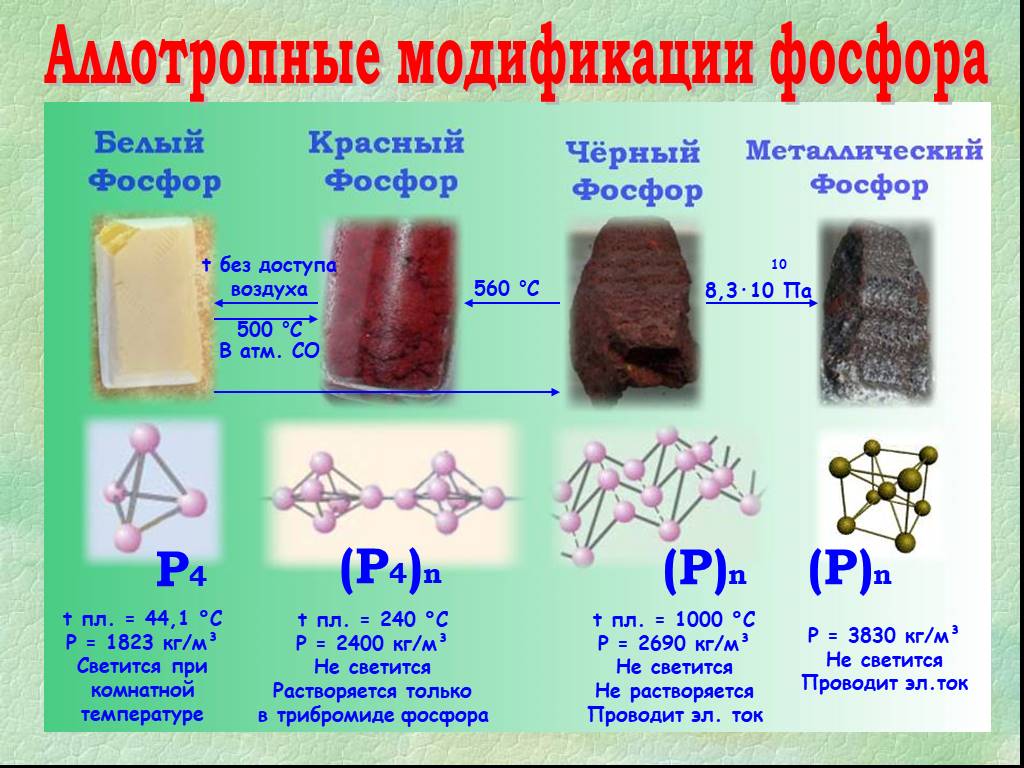
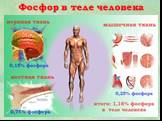
Презентация "Фосфор как простое вещество" по химии – проект, доклад
Презентацию на тему "Фосфор как простое вещество" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Алюминий как химический элемент и как простое вещество
AL. Элемент III(A) группы таблицы Д.И.Менделеева. Элемент с порядковым № 13. Элемент 3 -его периода. Третий по распространенности в земной коре. Впервые ...Сера как химический элемент и простое вещество
Основные вопросы. 1.Истрия открытия и изучения серы. 2. Распространение серы в природе. 3. Аллотропия и физические свойства серы. 4.Химические свойства ...Сера как элемент и как простое вещество
Работу выполнили: Учителя химии ГБОУ СОШ № 1465 им. Н.Г.Кузнецова Попова Светлана Анатольевна и Образовательного комплекса ГБОУ СОШ № 880 Гершановская ...Кислород как химический элемент и простое вещество
Тема урока. «Кислород как химический элемент и простое вещество». «Dum spiro spero»…… Пока дышу, надеюсь…. Кислород – это вещество, вокруг которого ...Углерод – химический элемент и простое вещество
Цели урока:. Познакомить учащихся с распространением химического элемента углерода в природе Вспомнить электронное строение атома углерода Закрепить ...Вода как вещество
Содержание. Состав и строение молекулы. Методы определения состава веществ. Вода в природе. Методы очистки воды. Физические свойства. Химические свойства. ...Фосфор
«Элемент жизни и мысли» (А.Е. Ферсман). Фосфор. Цели урока: А. Образовательные Способствовать формированию умения учащихся давать сравнительную характеристику ...Фосфор
Проэкт Фосфор. Выполнили ученики 10 класса Бурдюк ,Власенко ,Черненко. Фосфор (P) – довольно распространённый химический элемент на нашей планете, ...Фосфор
Аннотация. Тематика презентации рассчитана на учащихся 9х классов Навыки и знания компьютера не требует от учащихся Созданная презентация позволяет ...Фосфор
Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов. Фосфор занимает 12-е место по распространенности ...Фосфор
Білий,складається з молекул P4 , які мають форму тетраєдра . В утворенні молекули приймають участь р-орбіталі, вони утворюють тільки б-зв’я зки. При ...Вода - самое удивительное вещество на Земле
Вода – самое распространенное и самое удивительное вещество на Земле. Вода окружает нас повсюду: в водоемах, на земле и даже в воздухе – в виде снега, ...Белки как основа всего живого
Жизнь – это переплетение сложнейших химических процессов взаимодействия белков между собой и другими веществами. Ф. Энгельс. Продукты, содержащие ...Исследование свойств маннозы как природного иммунностимулятора
Актуальность темы. Создание отечественных натуральных веществ с выраженными иммуностимулирующими и иммуномодулирующими свойствами является актуальной ...Ионная связь как химическая связь
ХИМИЧЕСКАЯ СВЯЗЬ -. сила, связывающая атомы в молекулы или другие частицы. - совокупность электростатических сил притяжения, связывающих атомы друг ...Изучение характеристик мороженого как продукта питания
Изучить химический состав и энергетическую ценность наиболее предпочитаемых сортов мороженого. Цель научной работы. изучить информационную базу по ...Гипертекст как средство развития познавательной активности учащихся на уроках химии
Анонимное тестирование учащихся 8-11 классов. Выполняете ли вы домашнее задание? Читаете ли вы параграф, заданный на дом? Вы пользуетесь компьютером ...Вода Самое удивительное вещество
Вода в природе. Советский учёный В. И. Вернадский писал: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться ...Вода как растворитель
Проверка домашнего задания. Решение задач. 1. Если в чайник или кастрюлю налить воду до краев и начать нагревать, то через некоторое время вода начнет ...Фосфор
Определение фосфора Теория открытия Виды фосфора. Фосфор — один из самых распространённых элементов земной коры, его содержание составляет 0,1 % её ...Конспекты
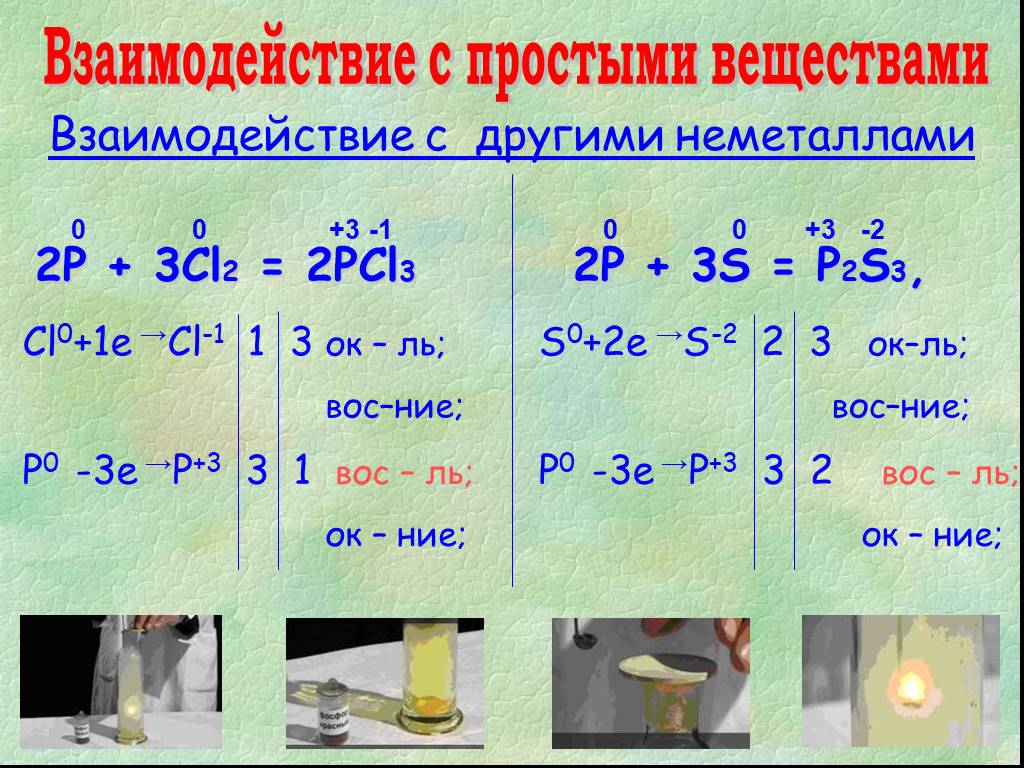
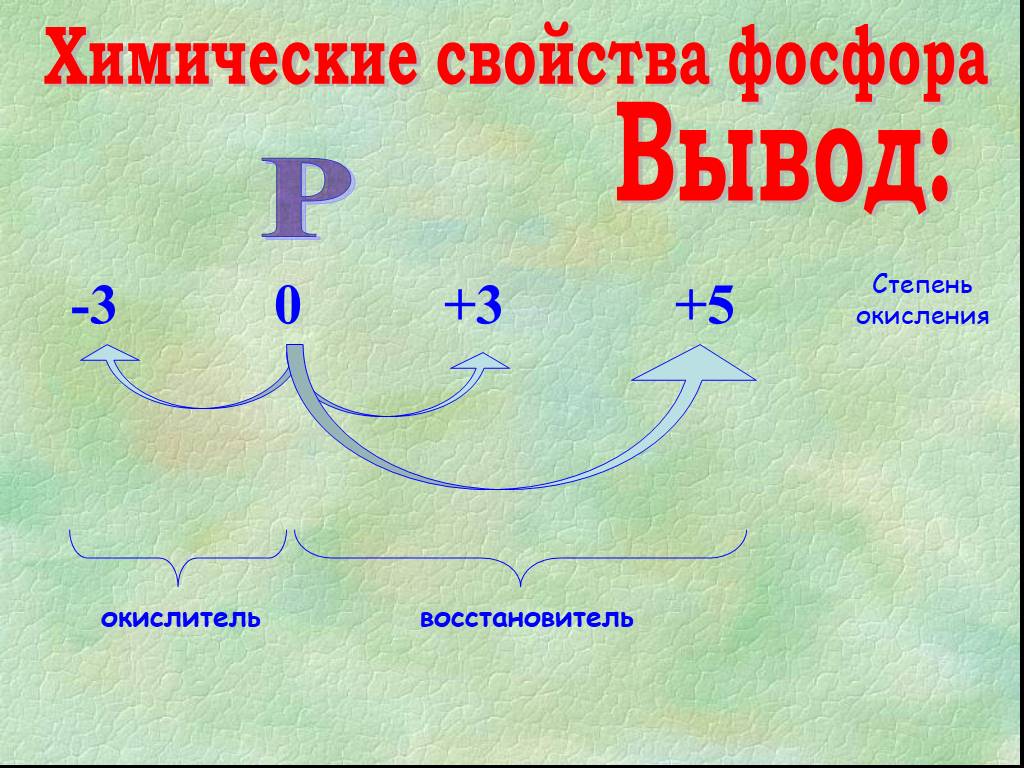
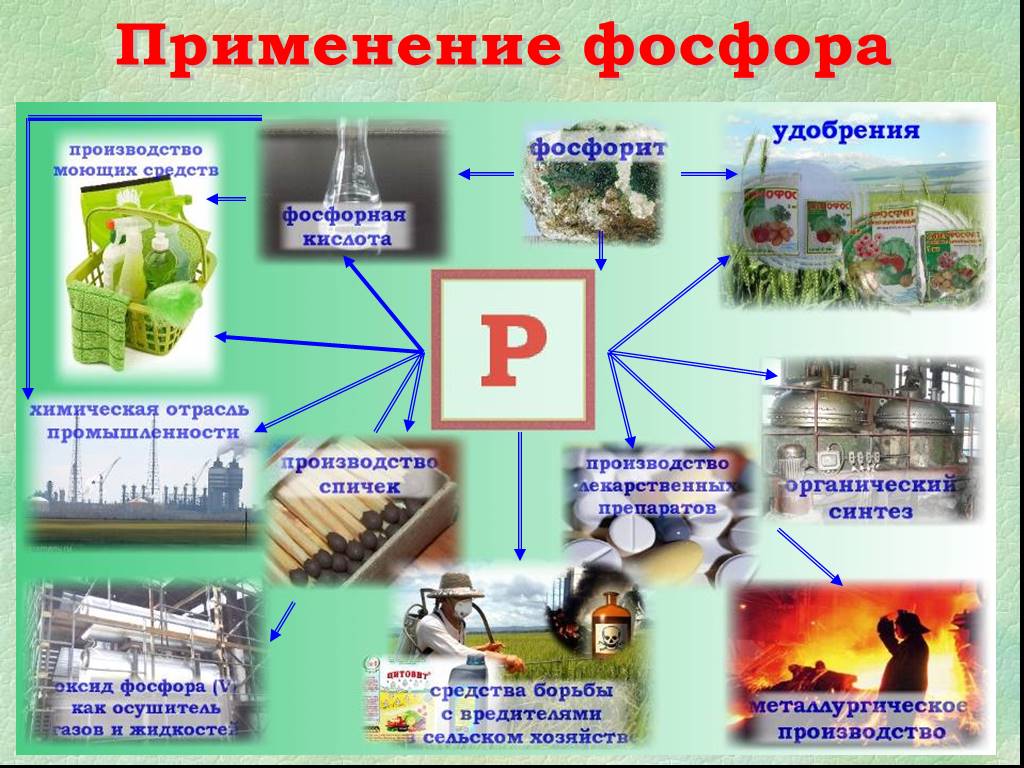
Фосфор – химический элемент и простое вещество
ПЛАН-КОНСПЕКТ УРОКА. 1. «Фосфор – химический элемент и простое вещество». (Тема урока). ФИО: Артемьева Елена Юрьевна. . Место работы: МОУ ...Фосфор как химический элемент и вещество
Муниципальное бюджетное общеобразовательное учреждение. «Новотимошкинская основная общеобразовательная школа». Аксубаевского муниципального района ...Подгруппа углерода. Углерод как простое вещество
Тема: «Подгруппа углерода. Углерод как простое вещество». Цель урока. :. Дать общую характеристику элементам. VI. А группы, показать аллотропные ...Алюминий: химический элемент и простое вещество
Урок химии в 9 классе по теме: "Алюминий: химический элемент и простое вещество". . Урок № 14 в теме “Металлы”, по учебнику О.С. Габриеляна “Химия, ...Cера – простое вещество
Конспект урока. Кобелева Вера Ивановна. Муниципальное образовательное Учреждение. Красноармейская Основная Общеобразовательная Школа. Город ...Кислород химический элемент и простое вещество
«Утверждено. » «Рассмотрено». Директор школы: ________________ Зам УВР: ________________. Урок №. 34. дата. ____________. Краткосрочное планирование ...Сера – простое вещество
Тема «Сера – простое вещество». Цель урока. : определить положение серы в периодической системе химических элементов Д.И. Менделеева, рассмотреть ...Кислород — химический элемент и простое вещество. Получение кислорода
Муниципальное общеобразовательное автономное учреждение. . «СОШ № 10». Урок по теме "Кислород — химический элемент и простое ...Водород – химический элемент и простое вещество
Тема урока «Водород – химический элемент и простое вещество». Тип урока: урок обобщения и систематизации знаний по теме «Водород». Форма урока: ...Железо: химический элемент и простое вещество
Муниципальное бюджетное образовательное учреждение. «Средняя общеобразовательная школа №3». Конспект урока по химии:. “Железо: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию