Конспект урока «Кислород — химический элемент и простое вещество. Получение кислорода» по химии
Муниципальное общеобразовательное автономное учреждение
«СОШ № 10»
Урок по теме "Кислород — химический элемент и простое вещество. Получение кислорода"
Горькова Екатерина Валерьевна,
учитель химии
г. Оренбург
Урок по теме "Кислород — химический элемент и простое вещество. Получение кислорода"
Цель:
Систематизация и расширение знаний учащихся о химическом элементе кислороде и простых веществах — кислороде и озоне, их нахождение в природе; усвоение понятий “аллотропия” и “аллотропные модификации”; знакомство с историей открытия простого вещества — кислород и способы его лабораторного получения и собирания; формирование представлений о катализаторах.
Задачи урока:
Обучающие: обеспечить усвоение учащимися теорий, законов, понятий, фактов, признаков, особенностей и т.д.; повторить, систематизировать, обобщить знания; сформировать умения, навыки; устранить пробелы в знаниях.
Воспитательные: формирование у учащихся таких черт характера, как трудолюбие, гуманность, дисциплинированность, ответственность, аккуратность, положительное отношение к учёбе.
Развивающие: развитие у учащихся умения анализировать, сравнивать, обобщать учебный материал; развитие познавательных умений - слушать, выделять главное, составлять план, тезисы, конспекты, делать опыты, наблюдать, ставить проблемы и решать их, выдвигать гипотезы и т.д.
Основные вопросы.
-
Характеристика элемента кислорода.
-
Кислород - простое вещество.
-
История открытия кислорода.
-
Способы получения и собирания кислорода. Понятие о катализаторах.
Основные понятия:
химический элемент кислород, аллотропия, аллотропные модификации, простые вещества — кислород и озон; катализаторы.
УУД:
Личностные УУД:
-
мысленное воспроизведение картины, ситуации;
Регулятивные УУД:
-
Поиск информации в предложенных источниках;
Коммуникативные УУД:
-
Групповая работа;
-
«отгадай, о чем говорим»;
Познавательные УУД:
-
Составление схем-опор;
-
Работа с разного вида таблицами.
Планируемые результаты.
Предметные: Формирование системы знаний о химическом элементе кислороде, его распространенности и роли в природе.
Усвоение понятий “аллотропия”, “аллотропные модификации” при сравнении состава, строения, свойств, изучение роли в природе и жизни человека кислорода и озона.
Личностные: Развитие научного мышления учащихся при формировании умений находить причинно-следственные связи, сравнивать химические объекты и давать им сравнительную характеристику.
Развитие научного мировоззрения учащихся при усвоении основных идей курса: единство и познаваемость мира; единство живой и неживой природы; зависимость свойств вещества от особенностей их состава и строения; зависимость способов получения вещества от его свойств.
Метапредметные: Развитие у школьников интереса к изучению химии путем расширения и систематизации их знаний о кислороде и озоне.
Развитие у школьников интереса к изучению химии через лабораторный эксперимент.
Приемы обучения:
-
постановка межпредметных вопросов; выполнение комплексного задания на сравнение состава, строения, свойств и роли кислорода и озона в природе; составление обобщающих таблиц; обращение к историческому материалу.
Средства обучения:
-
Мультимедиапроектор, схемы, таблицы, учебник, дополнительная литература, химический эксперимент, лабораторное оборудование.
Оборудование и реактивы:
-
компьютер, интерактивная доска, мультимедиа проектор, виртуальная лаборатория, пробирки, штатив, лучинки, колбы, Н2О2 — пероксид водорода, MnO2 — оксид марганца (IV).
Ход урока
-
Орг. момент – 2-3 мин.
-
Актуализация знаний – 7 мин.
Учитель: Наш урок посвящен химическому элементу и веществу им образованному, который занимает особое место в жизни всего живого.
П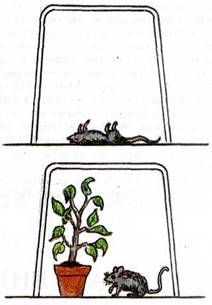 роанализируйте рисунки и скажите: Что случилось с мышкой на рисунке 1? Подумайте чем это можно объяснить?
роанализируйте рисунки и скажите: Что случилось с мышкой на рисунке 1? Подумайте чем это можно объяснить?
Ученики: кислород
Учитель: Что вы знаете о кислороде? Что бы вы хотели узнать?
(фронтальная работа) На доске составляем примерный план урока по ответам детей.
| Что хочу узнать | Что узнал? | |
| | | |
| | | |
План урока.
-
История открытия (кем, когда были открыты).
-
Общая характеристика химического элемента кислорода на основе его положения в Периодической системе Д. И. Менделеева.
-
Нахождение в природе: содержание в земной коре, содержание в атмосфере, в живой и не живой природе.
-
Способы получения (в лаборатории и промышленности). Катализаторы. Каталитические реакции.
Давайте перенесемся в средние века (выступление ученика по теме: «История открытия кислорода» интеллект-карта).
Учитель: Назовите точный адрес проживания кислорода в ПСХЭ и охарактеризуйте его как химический элемент.
План характеристика химического элемента:
-
Символ — О
-
Положение в ПСХЭМ — VI группа (А), II период, Порядковый номер — 8.
-
Химическая природа — неметалл.
-
Относительная атомная масса — Ar (O) = 16
-
Валентность — II.
-
Изучение нового материала – 15 мин.
Учитель: прослушав стихотворение, заполните кластер ( слайд ).
Он без запаха и цвета
С углеродом даст он дым,
Им окутана планета
Без него не быть живым,
Для дыхания он нужен,
В нем сгорают вещества
В океане он и в луже
Там, где зелень и листва.
-
Проанализируйте стихотворение и определите физические свойства.
Как вы думаете, в каком виде кислород содержится в природе? Какие образует вещества? А есть ли еще, какие либо простые вещества, состоящие из кислорода? Что защищает планету от УФ излучения? Ответы учащихся могут быть разными.
Учитель: Перед вами на столе лежит таблица. Для того, чтобы ее заполнить, немного обсудим эти вопросы.
| кислород | озон | |
| Какова химическая формула простого вещества? | | |
| Какова относительная молекулярная масса? | | |
| Агрегатное состояние при н.у. | | |
| Цвет | | |
| Запах | | |
| Растворимость в воде | | |
| Отличительные свойства | | |
| Действие на организм | | |
Ученики читают текст и заполняют таблицу: Кислород — газ, без цвета, вкуса, запаха, малорастворим в воде, тяжелее воздуха, при t = - 1870С превращается в жидкость бледно-синего цвета, а при t = -218, 80 С в синие кристаллы.
Озон — газ, голубого цвета, имеет запах свежести, в воде лучше растворим, чем кислород, тяжелее воздуха, при t = -1120С превращается в жидкость темно-синего цвета.
Учитель: Содержится ли кислород и озон в воздухе? Как эти газы там образуются?
Ученик: Кислород содержится в воздухе (21% по объему) образуется в результате фотосинтеза. Озон также содержится в атмосфере, примерно на расстоянии 10-30 км от поверхности Земли образуется в результате грозовых разрядов.
Учитель: Итак, мы подошли к очень важному понятию “аллотропия” и “аллотропные модификации”. Химический элемент кислород образует 2 простых вещества — кислород и озон, которые отличаются друг от друга составом, строением, свойствами. Такое явление называется “аллотропия”, а вещества, образованные одним и тем же химическим элементом, - “аллотропными модификациями” или видоизменениями. Запишем это в тетрадь.
Примечание: учащиеся переписывают в тетрадь определения.
Учитель: Явление существования различных простых веществ, образованных атомами одного и того же химического элемента и называется аллотропией, а простые вещества — аллотропными модификациями. Таким образом, О2 и О3, т.е кислород и озон — это аллотропные модификации химического элемента кислорода. Переходим к следующему этапу урока.
Физминутка – 2 мин.
-
Групповая работа
Учитель: Как же был получен кислород? (групповая работа)
Учитель: Ребята предлагается работа в 5 группах (дифференцированно).
1-3 группы: задание - изучить по раздаточному материалу «методы получения кислорода» и объяснить этот метод, используя виртуальную лабораторию.
4-5 группы: задание - предложите, опираясь на физические свойства кислорода способы собирания этого газа.
-
Обобщение и систематизация знаний – 10 мин.
Работа в группах. Каждая группа получает карточку с заданием. На данную работу группам отводится 5 мин., затем учащиеся отвечают.
С о д е р ж а н и е к а р т о ч е к д л я г р у п п
Учитель делает вывод о результатах деятельности групп:
Учитель: Кислород можно получить и разложением других кислородсодержащих веществ в присутствии катализаторов.
Катализаторы – это вещества, которые ускоряют ход химической реакции, но сами при этом не расходуются.
Реакции, протекающие с участием катализаторов, называются каталитическими реакциями. Например, разложение бертолетовой соли (хлората калия).
Примечание: Ученики записывают определение понятий в тетради.
Учитель: Итак, подведем итоги урока. Вернемся к нашей табличке и заполним третью колонку.
| Что хочу узнать | Что узнал? | |
| | | |
| | | |
Контроль знаний тест-3мин
Взаимопроверка.-2 мин
Проверка знаний учащихся, подведение итогов занятия.
Проверка знаний учащихся проводится в форме х и м и ч е с к о г о д и к т а н т а: если утверждение соответствует кислороду, ставят знак «+», если не соответствует – знак «–».
1) Хорошо растворяется в воде.
2) Плохо растворяется в воде.
3) Легче воздуха.
4) Тяжелее воздуха.
5) Горючий газ.
6) Газ, поддерживает горение.
7) Восстановитель.
8) Окислитель.
9) При смешении с О2 взрывается при обычных условиях.
10) Горит спокойно.
11) Взаимодействует с оксидом меди(II).
12) Собирают методом вытеснения воздуха.
13) Собирают в опрокинутый вверх дном сосуд.
14) Собирают методом вытеснения воды.
15) Собирают в прямостоящий сосуд.
16) Получают перегонкой жидкого воздуха.
17) Получают электролизом воды.
О т в е т ы д л я с а м о п р о в е р к и
| 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | |
| – | + | – | + | – | + | – | + | – | – | – | + | – | + | + | + | + |
Домашнее задание: используя кейс выполните задания:
Текст:
Кислород самый распространенный элемент на Земле. Он входит в состав всех окружающих нас веществ. Так, например вода, песок, многие горные породы и минералы, составляющие зеленую кору, содержат кислород. Кислород является важной частью многих органических соединений, например белков, жиров и углеводов, имеющих исключительно большое значение в жизни человека.
В 1772 году шведский химик Шееле установил, что воздух состоит из кислорода и азота, В 1774 году английский химик Д. Пристли, разложением оксида ртути получил кислород и изучил его свойства. В 1777 году француз А. Лавуазье объяснил процессы дыхания и горения, как взаимодействие веществ с окислителем кислородом. Название элемента – оксигениум (рождающий кислоты) – дал Лавуазье. [5]
Кислород – бесцветный газ, без вкуса, запаха, малорастворим в воде, тяжелее воздуха.
Кислород энергично реагирует со многими веществами, при этом выделяется теплота и свет. Такие реакции называются горением. Для того, чтобы горение началось необходимы два условия: 1) нагревание горючего вещества до температуры воспламенения; 2) доступ кислорода. Для прекращения горения необходимо исключить хотя бы одно из условий.
Применение кислорода основано на его химических свойствах. В больших количествах кислород используют в разных отраслях химической промышленности, в металлургии, в ракетных двигателях, в медицине и т. д.
Пополняют запас кислорода в атмосфере зеленые растения.
Кислород в природе
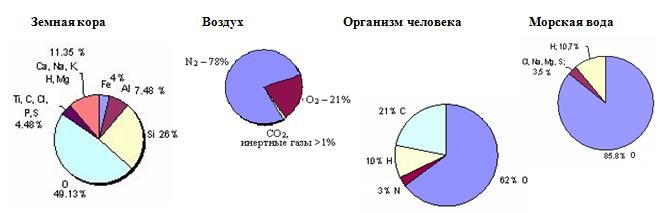
Задача №1
Впервые состав воздуха был установлен французским ученым Лавуазье. Он нагрел ртуть в определенном объеме воздуха. Объем воздуха сократился, а ртуть покрылась налетом оранжевого света, оставшийся газ не поддерживал ни горения, ни дыхания. Тогда Лавуазье собрал с поверхности ртути оранжевые чешуйки, поместил их в пробирку, сильно нагрел и собрал выделившийся газ. Смешав собранный газ с остатками газа из первого опыта, он получил смесь газов, ничем не отличающуюся от воздуха. Разъясните опыт Лавуазье. Приведите уравнение тех реакций, которые он воспользовался для определения состава воздуха.
Задача №2
«Доктор Окс… не пользовался марганцовокислым натрием по методу Тессье дю Мотэ, а попросту разлагал слегка подкисленную воду с помощью изобретенной им батареи… Электрический ток проходил сквозь большие чаны, наполненные водой, которая разлагалась на составные элементы, кислород и водород». Запишите уравнение реакций получения кислорода, о которых упоминается в отрывке повести Ж. Верна «Опыт доктора Окса». [2]
Задача №3
Используя диаграмму, определите массу кислорода в своем организме.
Список литературы:
-
Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для учащихся 8 класса общеобразовательных учреждений — 2-е издание, перераб. — М.: Вентана — Граф, 2001.
-
Люкимсон П.Е. Исползование художественной литературы на уроках химии //Химия в школе. — 1992 - № 3 — 4.
-
Методика преподавания химии/ Под редакцией Н.Е. Кузнецовой — М.: Просвещение, 1984.
-
Тихомирова С.А., Долгих А.Ф. Использование художественной литературы на уроках при изучении неорганической химии // Химия в школе — 1991 - № 2.
-
Ходаков Ю.В. Неорганическая химия: пособие для учителя — М.: Просвещение, 1972.
-
Шаталов Н.Е., Шаталов М. А. Межпредметные связи в формировании системных знаний // Химия в школе — 1997 - № 5
-
Кузнецова Н.Е., Шаталов М. А. Обучение химии на основе межпредметной интеграции. Учебно — методическое пособие 8 — 9 классы. - М.: Вентана — Граф, 2004.
-
Шаталов М.А. Уроки химии. Методическое пособие 8 класс. - М.: Вентана — Граф, 2006.
Здесь представлен конспект к уроку на тему «Кислород — химический элемент и простое вещество. Получение кислорода», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

