Презентация "Фосфор" (9 класс) по химии – проект, доклад
Презентацию на тему "Фосфор" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 10 слайд(ов).
Слайды презентации
Список похожих презентаций
Фосфор и его соединения
Цель: исследовать влияние фосфора на рост и развитие растений. Задачи исследования: 1. Изучить влияние фосфора на рост и развитие растений; 2. Рассмотреть ...Фосфор и его соединения
Строение атома. Символ элемента: P. Атомный номер: 15. Положение в таблице: 3-й период, группа - VA (2) Относительная атомная масса: 30.973761 Степени ...Фосфор «Светоносный»
Соединения азота:. Li3N нитриды NH3 аммиак. N - 3 +1 +3 +4 +5 © Осиевская И.А. Образует 2 аллотропные модификации:. Химические свойства:. 1. Р + Н2 ...Фосфор и его соединения
«Чудовище лежало перед нами… Его огромная пасть все еще светилась голубоватым пламенем, глубоко сидящие дикие глаза обведены огненными кругами. Я ...Фосфор
«Элемент жизни и мысли» (А.Е. Ферсман). Фосфор. Цели урока: А. Образовательные Способствовать формированию умения учащихся давать сравнительную характеристику ...Фосфор
История открытия фосфора.1669 год. Купец, чьи дела шли плохо, решил попытать счастья в алхимии, чтобы выбраться из низеты: Хенниг Бранд провел уже ...Фосфор
Проэкт Фосфор. Выполнили ученики 10 класса Бурдюк ,Власенко ,Черненко. Фосфор (P) – довольно распространённый химический элемент на нашей планете, ...Фосфор
Білий,складається з молекул P4 , які мають форму тетраєдра . В утворенні молекули приймають участь р-орбіталі, вони утворюють тільки б-зв’я зки. При ...Фосфор
Аннотация. Тематика презентации рассчитана на учащихся 9х классов Навыки и знания компьютера не требует от учащихся Созданная презентация позволяет ...Фосфор
Цели урока:. обеспечить усвоение учащимися знаний о фосфоре как о химическом элементе и простом веществе; аллотропных видоизменениях фосфора; повторить ...Фосфор
План урока. 1)СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА АТОМОВ ФОСФОРА И АЗОТА; 2)ФОСФОР, КАК ПРОСТОЕ ВЕЩЕСТВО ;АЛЛОТРОПНЫЕ МОДИФИКАЦИИ ФОСФОРА; 3)ИСТОРИЯ ОТКРЫТИЯ ...Фосфор
Форфор (phosphorus), неметаллический химический элемент подгруппы азота (VA) периодической системы элементов. Фосфор занимает 12-е место по распространенности ...Фосфор
Положение в ПСХЭ. Строение атома Р +15 ) ) ) 2 8 5 Возможные степени окисления: -3,0,+3,+5 Р0 +3ē → Р-3 – окислитель, восс-тся Р0 - 5ē → Р+5 - восс-ль, ...Фосфор и его соединения и их свойства
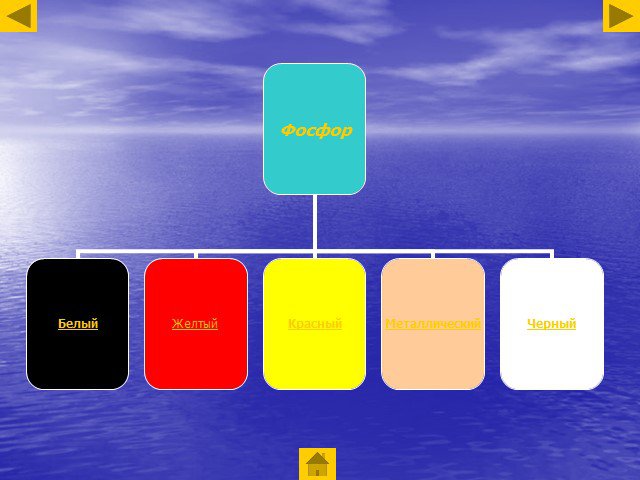
Аллотропные модификации фосфора. Чёрный фосфор Красный фосфор Белый фосфор. Химические свойства фосфора. Горение фосфора. Оксиды фосфора. Взаимодействие ...Фосфор
содержание. Введение……………………………………………………………………………. История развития фосфора………………………………………………………... Природные соединения и получение фосфора…………………………………... ...Фосфор как простое вещество
Фосфор как простое вещество. История открытия и изучения фосфора. Хенниг Бранд в 1669 г. открыл фосфор. И. Кункель Купил секрет получения фосфора. ...Фосфор
Аллотропные Модификации. Белый фосфор – P4 запах чесночный, Н в воде, Р в органических растворителях, летуч, Tпл= 440С, молекулярная кристаллическая ...Конспекты
Фосфор и его соединения
ТЕМА. . УРОКА:. «Фосфор и его соединения» (9 класс). . Цель. : выяснение общей характеристики фосфора на основании. положения в периодической ...Фосфор как химический элемент и вещество
Муниципальное бюджетное общеобразовательное учреждение. «Новотимошкинская основная общеобразовательная школа». Аксубаевского муниципального района ...Фосфор и его соединения
Урок по химии в 9 классе на тему: «Фосфор и его соединения». Цель урока:. Познакомить учащихся с историей открытия фосфора, его аллотропными ...Фосфор и его соединения
Тема урока: «Фосфор и его соединения». . Цель урока:. . • продолжить формирование понятий «элемент» и «вещество», а также показать многообразие ...Фосфор и его соединения
Тема:. . Фосфор и его соединения. . Класс. : 9. Цель:. . Знать характеристику фосфора как химического элемента и как простого вещества, знать ...Фосфор и его соединения
Предлагаю разработку урока с использованием проектной деятельности. Тема урока «Фосфор и его соединения». Цель урока:. на основе базовых знаний ...Фосфор и его свойства
Государственное казенное общеобразовательное учреждение Ростовской области. общеобразовательная школа-интернат основного общего образования. п. ...Фосфор и его свойства
МОУ «Средняя общеобразовательная школа № 4. г. Железногорска Курской области. УРОК В 9 КЛАССЕ ПО ТЕМЕ. «. Фосфор и его ...Фосфор - элемент жизни и мысли
Развернутый конспект урока. Учитель химии: Калеева Светлана Вениаминовна. № урока. Класс: 9 А. Тип урока:. урок изучения нового материала и совершенствование ...Фосфор – химический элемент и простое вещество
ПЛАН-КОНСПЕКТ УРОКА. 1. «Фосфор – химический элемент и простое вещество». (Тема урока). ФИО: Артемьева Елена Юрьевна. . Место работы: МОУ ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 апреля 2015
Категория:Химия
Классы:
Содержит:10 слайд(ов)
Поделись с друзьями:
Скачать презентацию