Конспект урока «Ковалентная полярная химическая связь» по химии
Конспект урока химии
Тема 11:
Ковалентная полярная химическая связь.
Цель урока: изучить механизм образования ковалентной неполярной связи.
Задачи:
-
Образовательные:
- сформировать понятие о ковалентной полярной связи;
-объяснить причины возникновения и структуру связи;
- научить записывать схемы образования ковалентной связи для двухатомных молекул и трехатомных молекул;
- сформировать понятие об электроотрицательности, характере его изменения по периоду и по группе;
- закрепить знания о химических элементах и ПСХЭ Д.И. Менделеева;
- продолжить формировать знания у учащихся о составе атома и атомного ядра.
2. Развивающие:
- развивать у учащихся умение самостоятельно работать с текстом учебника, извлекая из них нужную информацию;
- формировать у учащихся умение осуществлять основные мыслительные операции и излагать их в устной и письменной форме;
- развивать воображение, память и внимание;
- развивать умение ориентироваться в ПСХЭ Д.И. Менделеева.
3. Воспитательные:
- воспитывать у учащихся бережное отношение к своему здоровью и здоровью окружающих;
- продолжить формирование интереса учащихся к научным знаниям;
- формирование мировоззрения у учащихся и расширение их кругозора.
Оборудование: ПСХЭ Д.И. Менделеева, плакат.
Понятия урока: ковалентная полярная химическая связь, электроотрицательность, частичный заряд.
Тип урока: изучение нового материала.
Вид урока: традиционный.
Ход урока.
-
Организационный момент.
Проверка домашнего задания:
-
Написать схемы образования ковалентной неполярной связи :
1вариант - брома, кислорода
2 вариант – йода, серы(2)
Написать электронную и графическую формулы образования связи.
2. Упр. 2, 4, 5
-
Изучение нового материала.
Ребята, вам уже известно, что все химические элементы в ПСХЭ Д.И. Менделеева делятся на металлы и неметаллы. Напомните мне, почему элементы получили такие названия, с чем это связано? (металлы отдают электроны, а неметаллы – их принимают, т.е. забирают).
Мы с вами рассматривали как образуется химическая связь между атомами металлов и неметаллов. Скажите, как называется данный тип связи?(ионная)А почему она получила такое название, кто скажет мне?(образуются ионы). Вспомните, какие ионы по заряду образуются?(+ и -). Для атомов металлов образование каких ионов характерно? А для неметаллов? Почему?
На прошлом уроке мы рассматривали как образуется связь между 2-мя одинаковыми атомами неметаллов. Вспомним, как она называется? За счет чего образовалась данная связь?(за счет общих электронных пар, т.к. атомы одинаковые)
Подумайте и скажите, может ли образовываться химическая связь между 2-мя разными атомами неметаллов? Данная связь может образовываться за счет общих электронных пар, только в данном случае, связь будет несколько иной, т.к. атомы элементов разные. А какой, мы с вами сейчас рассмотрим на примере образования молекулы хлороводорода, состоящего из 1 атома хлора и 1 атома водорода:
-
Атом водорода расположен в 1 группе, 1-м периоде, - имеет всего 1 электрон. Скажите, сколько электронов не хватает ему до завершения энергетического уровня?(1 электрона, стремиться быть похожим на инертный газ – гелий, у которого завершенный уровень равен 2 е).
-
Атом хлора расположен в 7-й группе, 2-м периоде. Скажите сколько не спаренных электронов он имеет? Сколько электронов ему не хватает до завершения энергетического уровня?
-
Как вы думаете, могут ли атомы разных химических элементов на примере водорода и хлора объединить свои непарные электроны, чтобы образовать общую электронную пару и тем самым достичь завершенного энергетического уровня? Давайте подумаем, какая связь здесь будет образовываться? Будет ли образовываться здесь ионная связь? Почему?(Ме и НеМе), а ковалентная?(НеМе). Действительно, здесь будет образовываться ковалентная связь. Давайте запишем структурную формулу образования молекулы хлороводорода:
Н + Cl H Cl
+ Cl H Cl
Атомы разных элементов имеют различное электронное строение, содержат разное число е на внешнем уровне, поэтому обладают различной способностью к притягиванию «чужих» е. атомы одних элементов сильнее притягивают е, а атомы других – слабее. Эта способность атомов химических элементов притягивать к себе общие электронные пары называется электроотрицательностью.
Электроотрицательность(ЭО) – способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Чем больше ЭО, тем сильнее атом данного элемента притягивает к себе общие электронные пары.
Т.о. можно сказать, что ЭО – мера неметалличности химических элементов. Чем больше ЭО, тем больше неметалличность элемента(тем более сильным неметаллом является данный элемент).
Поскольку ЭО мера неметалличности элемента, то она изменяется вместе с нею, имеет те же закономерности в изменении свойств неметаллов по периоду и по группе. Вспомним, как изменяются свойства неметаллов по периоду и по группе?
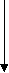
Э О ЭО
О ЭО
Возрастает Уменьшается
Откройте учебники на странице 64. Здесь вы увидите ряд электроотрицательности. Данный ряд поможет вам определить, в сторону какого химичес кого элемента смещаются общие электронные пары при образовании химической связи. Запишите в тетрадь ряд электроотрицатьельности. Как мы видим, ЭО уменьшается слева направо от фтора к водороду. Какой вывод мы можем сделать? Самый сильный НеМе – фтор, самый слабый – водород. Общие электронные пары смещаются в сторону более ЭО атома элемента.
Если элемент оттягивает на себя чужие электроны, значит, он будет приобретать частичный отрицательный заряд. Частичный потому, что происходит лишь смещение е, но не полный отрыв(как в случае ионной связи). Частичный заряд обозначается греческой буквой дельта δ и ставится над знаком химического элемента. А что же будет с атомом менее ЭО элемента? Атомы такого элемента будут иметь избыточный положительный заряд. Т.О., внутри молекулы будет 2 полюса: на одном конце – отрицательный заряд (δ-), на другом – положительный (δ +). Поэтому такая связь и называется полярной(от слова «полюс», - образуются 2 полюса с отрицатиельным и положительным зарадами).
H δ+Cl δ-
δ+Cl δ-
В химической формуле первым пишется знак менее ЭО элемента(в данном случае водорода). В случае образования ковалентной неполярной связи общие е не смещаются к одному из атомов, т.к. атомы одинаковые, и не имеют зарядов-полюсов.
Полярная связь не является новым видом химической связи, а представляет собой разновидность ковалентной связи, поэтому алгоритм схематического изображения здесь такой же, как в случае неполярной связи, только мы рассматриваем электроотрицательность(показываем ее стрелкой) и ставим частичные заряды атомов элементов. Дома выпишите алгоритм образования молекулы с ковалентной полярной связью.
Рассмотрим схему образования ковалентной неполярной связи на примере молекулы OF2
-
Кислород – элемент главной подгруппы 6 группы в ПСХЭ. Сколько атомов имеется на внешнем энергетическом уровне?(6). Назовите число непарных электронов(8-6=2)
Фтор – элемент 7 группы главной подгруппы в ПСХЭ. Сколько у него е на внешнем энергетическом уровне, назовите число непарных е?
-
Запишем знаки химических элементов с обозначением внешних электронов:
F О F
-
Запишем электронную и структурную формулы образования молекул:
 F + О + F F О F
F + О + F F О F
F – О – F
4. По ряду электроотрицательности(ЭО) определим, что общие электронные пары будут смещены от атома кислорода к атому фтора, т.е. связь будет ковалентной полярной(заменяем черточки стрелками):
F δ- – О δ+– F δ-
В целом можно отметить, при образовании ковалентной полярной связи каждый атом завершает свой энергетический уровень(добивается 8-ми электронного строения).
3.Закрепление изученного материала.
Итак, сегодня на уроке мы познакомились еще с одной разновидностью связи. Давайте вспомним:
-
Как называется связь между двумя одинаковыми атомами НеМе?
-
Между разными атомами НеМе?
-
Что показывает ЭО?
-
Как изменяется ЭО по периоду и по группе?
-
Какой самый сильный НеМе? Какой самый слабый НеМе?
-
Что означает частичный заряд? Какой частичный заряд приобретает сильный НеМе?, слабый?
-
Почему связь называют полярной?
-
Домашнее задание.
§ 11, Упр. 1, 2
Здесь представлен конспект к уроку на тему «Ковалентная полярная химическая связь», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

