Конспект урока «Ионная связь» по химии для 9 класса
Конспект урока химии
Тема 9:
Ионная связь.
Цель урока: изучить строение ионной связи.
Задачи:
-
Образовательные:
- сформировать понятие о ионной связи;
-объяснить причины возникновения и структуру связи;
- закрепить знания о химических элементах и ПСХЭ Д.И. Менделеева;
- продолжить формировать знания у учащихся о составе атома и атомного ядра.
2. Развивающие:
- развивать у учащихся умение самостоятельно работать с текстом учебника, извлекая из них нужную информацию;
- формировать у учащихся умение осуществлять основные мыслительные операции и излагать их в устной и письменной форме;
- развивать воображение, память и внимание;
- развивать умение ориентироваться в ПСХЭ Д.И. Менделеева.
3. Воспитательные:
- воспитывать у учащихся бережное отношение к своему здоровью и здоровью окружающих;
- продолжить формирование интереса учащихся к научным знаниям;
- формирование мировоззрения у учащихся и расширение их кругозора.
Оборудование: ПСХЭ Д.И. Менделеева, плакат.
Понятия урока: ионы положительные и отрицательные, ионная химическая связь, коэффициенты и индексы.
Тип урока: изучение нового материала.
Вид урока: традиционный.
Ход урока.
-
Организационный момент.
-
Упр. 1, 3 у доски.
-
Дать определение понятиям «Металлы и неметаллы».
-
Как изменяются металлические и неметаллические свойства элементов:
А) по периоду;
Б) по группе.
С чем это связанно. Ответ поясните.
2. Изучение нового материала.
Давайте рассмотрим, что произойдет с атомами элементов, если они достигнут завершенного энергетического уровня. Допустим встречаются 2 атома: металла и неметалла.






+11Na0 +17Cl0
2 8 1 2 8 7
У атома металла на внешнем энергетическом уровне Сколько электронов?(1е) Вспомним, как атому натрия достигнуть завершенного энергетического уровня?(отдать 1е), а как атому хлора достичь своего завершенного уровня?(принять 1е). Скажите, как называются химические элементы, которые отдают электроны с внешнего энергетического уровня? А как называются элементы, которые принимают недостающие электроны на свой внешний энергетический уровень?
Вывод: чтобы достичь завершенного уровня необходимо атому металла(назовите) отдать 1е атому неметалла(назовите).
Следовательно, атом натрия легко отдаст свой наиболее удаленный от ядра и слабо связанный с ним электрон атому неметалла, который предоставит ему свое свободное место на внешнем энергетическом уровне.
11Na0






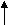
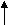
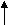

1s22s2 2p6 3s1
17Cl0


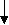



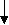
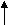
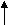
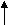
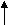
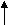
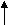
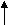
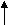
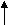
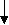
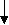




1s2 2s2 2p6 3s23p5
11Na0 2е; 8е; 1е - Сколько протонов у натрия? Т.Е. можно сказать, что атом натрия содержит одинаковое число протонов и нейтронов. В целом атом нейтрален(поэтому над знаком элемента выставляем ноль- нулевой заряд)
11Na+ 2е; 8е - это формула заряженной частицы, когда атом натрия отдаст свой электрон кому?(правильно, атому хлора). Т.к. атом отдает 1е, то он заряжается положительно, т.е. у натрия появляется заряд+1
N a0 -1е Na+
a0 -1е Na+
Напоминаю, что заряд ставится в правом верхнем углу( +1 мы не пишем, а просто ставим +).
Давайте рассмотрим, что произойдет с атомом хлора. Хлор принимает на свой внешний энергетический уровень сколько электронов(напомните мне)? Соответственно как заряжается атом хлора – отрицательно(потому что он забирает электроны, а тот, кто отдает электроны – заряжается положительно).
17Cl0 2e; 8е; 2е; 5е – формула нейтрального атома хлора, т.к. число протонов и электронов равны.
17Cl- 2e; 8е; 2е; 6е - формула заряженной частицы, когда атом хлора примет на свой энергетический уровень 1е..
Хлор принимает на свой внешний энергетический уровень сколько электронов(напомните мне)? Соответственно как заряжается атом хлора – отрицательно(потому что он забирает электроны, а тот, кто отдает электроны – заряжается положительно).
C l0 +1е Cl-
l0 +1е Cl-
В результате принятия или отдачи электронов образуются заряженные частицы + и -. Их называют ионы. Между положительными ионами натрия и отрицательными ионами хлора образуется связь, которая называется ионной.
Рассмотрим образование ионной связи:






+11 Na0 + +17Cl0 Na+ Cl-
+11 +17
2 8 1 2 8 5 2;8 2;8;8
Na0 + Cl0 = Na+ + Cl- = Na+ Cl-
Атом атом ион ион ионное соединение
Ионная связь образуется всегда при взаимодействии атомов типичных металлов и неметаллов.(Укажите их соответственно)
Рассмотрим алгоритм рассуждений при записи схемы образования ионной связи на примере кальция и кислорода:
-
Кальций – это элемент главной подгруппы II группы ПСХЭ, металл. Его атому легче отдать 2 лишних электрона с внешнего энергетического уровня, чем принять недостающие шесть: (пример на стр. 57)
-
Хлор – это элемент главной подгруппы VII группы, неметалл. Его атому легче принять 1е, которого не хватает до завершения внешнего энергетического уровня, чем отдать 7е(см. стр.58)
-
Сначала находим наименьшее общее кратное между зарядами образовавшихся ионов, оно равно 2(2*1). Затем определим, сколько атомов кальция нужно взять, чтобы они отдали 2е(т.е. надо взять 1 атом кальция), и сколько атомов хлора надо взять, чтобы они смогли принять 2е(т.е. нужно взять 2 атома хлора)
-
Схематично образование ионной связи между атомами кальция и хлора можно записать так:
Са0 + 2Сl0 = Са2+Сl-2
Для выражения состава ионных соединений пользуются формульными единицами – аналогами молекулярных формул.
Цифры, показывающие число атомов, молекул или формульных единиц, называют коэффициентами; а цифры, показывающие число атомов в молекуле или ионов в формульной единице, называют индексами.
-
Закрепление изученного материала.
Итак, давайте вспомним, что мы сегодня изучали на уроке:
-
Какие элементы способны к отдаче электронов?
-
Какие элементы способны к принятию электронов?
-
Как заряжаются элементы при отдаче е?
-
Как заряжаются элементы при принятии е?
-
Что происходить с элементами после принятия или отдачи е?
-
Какую связь образуют ионы?
-
Между какими атомами элементов образуется данная связь?
-
Для чего понадобилось образовывать ионную связь?
-
Домашнее задание.
§ 9, упр. 2 письменно
Атом. Строение электронных оболочек.
Вариант 1.
1. Даны химические элементы с порядковым номером 4, 8. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 1.
1. Даны химические элементы с порядковым номером 4, 8. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 1.
1. Даны химические элементы с порядковым номером 4, 8. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 1.
1. Даны химические элементы с порядковым номером 4, 8. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 1.
1. Даны химические элементы с порядковым номером 4, 8. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 2.
1. Даны химические элементы с порядковым номером 12, 16. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 2.
1. Даны химические элементы с порядковым номером 12, 16. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 2.
1. Даны химические элементы с порядковым номером 12, 16. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 2.
1. Даны химические элементы с порядковым номером 12, 16. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Атом. Строение электронных оболочек.
Вариант 2.
1. Даны химические элементы с порядковым номером 12, 16. Напишите:
-
химический знак элементов, число энергетических уровней, укажите число электронов на каждом энергетическом уровне.
-
Как вы думаете, что необходимо совершить данным элементам, чтобы достичь завершенного энергетического уровня.
3) Как вы думаете, к каким классам(металлы или неметаллы)относятся данные элементы. Ответ поясните.
Здесь представлен конспект к уроку на тему «Ионная связь», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

