Презентация "Кремний" по химии – проект, доклад
Презентацию на тему "Кремний" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Кремний и его соединения
Дать общую характеристику элементу кремний. Рассмотреть природные соединения кремния. Провести сравнительный анализ с соединениями углерода. Изучить ...Кремний и его соединения
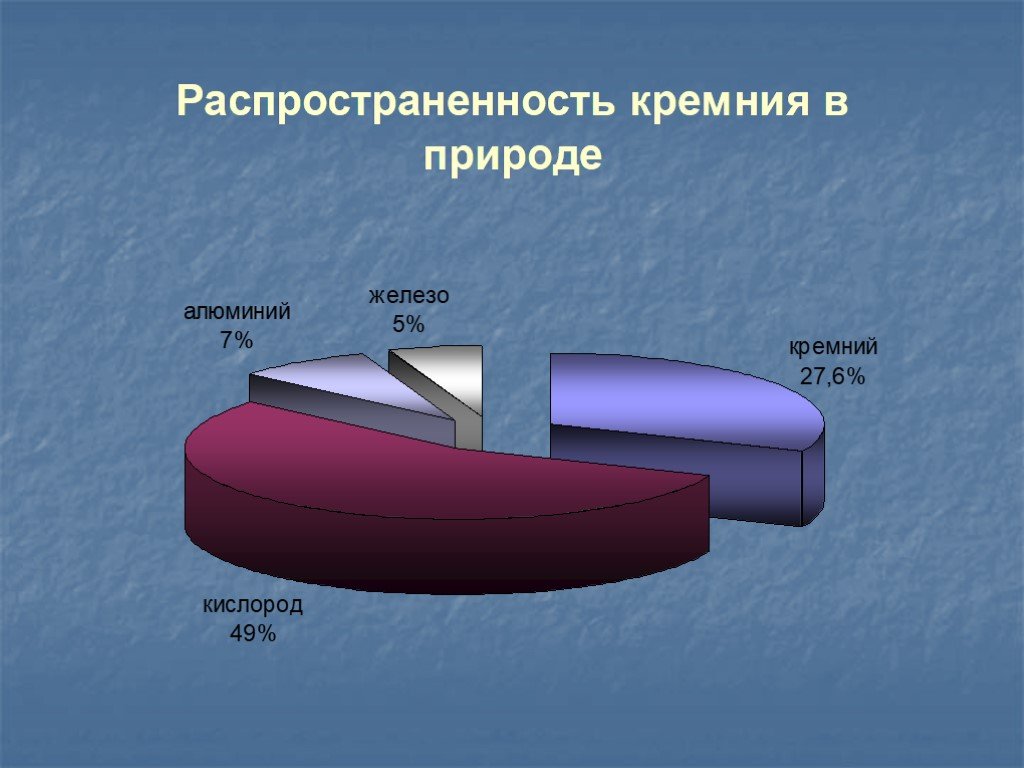
Нахождение в природе. SiO2 кремнезём (песок). Al2O3∙ 2SiO2∙2H2O каолинит (глина). По распространенности занимает второе место после кислорода (26%). ...Кремний и его соединения
Короткова Фаина Алексеевна, учитель химии и биологии МБОУ Летуновской СОШ. Контактная информация: - e-mail: korotkova_faina@mail.ru - тел. +7 903 ...Кремний в природе
9 класс. КРЕМНИЙ В ПРИРОДЕ ИСПОЛЬЗОВАНИЕ КРЕМНЕЗЕМА ДЛЯ ПРОИЗВОДСТВА СТЕКЛА ПРИМЕНЕНИЕ СТЕКЛА. Si – ВТОРОЙ ПО РАСПРОСТРАНЕННОСТИ ЭЛЕМЕНТ НА ЗЕМНОМ ...Кремний
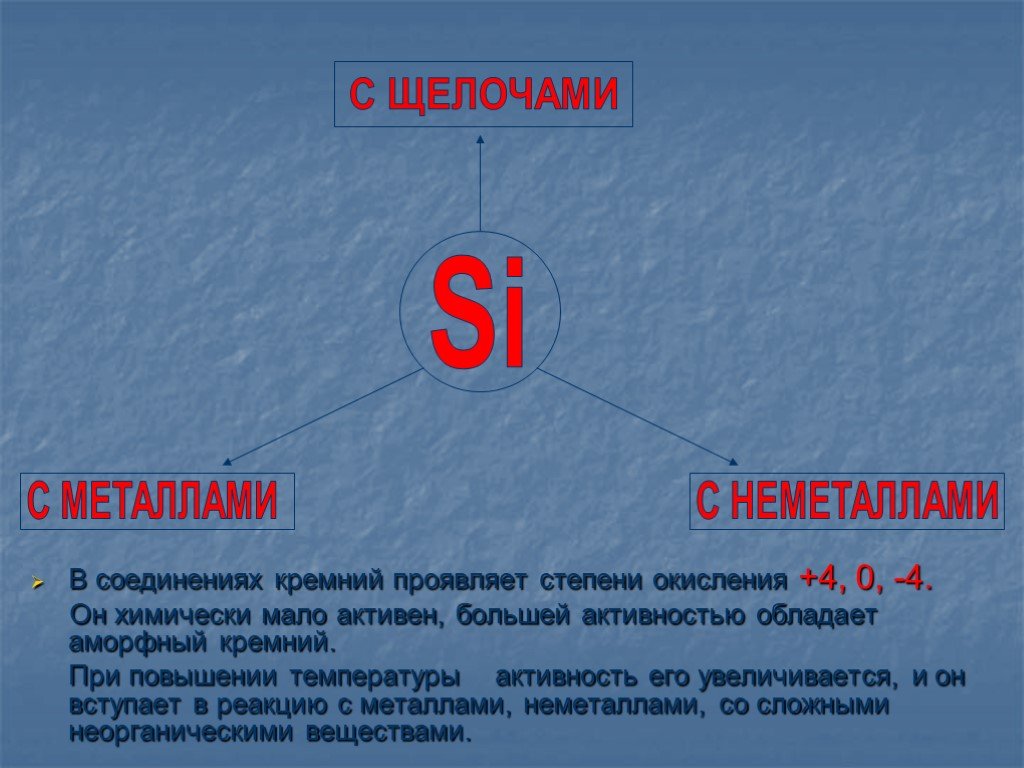
В главной подгруппе четвёртой группы В третьем малом периоде Возможные степени окисления: -4, 0, +2, +4. Si – ВТОРОЙ ПО РАСПРОСТРАНЕННОСТИ ЭЛЕМЕНТ ...Кремний
Si 30,9738 Р S 32,064 Сера 16 Cl 17 Al 13 Алюминий 26,982 I 10 Периоды Ряды.Периодическая система химических элементов Д.И.Менделеева.
39,948 24,312 ...
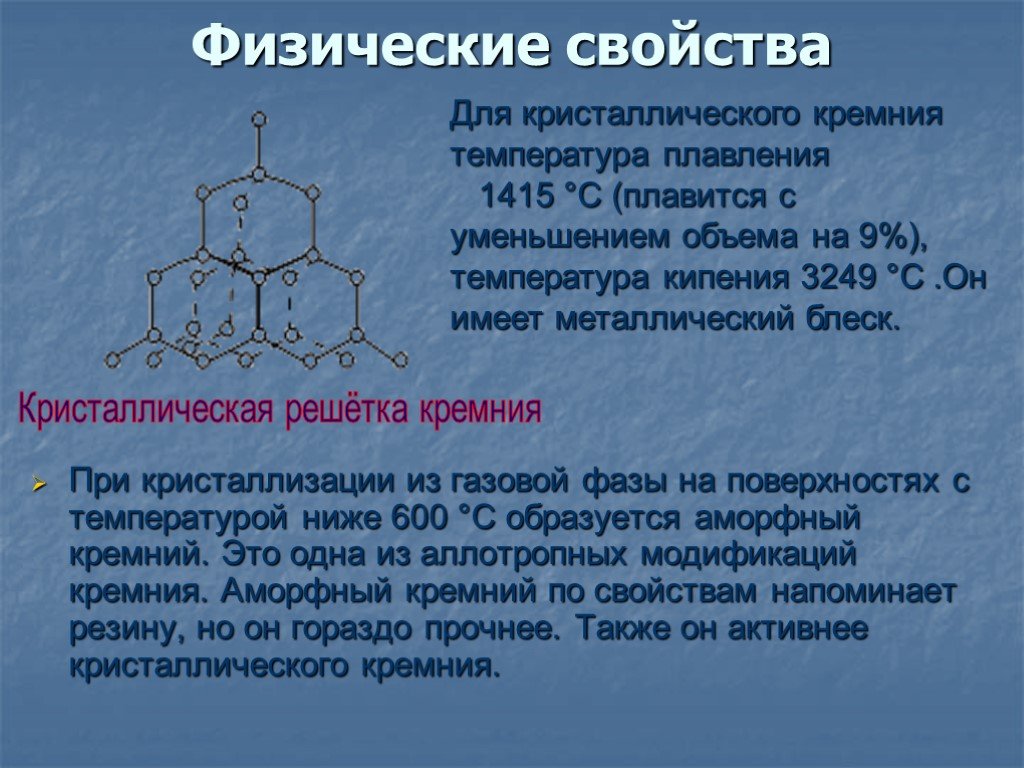
Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ...Кремний
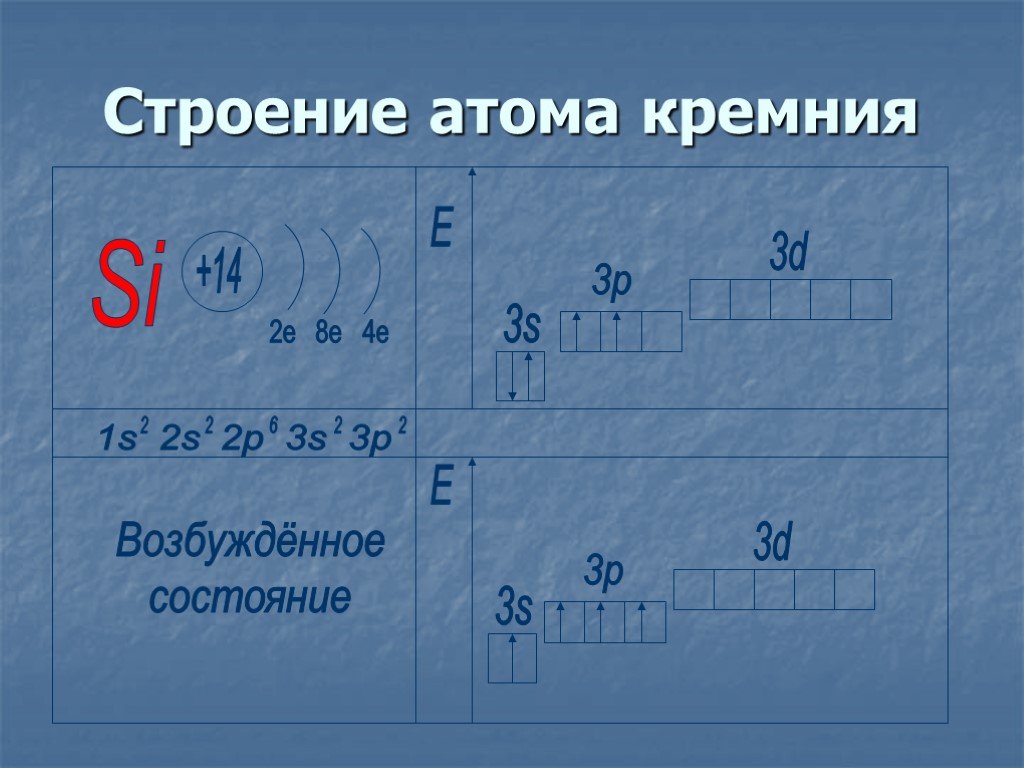
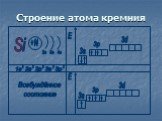
Положение в ПСХЭ Д.И.Менделеева. ↑ ↑↓ 1s2 Строение атома 14Si 2e 4e 8e. № 14 Ar(Si) = 28 Z =+14, 14p+, 14e-, 14n0. р - элемент 28 2p6 2s2. В природе ...Кремний
Кремний. в виде кристаллов входит в состав горных пород образует бесцветные кристалла кварца и горного хрусталя на его основе создано промышленное ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Конспекты
Кремний и его соединения. Стекло. Цемент
Дата_____________ Класс_______________. Тема:. . Кремний и его соединения. Стекло. Цемент. Цели урока:. знать состав, строение, свойства оксидов ...Кремний и его соединения
Конспект урока химии «Кремний и его соединения». Приветствую тебя, мой юный исследователь! Предлагаю тебе сегодня обратиться самым настоящим пиратом. ...Кремний – химический элемент или природный дар. ...Силикаты
9 класс химия ( Габриелян). Учебное занятие № 44. Дата:. Тема: Кремний – химический элемент или природный дар. ...Силикаты. Эпиграф к уроку:. ...Кремний и его соединения
Т.В.Кузнецова,учитель химии, школа № 53. . ПЛАН-КОНСПЕКТ УРОКА. . «Кремний и его соединения». (тема урока). . ФИО Кузнецова Татьяна ...Кремний
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». г.Нижнекамск Республика Татарстан. Конспект урока по химии в 9 классе«. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 января 2019
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию