Презентация "Азот и фосфор-характеристика" по химии – проект, доклад
Презентацию на тему "Азот и фосфор-характеристика" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 37 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика элементов VA-группы. Азот
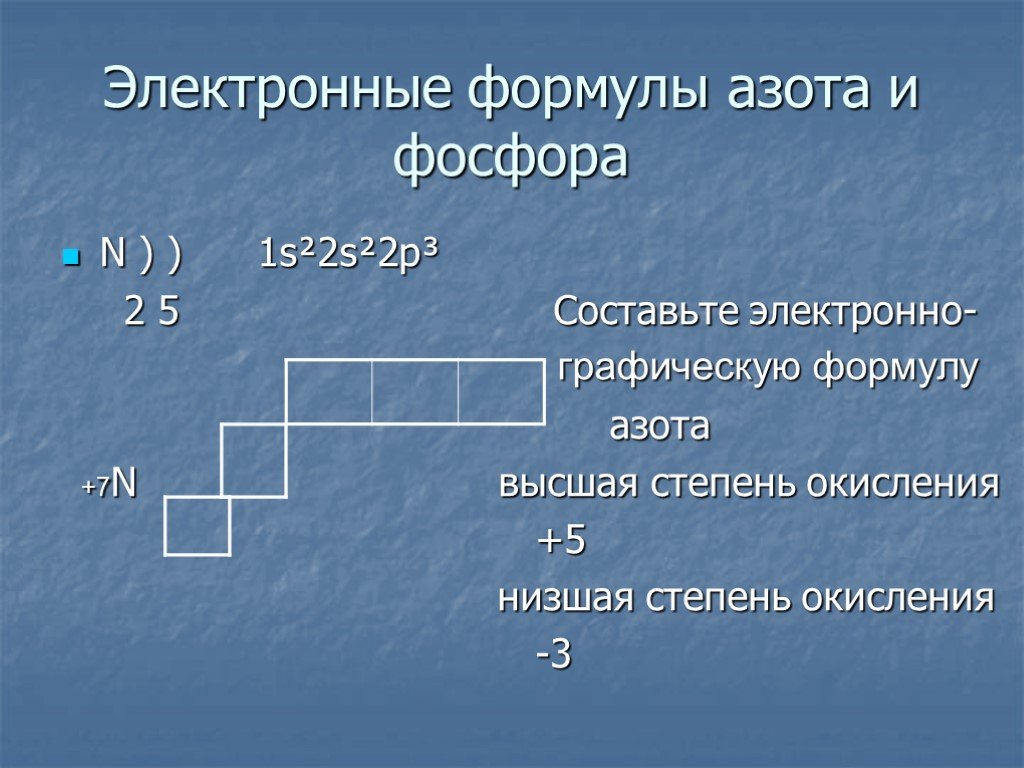
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Азот урок химии
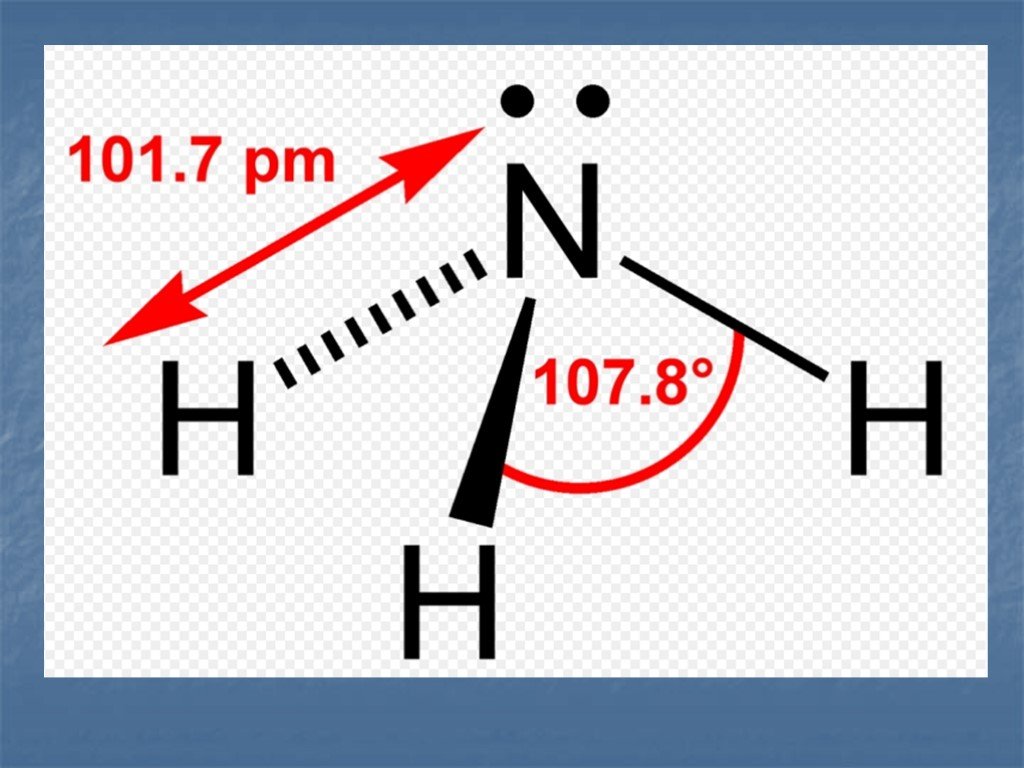
ЦЕЛИ :. Сформировать представление о строении атома и молекулы азота. Рассмотреть физические и химические свойства азота в свете ОВР. Показать значение ...Азот химия
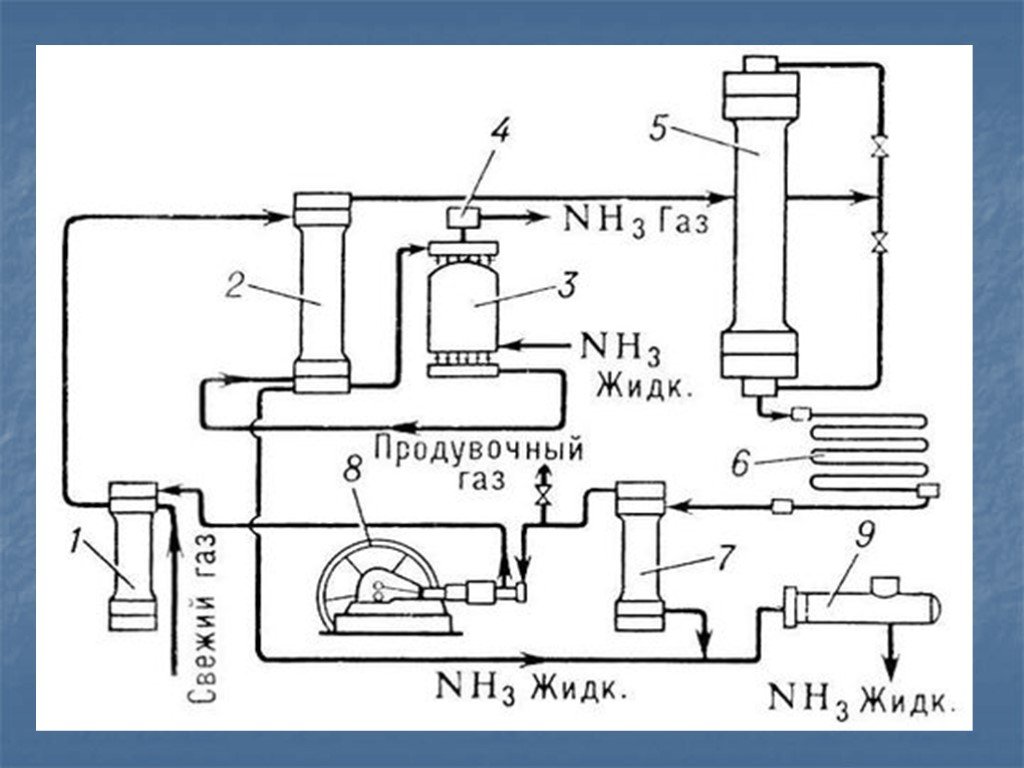
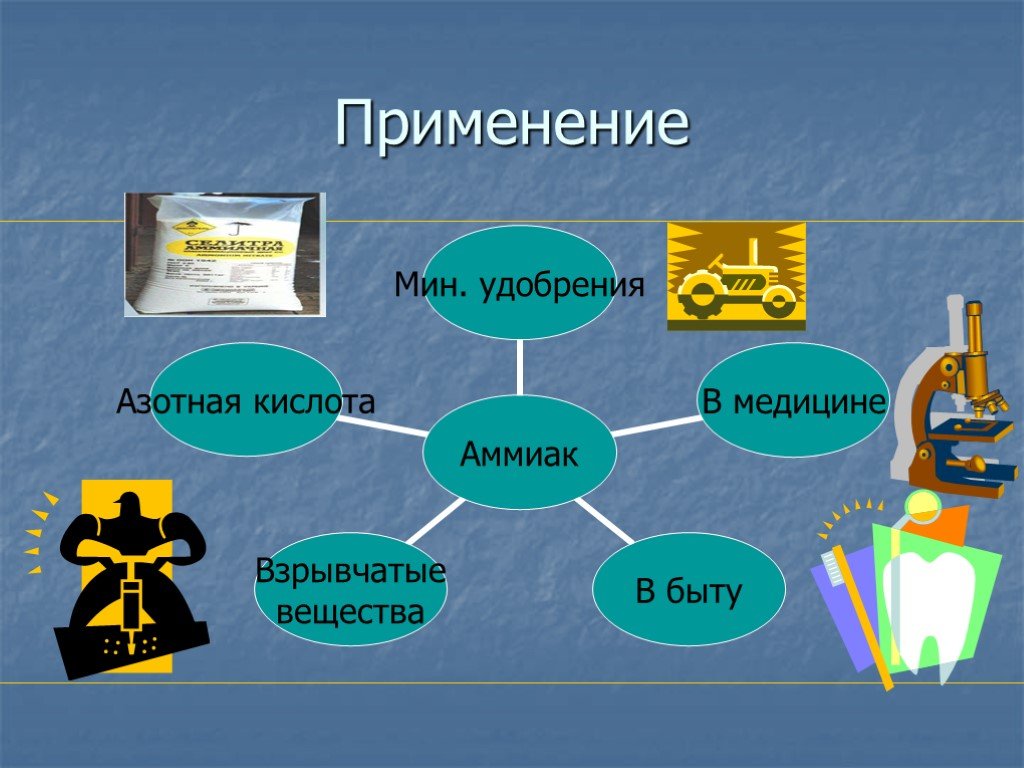
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Азот и его свойства
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот и его соединения
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Азот (N2)
Азот (от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная ...Азот
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот
ИСТОРИЯ ОТКРЫТИЯ. 1772г. К.Шееле и Г.Кавендиш получили азот Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил название азот – «безжизненный» ...Урок Азот
Цели урока. 1) Образовательные задачи: Сформировать систему знаний общей характеристики элемента V (А) гр. – азота в свете двух форм существования ...Азот
Проблемно-поисковый метод урока Цели урока:. Закрепить знания учащихся о строении атома и молекулы азота; Изучить физические и химические свойства ...Азот
Строение атома. «Паспорт Элемента» Химический элемент таблицы Менделеева, неметалл. Символ элемента: N. Атомный номер: 7. Положение в таблице: 2-й ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Конспекты
Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Тема урока: Азот. . . (Первый уровень). Интегрирующая цель:. . . - знать физические и химические свойствах азота, показать значение азота ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 декабря 2018
Категория:Химия
Содержит:37 слайд(ов)
Поделись с друзьями:
Скачать презентацию