Презентация "Азот" (10 класс) по химии – проект, доклад
Презентацию на тему "Азот" (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Азот урок химии
ЦЕЛИ :. Сформировать представление о строении атома и молекулы азота. Рассмотреть физические и химические свойства азота в свете ОВР. Показать значение ...Азот и его соединения
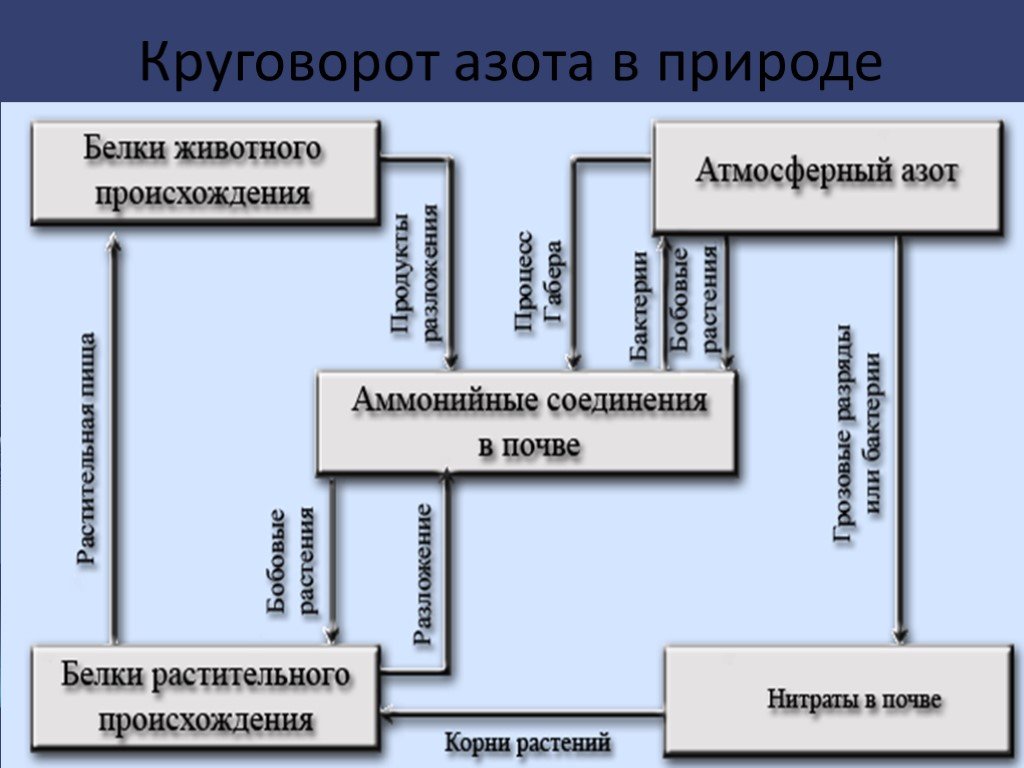
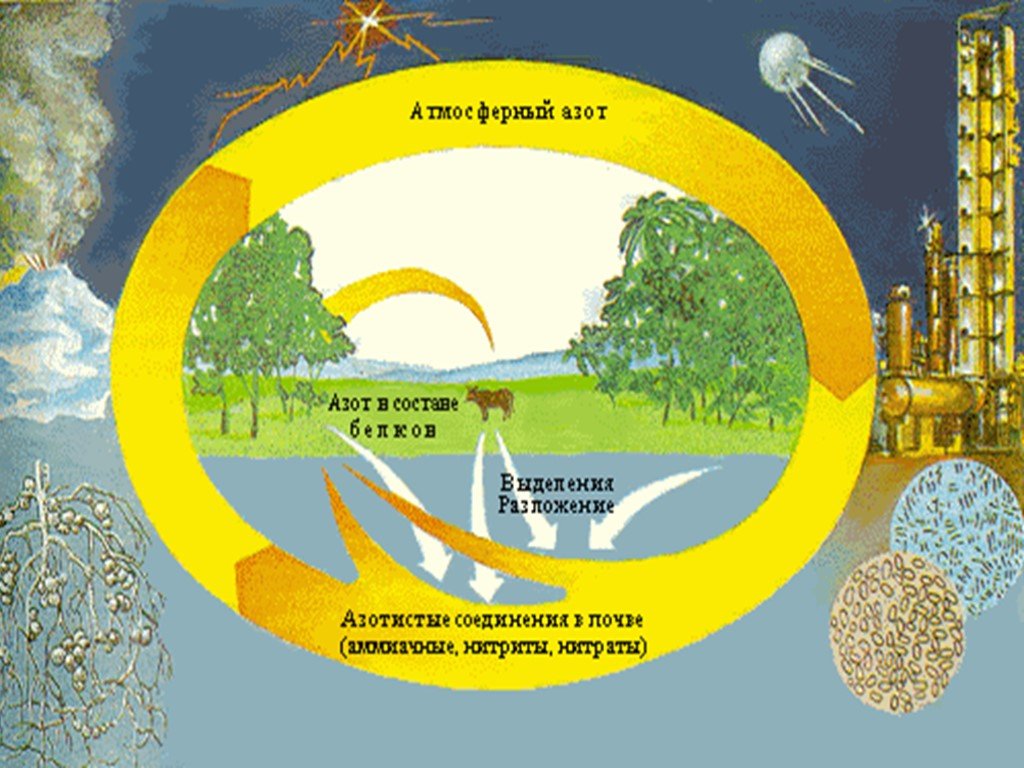
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Азот и фосфор-характеристика
V группа А подгруппа. К элементам этой подгруппы относятся: N ; P ; As ; Sb; Bi. Особенно большое значение имеют азот и фосфор Азот входит в состав ...Азот и его свойства
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот (N2)
Азот (от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная ...Азот
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Азот
Проблемно-поисковый метод урока Цели урока:. Закрепить знания учащихся о строении атома и молекулы азота; Изучить физические и химические свойства ...Азот
ИСТОРИЯ ОТКРЫТИЯ. 1772г. К.Шееле и Г.Кавендиш получили азот Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил название азот – «безжизненный» ...Урок Азот
Цели урока. 1) Образовательные задачи: Сформировать систему знаний общей характеристики элемента V (А) гр. – азота в свете двух форм существования ...Интерактивная игра "Химия в ребусах: Химические элементы"
НИКЕЛЬ. ИОД. АЗОТ. БОР. МАГНИЙ Й. МАРГАНЕЦ. КРЕМНИЙ Л=й. МЫШЬЯК. УГЛЕРОД О. ЦИРКОНИЙ. АРГОН. МЕДЬ ДВЕ. КРИПТОН. ЗОЛОТО. СЕРА П=А. ВОДОРОД А=О Т=Д. ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ..."Химические элементы и вещества"
Цель урока:. Повторить основные вопросы по изученному разделу “Вещества и химические явления”, закрепить полученные знания. Физические свойства веществ. ...М.В. Ломоносов и химия
- М.В. Ломоносов был создателем многих химических производств (неорганических пигментов, глазурей, стекла, фарфора). - Он разработал технологию и ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Конспекты
Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Тема урока: Азот. . . (Первый уровень). Интегрирующая цель:. . . - знать физические и химические свойствах азота, показать значение азота ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию