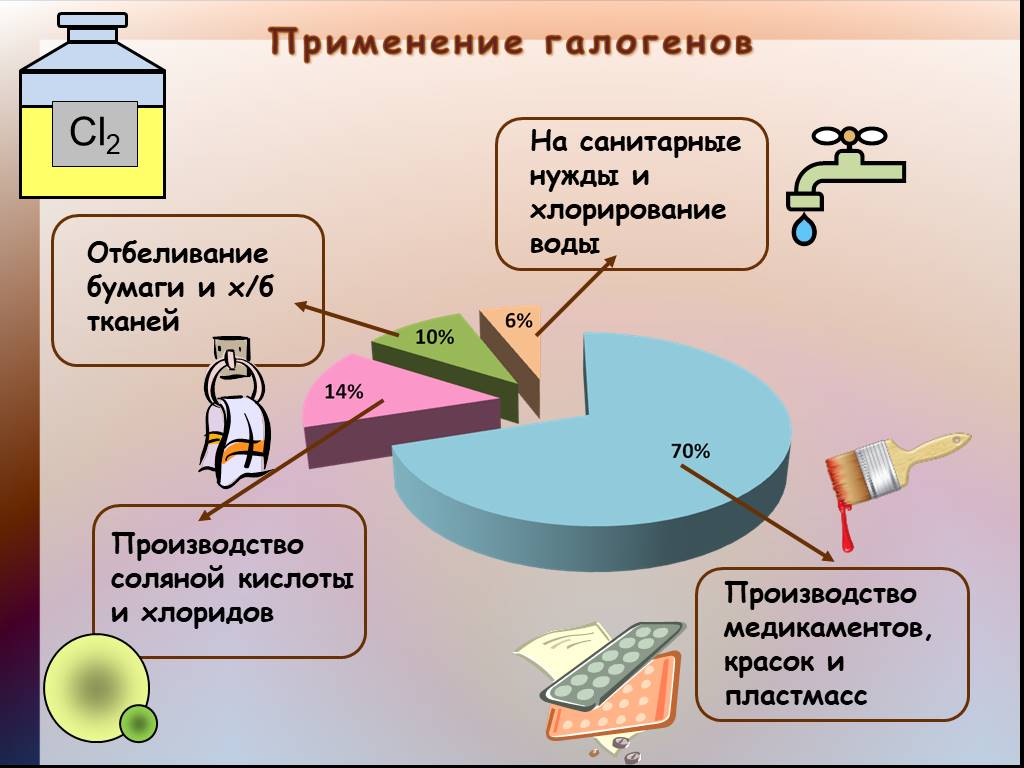
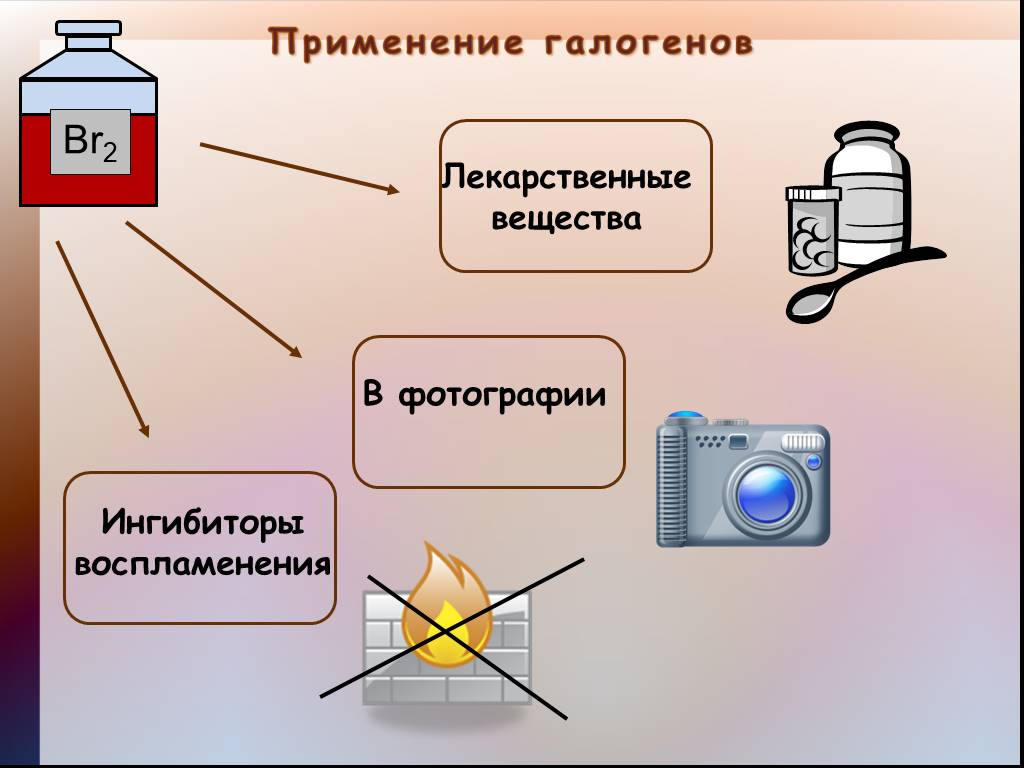
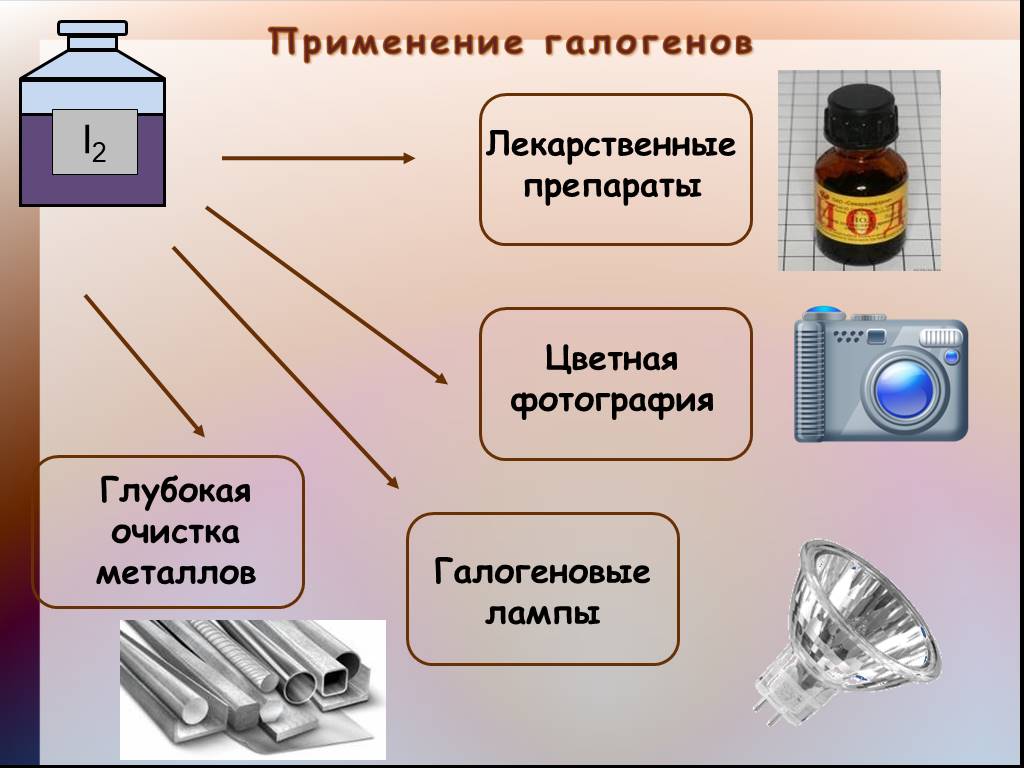
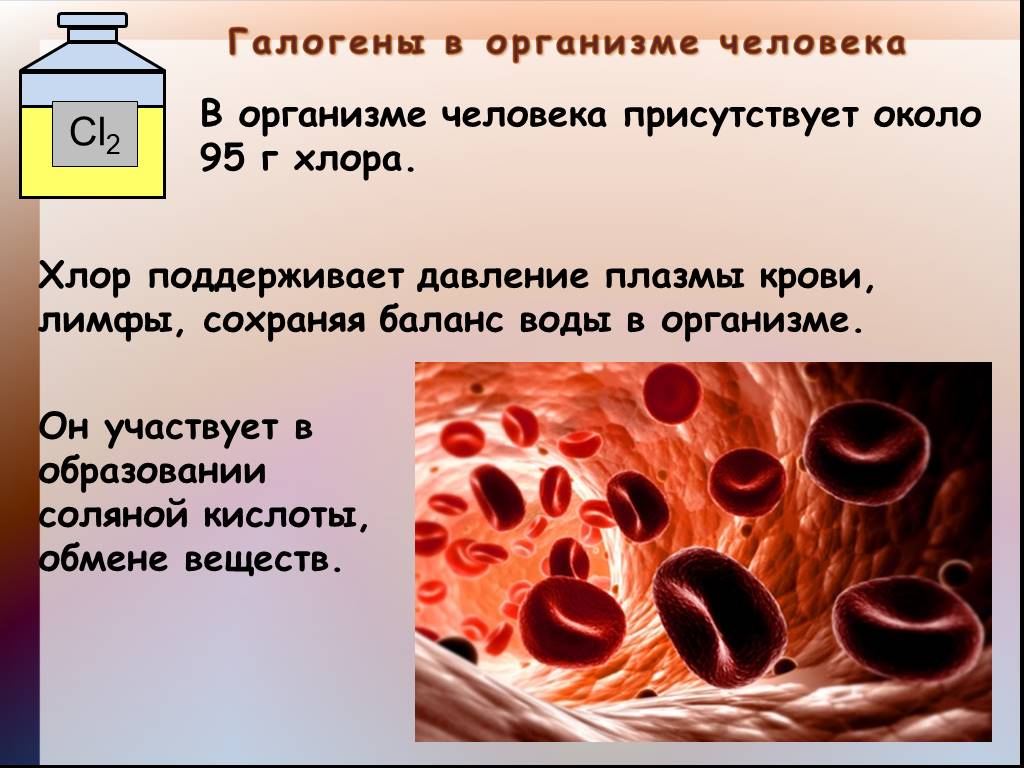
Презентация "Общая характеристика галогенов." по химии – проект, доклад
Презентацию на тему "Общая характеристика галогенов." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Общая характеристика галогенов
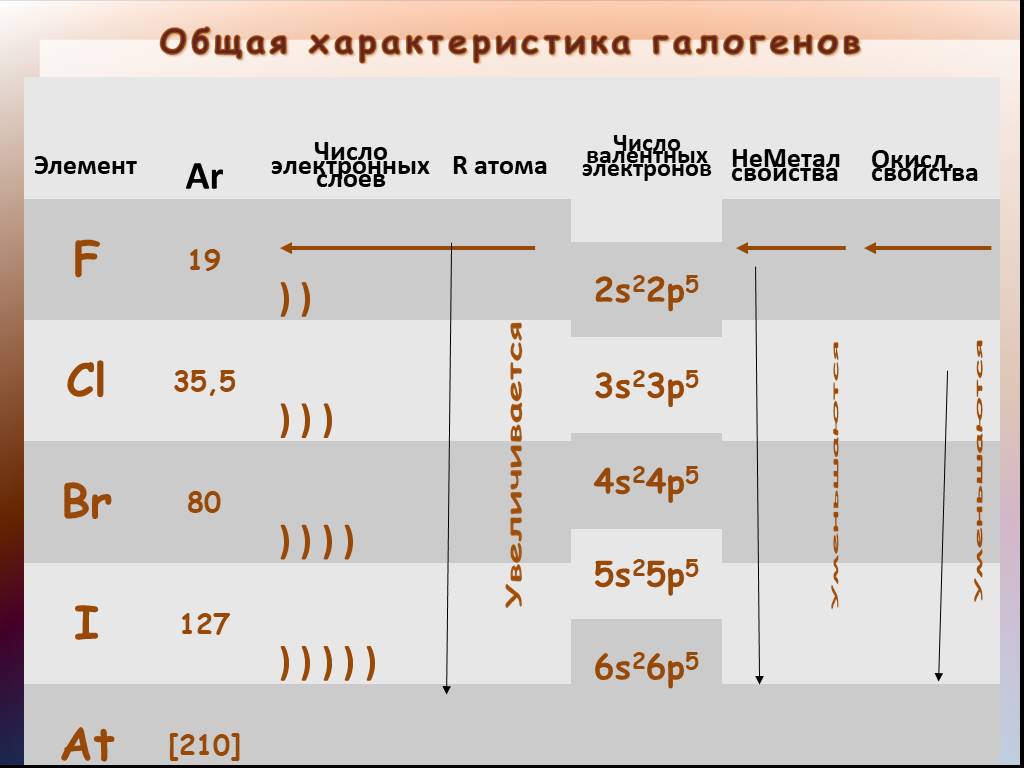
Цель урока:. Повторить свойства металлов и неметаллов Изучить строениеатомов, свойства галогенов на основании их сравнительной характеристики. Ответы ...Общая характеристика галогенов
Цели урока:. 1.Систематизировать знания учащихся о галогенах. 2.Ознакомить учащихся с окислительными свойствами галогенов. 3.Повторить, обобщить и ...Водород, его общая характеристика, нахождение в природе и его свойства
Цели. сформировать знания учащихся о водороде как о атоме и простом веществе, его способах получении, свойствах и применении научить учащихся работать ...Общая характеристика неметаллов
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами атомов и большим ...Азот. Общая характеристика
Азот – это вечный источник танталовых мук человечества, это вечные терзания голода среди океана изобилия. М.Камен (американский биохимик). Источник ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Общая характеристика оксидов
Оксиды - это сложные вещества, состоящие из двух элементов, один из которых кислород. Например: CaO, SO2, Al2O3, CO. Оксиды. Оксиды – соединения элементов ...Общая характеристика подгруппы углерода
Сравнительная характеристика элементов IV группы главной подгруппы. 2s22p2 3s23p2 4s24p2 5s25p2 6s26p2 C Si Ge Sn Pb 73 119 )) ))))) ))) )))))) ))))))) ...Общая характеристика элементов главной подгруппы VI группы (подгруппы кислорода)
Строение атома. КИСЛОРОД. Кислород O2 (К.В. Шееле 1772 г., Дж. Пристли 1774 г.) Самый распространенный элемент на Земле; в воздухе - 21% по объему; ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Неметаллы-общая характеристика
Неметаллы. Общая характеристика Кислород и кремний составляют 76% от массы земной коры (О – 49%, Si – 27%) C,H,O,N,P,S – биогенные элементы, составляют ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Общая характеристика металлов главных подгрупп I-III
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Кислород. Общая характеристика, получение и свойства
Химический элемент Знак элемента – О Относительная атомная масса – 16 Валентность – II. Кислород. Простое вещество Неметалл Молекула – О2 Относительная ...Общая характеристика реакций органических соединений
Классификация органических реакций. I. По результату реакции делят на 1) реакции замещения , S , (substitution замещение). CH4 + Cl2 CH3Cl + HCl ...Соединения галогенов
План урока. 1. Галогеноводородные кислоты. 2. Соляная кислота и её свойства. 3. Соли галогеноводородных кислот. Галогениды. Качественные реакции на ...Соединения галогенов
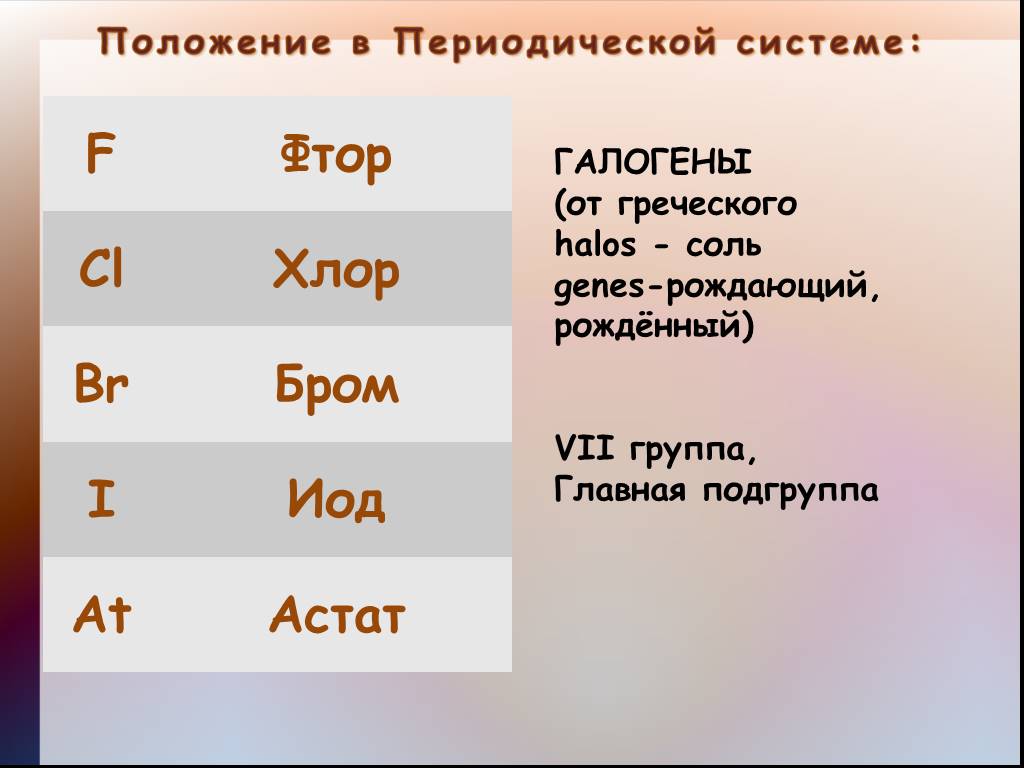
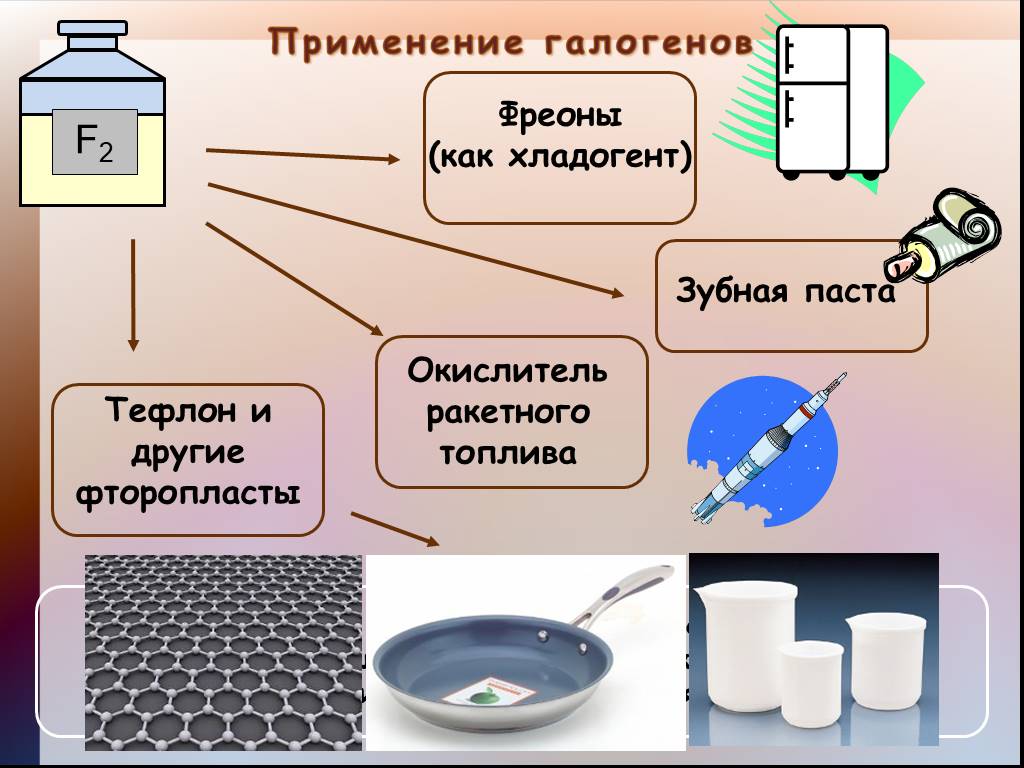
Экспресс опрос класса:. 1. Какие элементы называются галогенами? 2. Охарактеризуйте положение галогенов в Периодической системе Д.И.Менделеева. 3. ...Получение галогенов. Биологическое значение и применение галогенов
Давайте вспомним . . . Положение галогенов в таблице Менделеева Что вы можете сказать о физических свойствах галогенов А) Агрегатное состояние Б) ...Токсикологическая характеристика оксидов серы
Физические свойства. SO2 (серистый ангидрид; сернистый газ). SO3 (серный ангидрид). Окси́д се́ры(IV) (диокси́д се́ры, серни́стый газ, серни́стый ангидри́д) ...Алюминий и его характеристика
Цель урока. Рассмотрение характеристики алюминия по трем формам существования химических элементов: атомов, простых и сложных веществ. Задачи урока. ...Конспекты
Общая характеристика галогенов. Хлор
Тема:. Общая характеристика галогенов. Хлор. Цели:. Развивать. знания о семействе галогенов на примере хлора и его соединений, изучить строение ...Общая характеристика галогенов
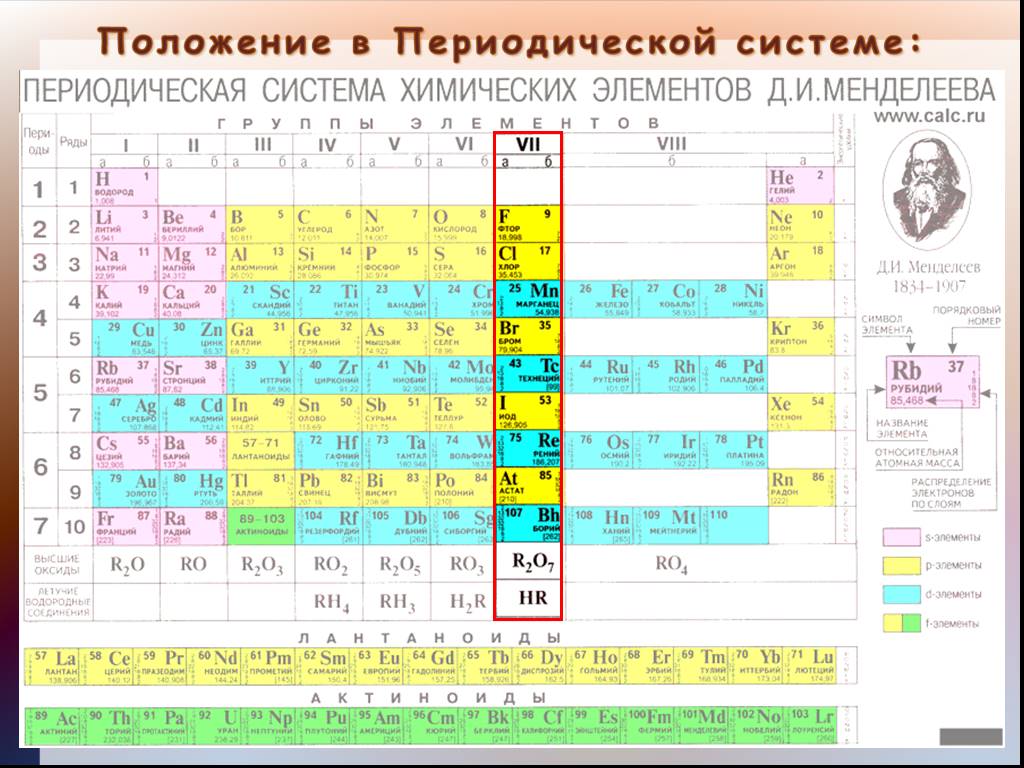
Цели урока:. Образовательные:. Охарактеризовать особенности положения галогенов в Периодической системе Д.И.Менделеева. . Охарактеризовать ...Общая характеристика водорода. Получение водорода
Муниципальное казенное общеобразовательное учреждение. « Суриндинская основная общеобразовательная школа». Урок по химии 8 класс. Общая ...Неметаллы. Общая характеристика неметаллов
. План-конспект урока химии в 9 -м классе с использованием ЦОР по теме: «Неметаллы. Общая характеристика неметаллов». Автор: Кобелева Вера Ивановна. ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Общая характеристика металлов. Металлы главных и побочных подгрупп. Щелочные металлы и их важнейшие соединения
План учебного занятия № 10. Дата Предмет. химия. группа. Ф.И.О. преподавателя. : Кайырбекова И.А. . І. Тема занятия:. Общая характеристика металлов. ...Водород. Его общая характеристика, нахождение в природе и получение
14 октября 2014 года. Открытый урок химии в 9 классе разработан на основе УМК Н.С.Новошинской по технологии критического мышления. Учитель: Королева ...Общая характеристика элементов главной подгруппы VI группы. Кислород и сера.Важнейшие соединения: оксиды, кислоты и их соли
Класс: 10 , учитель: Султанова Е.А. СШ № 17 , г. Балхаш, химия. Тип урока:. комбинированный,. язык обучения. : русский. Оборудование:. флипчарт, ...Общая характеристика предельных углеводородов
Министерство образования Республики Карелия. ГАПОУ РК «Сортавальский колледж». МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА. Общая характеристика ...Общая характеристика элементов 1 группы, главной подгруппы
№. п/п. . Структурные элементы. . . . . Дата. . . 08.10.2014г. . . . Класс. . 9. . . . . Тема урока. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 января 2019
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию