Презентация "Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс" по химии – проект, доклад
Презентацию на тему "Химические свойства металлов. Электрохимический ряд напряжения металлов. 11-й класс" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 18 слайд(ов).
Слайды презентации
Список похожих презентаций
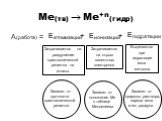
"Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
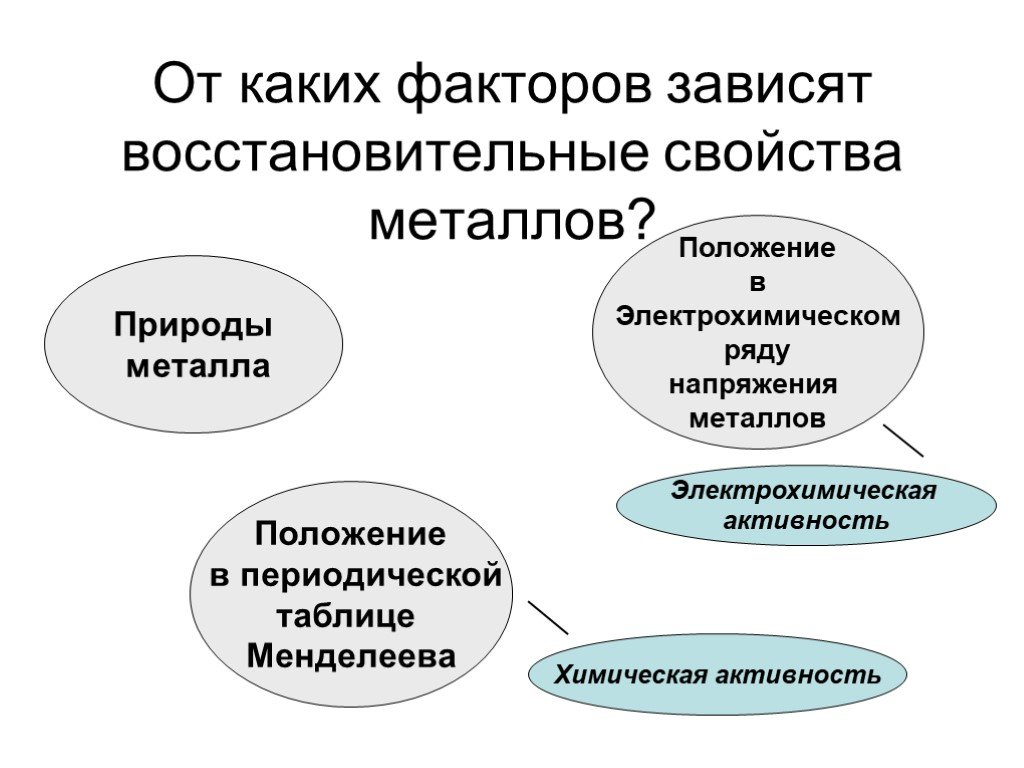
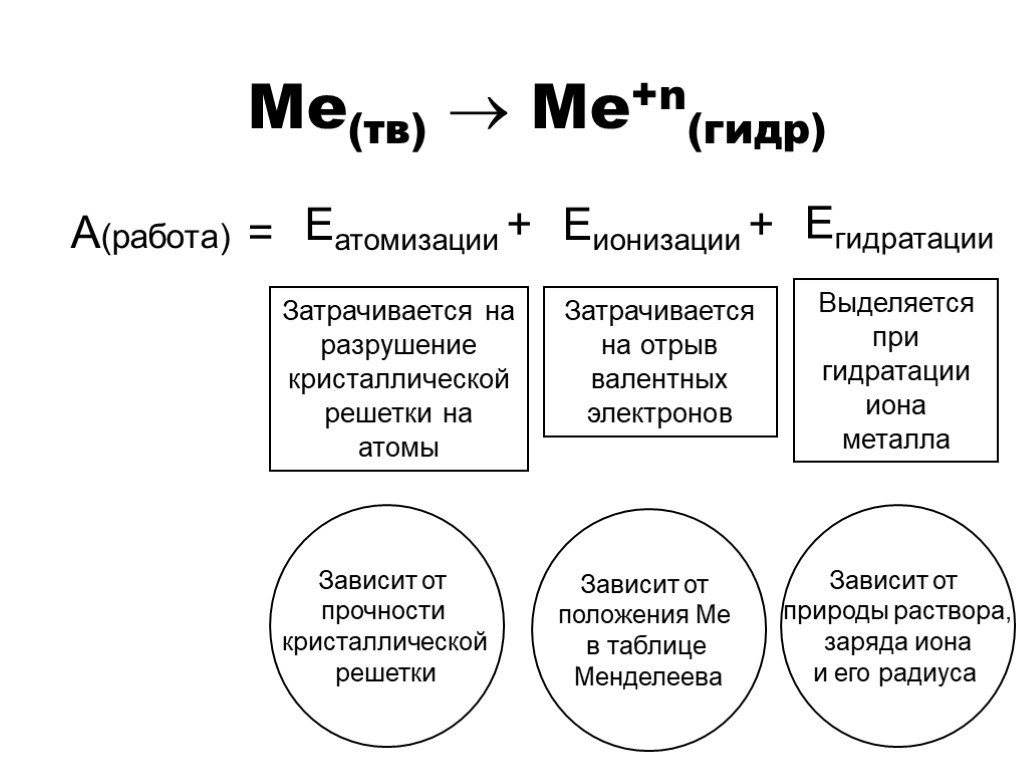
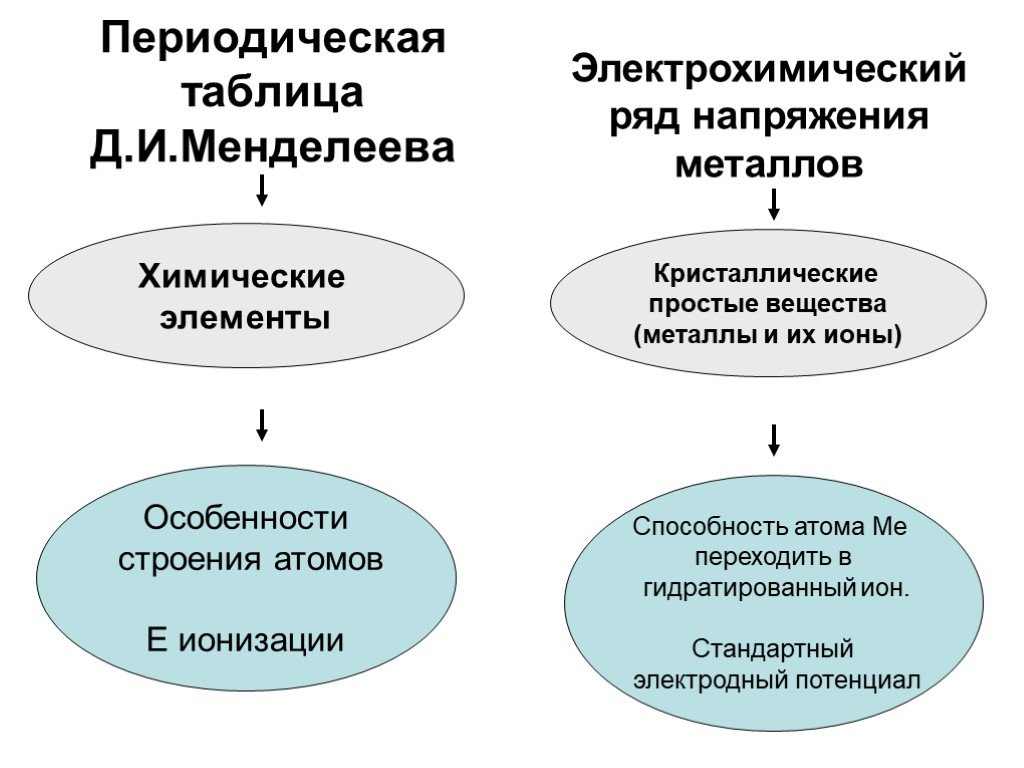
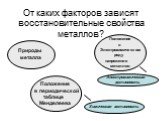
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Металлы. Химические и физические свойства металлов
Физические свойства металлов. Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они ...Металы. Общая характеристика металлов. Физические свойства и применение металлов
Цели урока: повторить и обобщить сведения о металлической химической связи и кристаллической металлической решетке. Изучить общие физические свойства ...Общие свойства металлов
Цель: обобщить знания учащихся об основных свойствах элементов-металлов и образуемых ими простых и сложных веществ. Задачи: Развитие умения записывать ...Металлы, свойства металлов
Металлы – химические элементы , образующие в свободном состоянии простые вещества с металлической связью. М.В. Ломоносов - металлы «светлое тело, ...История металлов
Цель:. Рассказать об открытии металлов. Гипотеза:. Возможно открытие металлов никак не повлияло на развитие цивилизаций. Медь. История цивилизаций ...Основания. Химические свойства. Способы получения
Химические свойства. Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы. ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Качественные реакции на ионы металлов
Проблемный вопрос: каким образом можно определить ионы металлов в растворах. Цель работы: научиться определять ионы металлов Задачи: расширить знания ...Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации. 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть ...Основания. Химические свойства оснований
Классификация оснований. Растворимые в воде (щелочи). Нерастворимые в воде. NaOH Ca(OH)2 Al(OH)3 Сu(OH)2. Название оснований. Гидроксид +. Название ...Оксиды, их классификация и свойства
Что такое оксиды? Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород в степени окисления -2. Классификация ...Нахождение металлов и их соединений в природе
«Человек не может обойтись без металлов. Если бы не металлы, человек влачил бы самую жалкую жизнь среди диких зверей» Г. Агрикола XVI век. Альманах ...Общая характеристика металлов главных подгрупп I-III
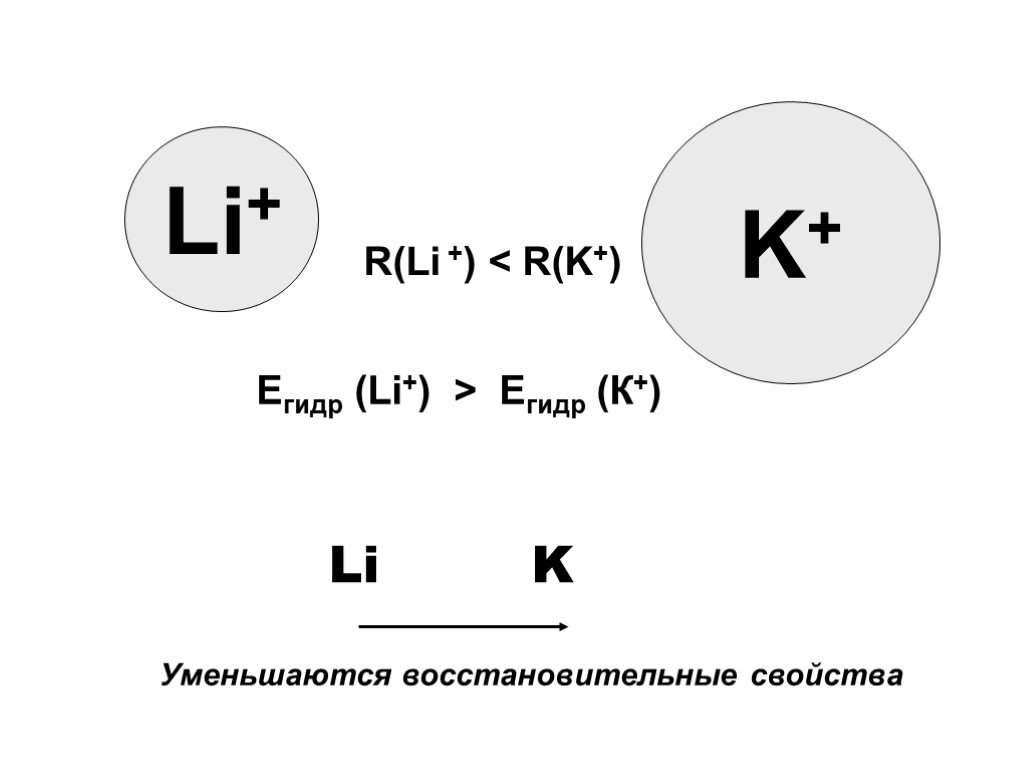
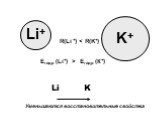
Характеристика металлов главной подгруппы I группы. Щелочны́е мета́ллы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы ...Области применения металлов
Железо. Железо издревле использовалось в качестве лекарства. В папирусах Египта ржавчина предписывалась в качестве мази от облысения. В XVII веке ...Мир металлов
Содержание. Золото. Серебро. Медь. Бронза. Железо. Чугун. Сталь. Золото. Из золота можно изготовить проволоку в тысячу раз более тонкую, чем человеческий ...Нахождение металлов в природе
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для ...Алюминий – металл ХХ века. Физические и химические свойства
Алюминий. Алюминий вы найдете В ложке, кружке, самолете. Нужен легонький металл, Чтобы самолет летал! Самолет парит легко, Небосвод пронзает синий, ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Конспекты
Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Кислоты. Классификация. Химические свойства с точки зрения электролитической диссоциации
8 класс. . . Урок-игра «Химическое лукошко» по теме «Урок-упражнение по теме «Кислоты. Классификация. Химические свойства с точки зрения электролитической ...Общие свойства металлов
Муниципальное бюджетное образовательное учреждение. «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 3». Конспект урока по химии в 9 классе. «Общие ...Общие свойства металлов
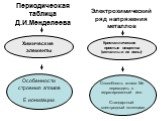
Общие свойства металлов. Цели урока:. . Образовательная: Исходя, из нахождения в таблице Д.И. Менделеева рассмотреть строение атома, выяснить тип ...Основания, их классификация и химические свойства в свете теории электролитической диссоциации
ТЕМА УРОКА :. Основания, их классификация и химические свойства в. . свете теории электролитической диссоциации. . . II. слайд:. ЦЕЛЬ УРОКА:. ...Получение и свойства соединений металлов
Муниципальное общеобразовательное учреждение лицей. Технологическая карта урока по химии. Практическая работа. «Получение и свойства соединений ...Практическая работа № 1 Получение и свойства соединений металлов
Лысоконь Ирина Алексеевна. МБОУ СОШ № 2 ст. Архонская Пригородного района РСО-Алания. Учитель химии. Тема урока: Практическая работа № 1 Получение ...Кислоты: классификация, номенклатура, физические и химические свойства
Химия 8 класс. Тема урока:. . Кислоты: классификация, номенклатура, физические и химические свойства. «Всё познаётся в сравнении». Цель урока:. ...Кислоты, их классификация и свойства
. МАОУ «Голышмановская средняя общеобразовательная школа №2». Урок химии в 8 классе. Кислоты, их классификация и свойства. ...Роль металлов и их соединений в природной среде и в живых организмах
Дата:. 26.02. 15 г. Предмет:. химия, 8 класс. Тема: «Роль металлов и их соединений в природной среде и в живых организмах (биогенны и загрязнители). ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 декабря 2018
Категория:Химия
Классы:
Содержит:18 слайд(ов)
Поделись с друзьями:
Скачать презентацию