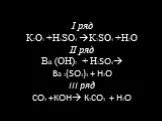Презентация "Основные типы химической связи" по химии – проект, доклад
Презентацию на тему "Основные типы химической связи" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 27 слайд(ов).
Слайды презентации
Список похожих презентаций
Виды химической связи и типы кристаллических решеток
Результат теста. Верно: 15 Ошибки: 0 Отметка: 5. Время: 0 мин. 47 сек. ещё. Вопрос 1 В). H2S А). Сl2 Б). NaBr Г). MgCl2. Задание теста с единственным ...Типы химической связи
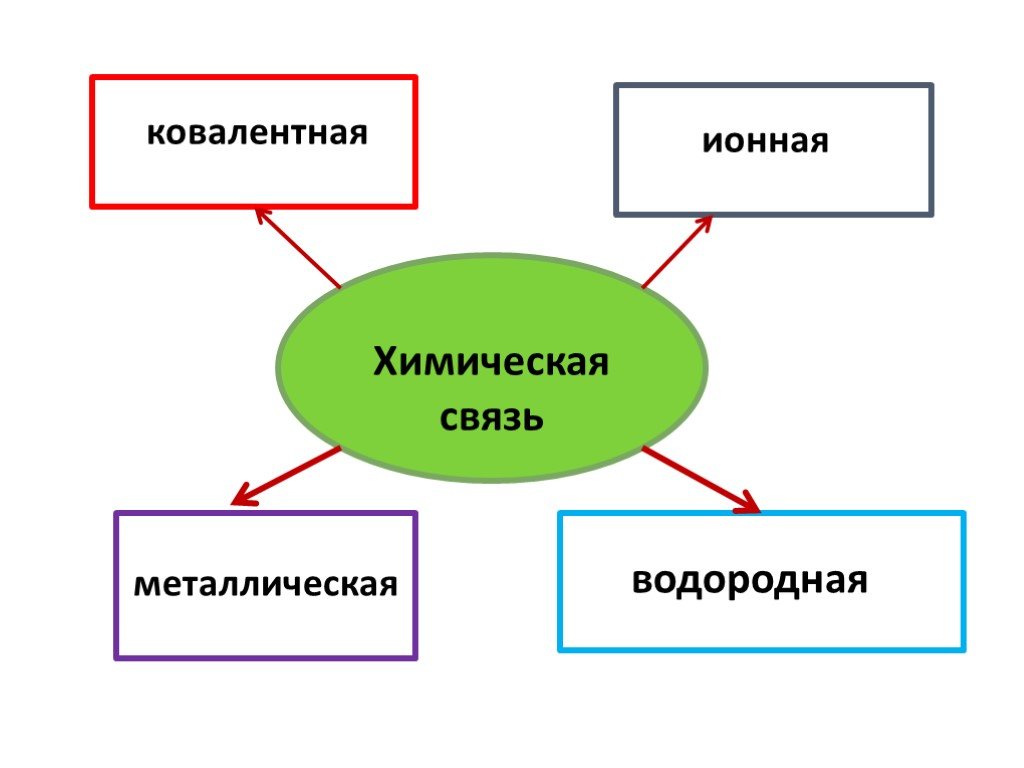
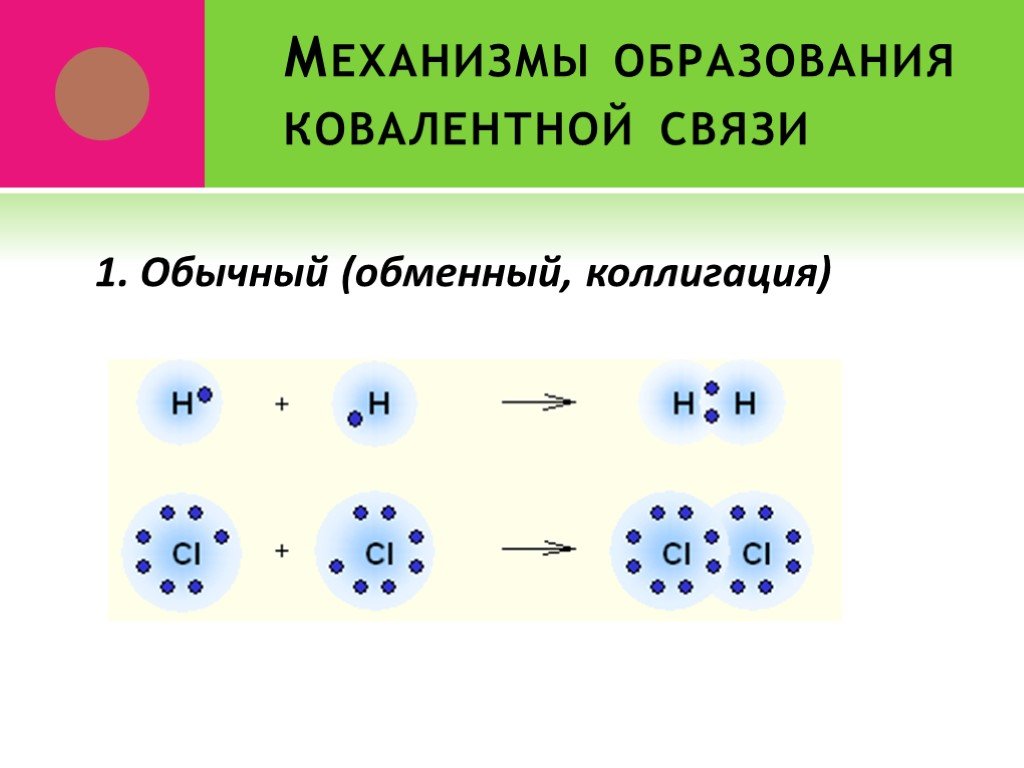
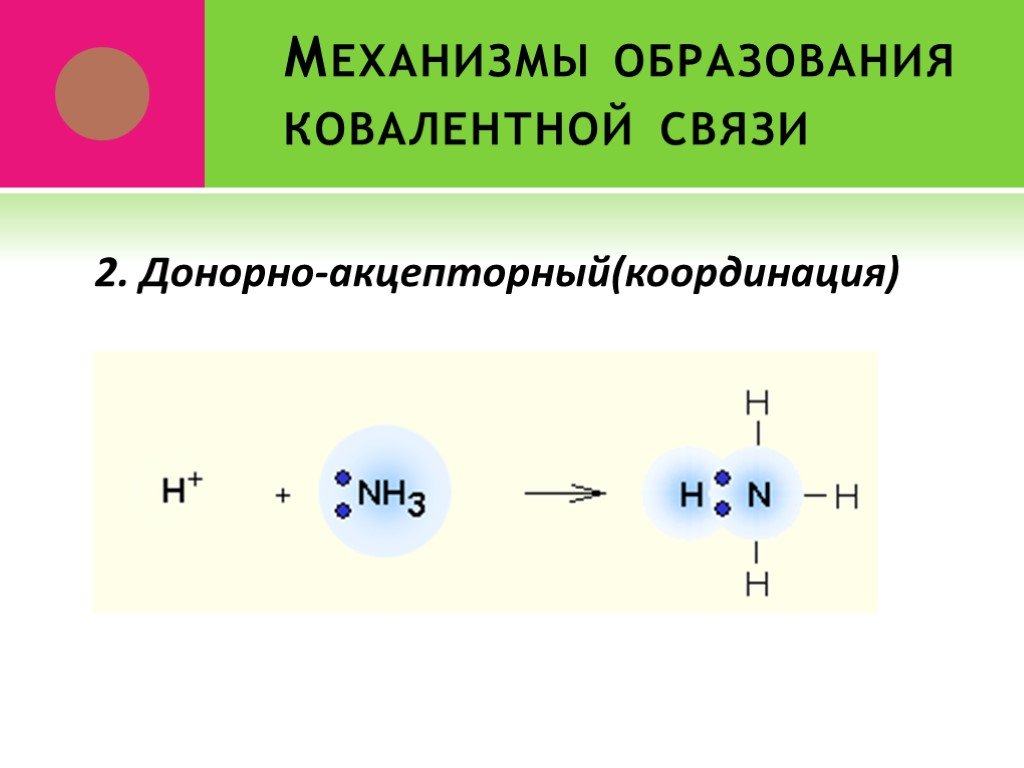
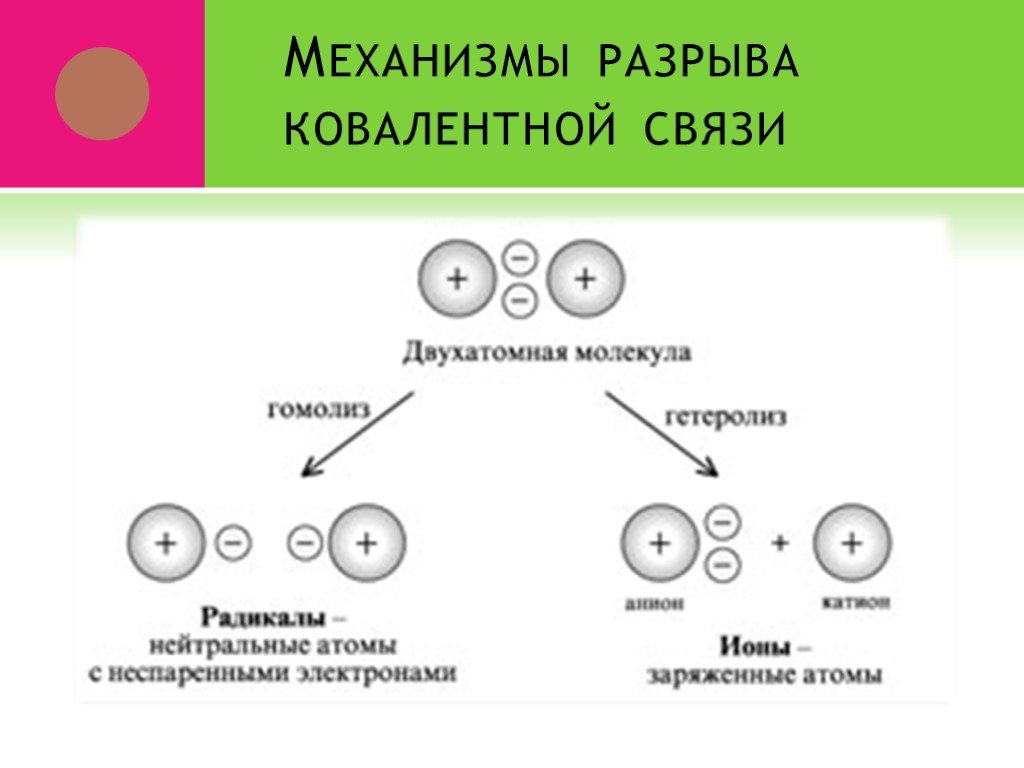
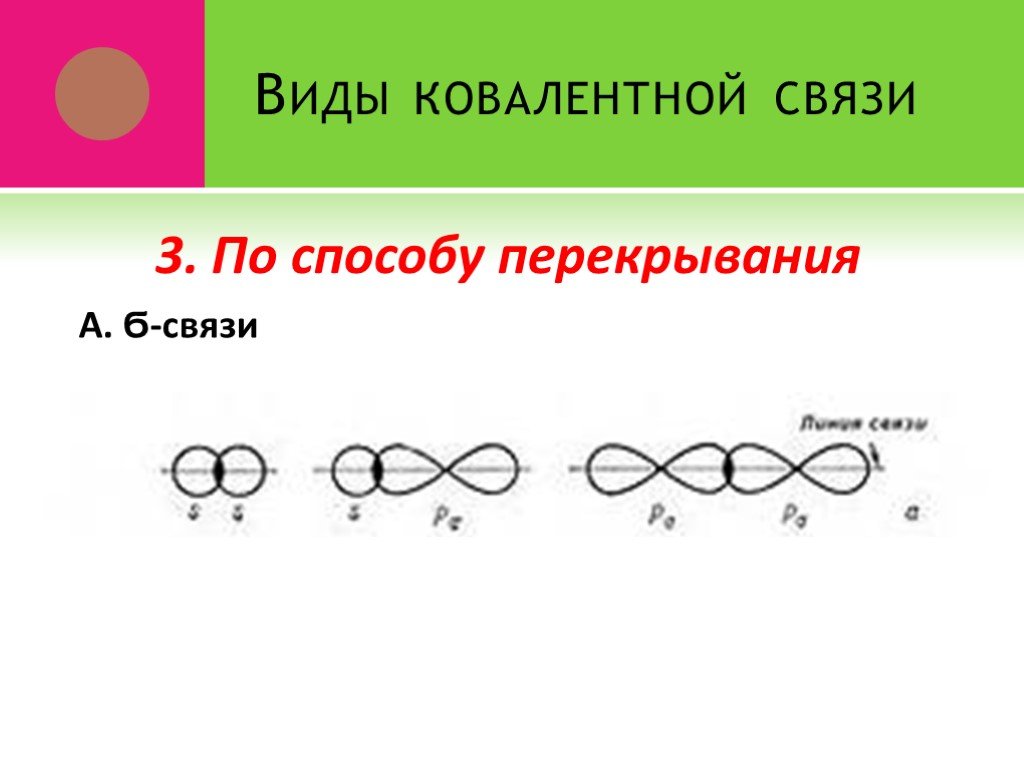
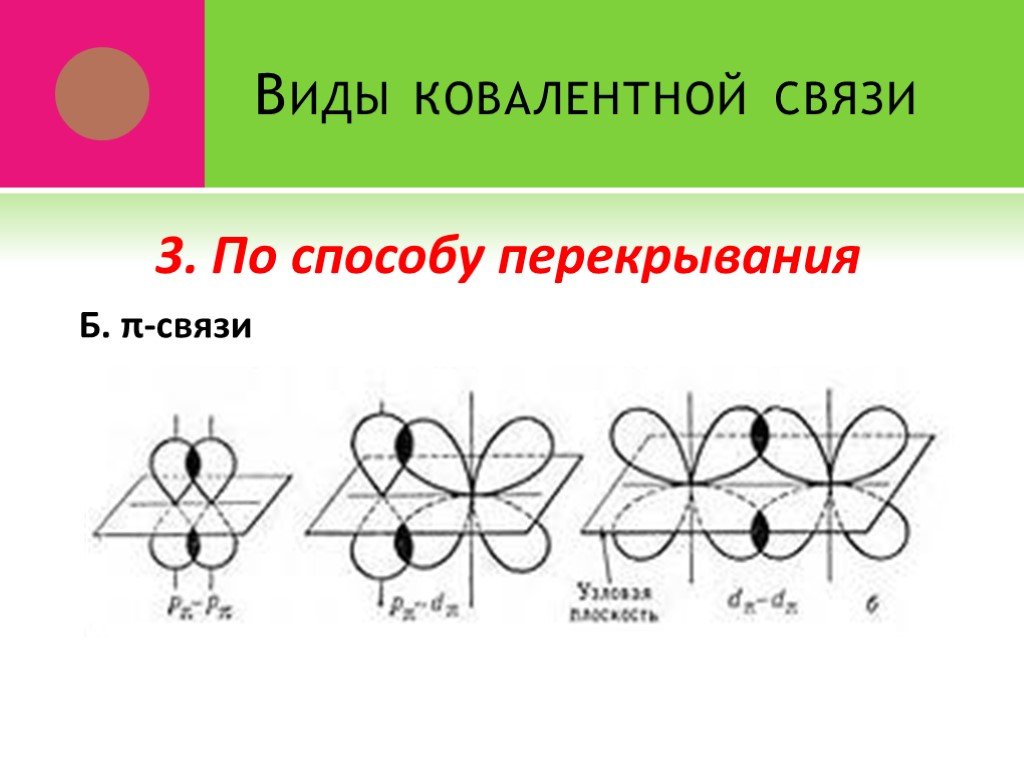
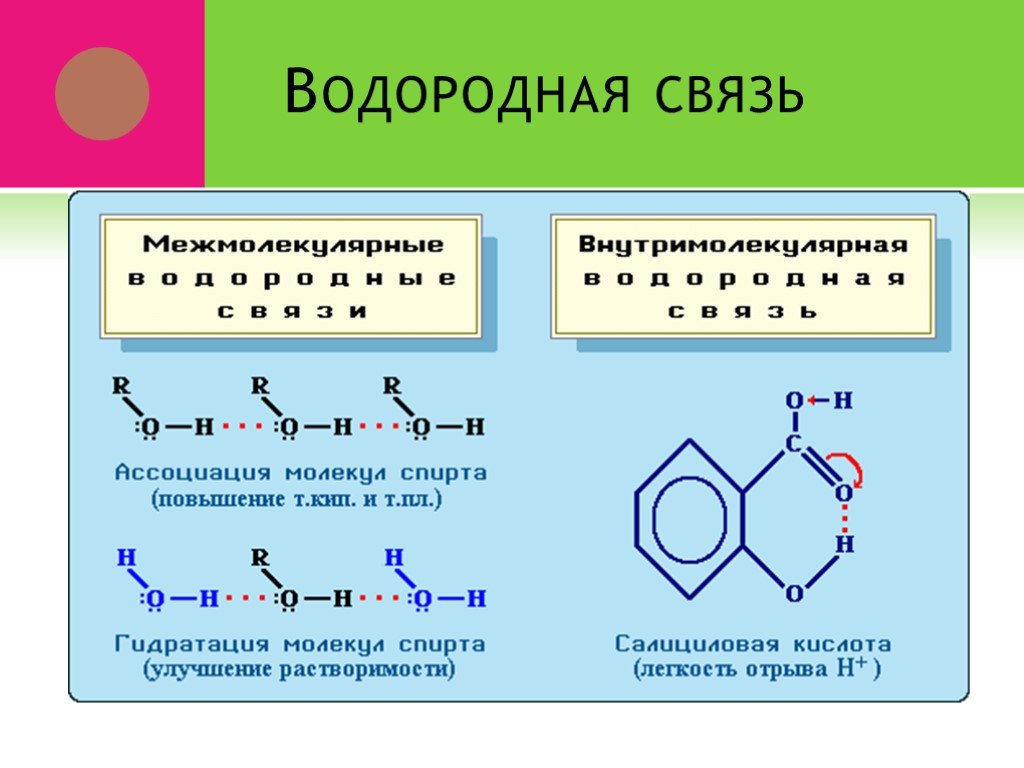
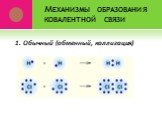
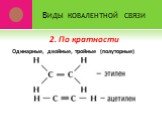
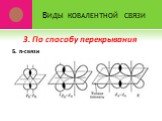
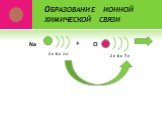
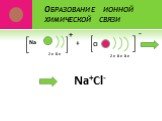
Ковалентная связь. 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между двумя атомами. Правило октета. Валентный ...Виды химической связи в неорганических веществах
Знать. определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Уметь. определять вид связи по формуле ...Виды химической связи
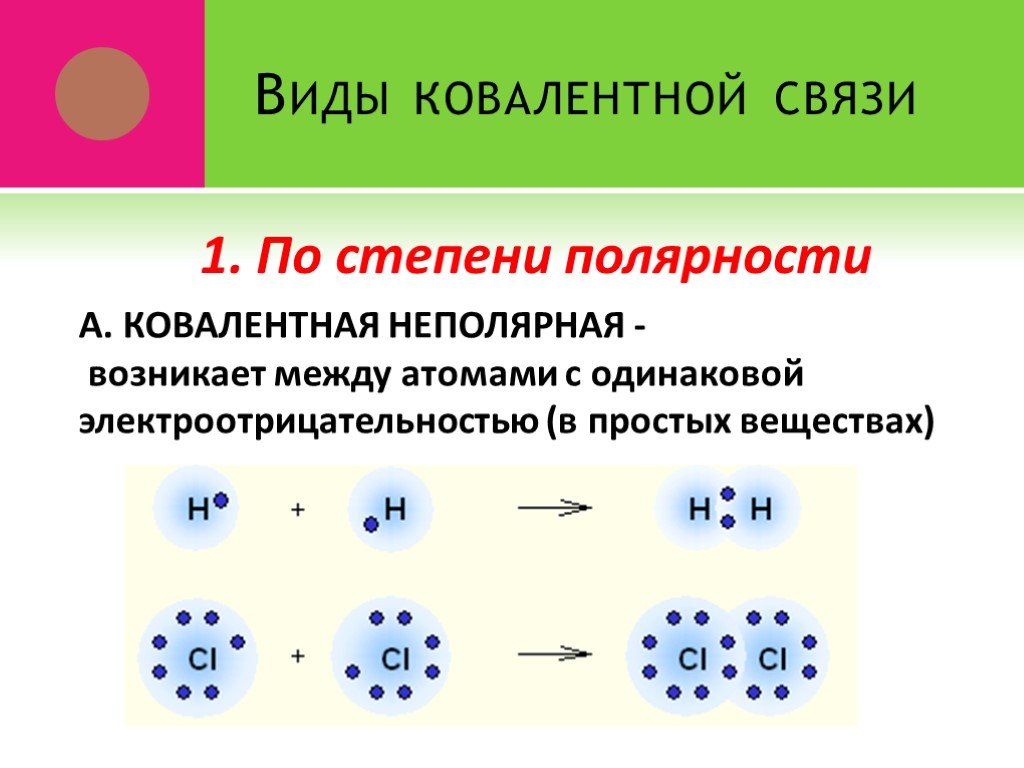
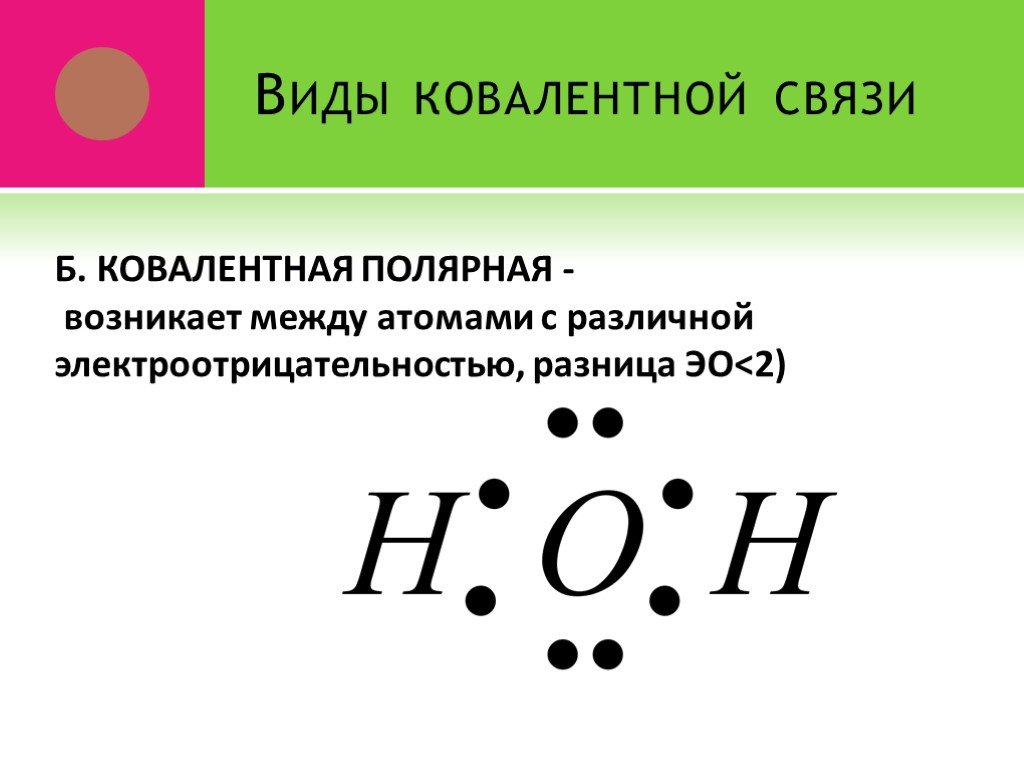
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. Охарактеризуйте виды химических связей. К.Н.С. - это … К.П.С. - это … И.С. - это …. I.Выпишите формулы веществ: 1.с К.Н.С. ...Виды химической связи
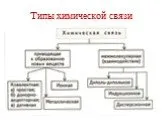
Виды химической связи. Цель урока:. Повторить теоретический материал по данному вопросу. Проделать упражнения из заданий ЕГЭ. Химическая связь – это ...Виды химической связи
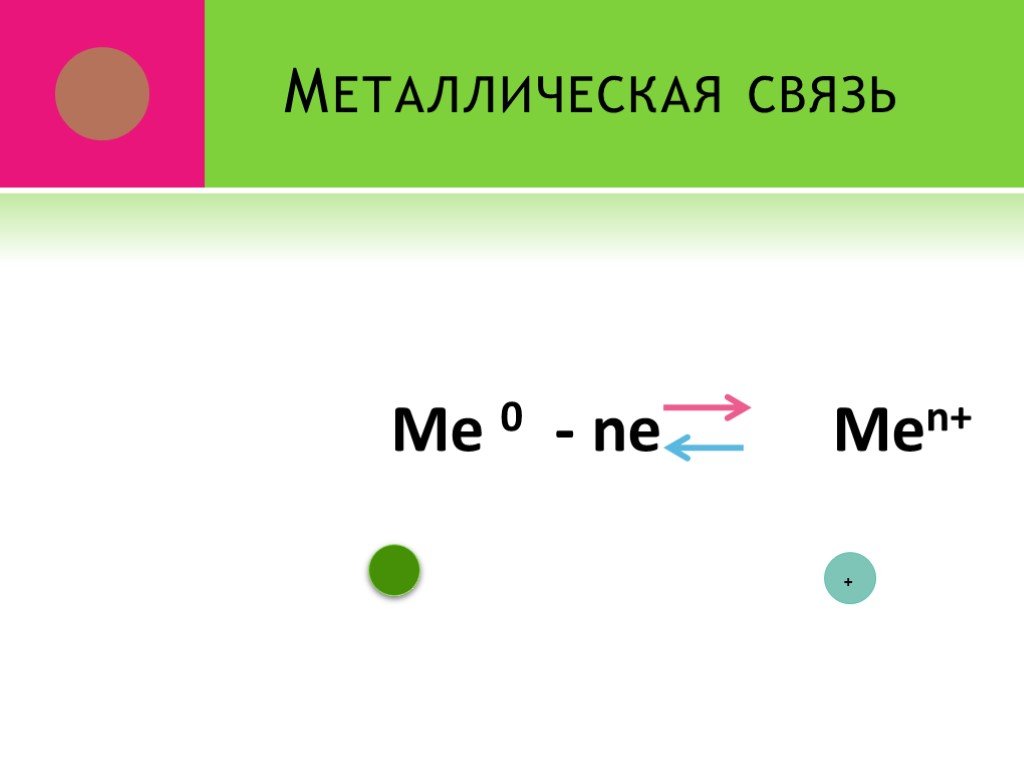
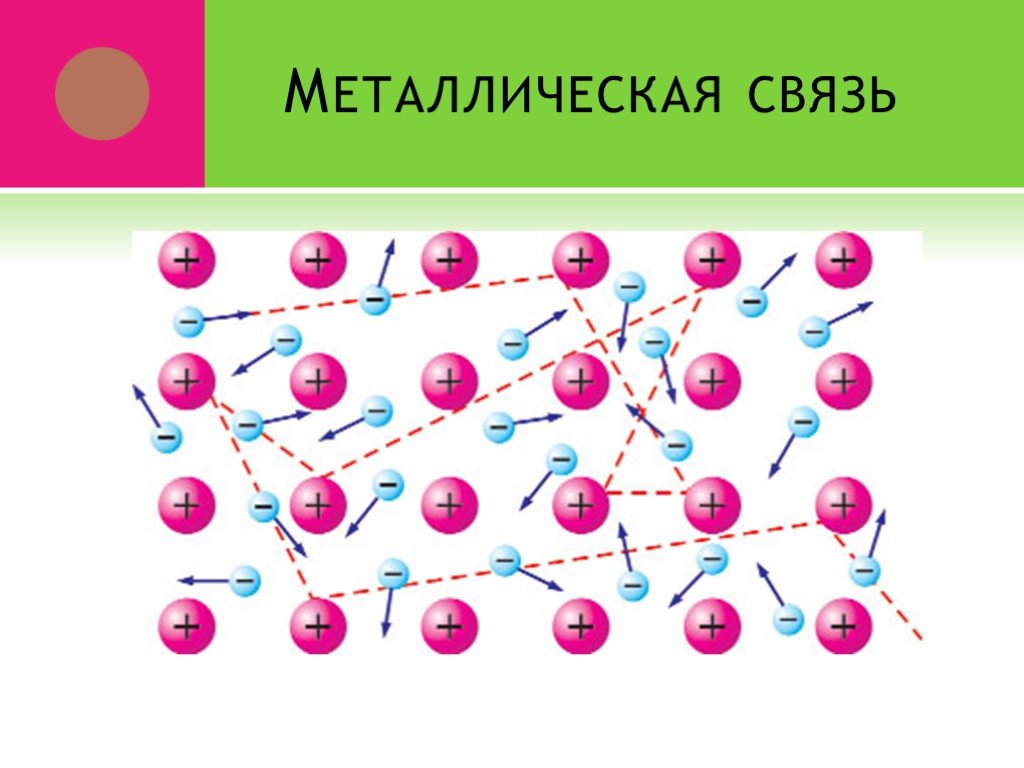
Связь между ионами металла и блуждающими электронами называется:. КОВАЛЕНТНОЙ ПОЛЯРНОЙ. ИОННОЙ МЕТАЛЛИЧЕСКОЙ. КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ. 2. Химическая ...Виды химической связи
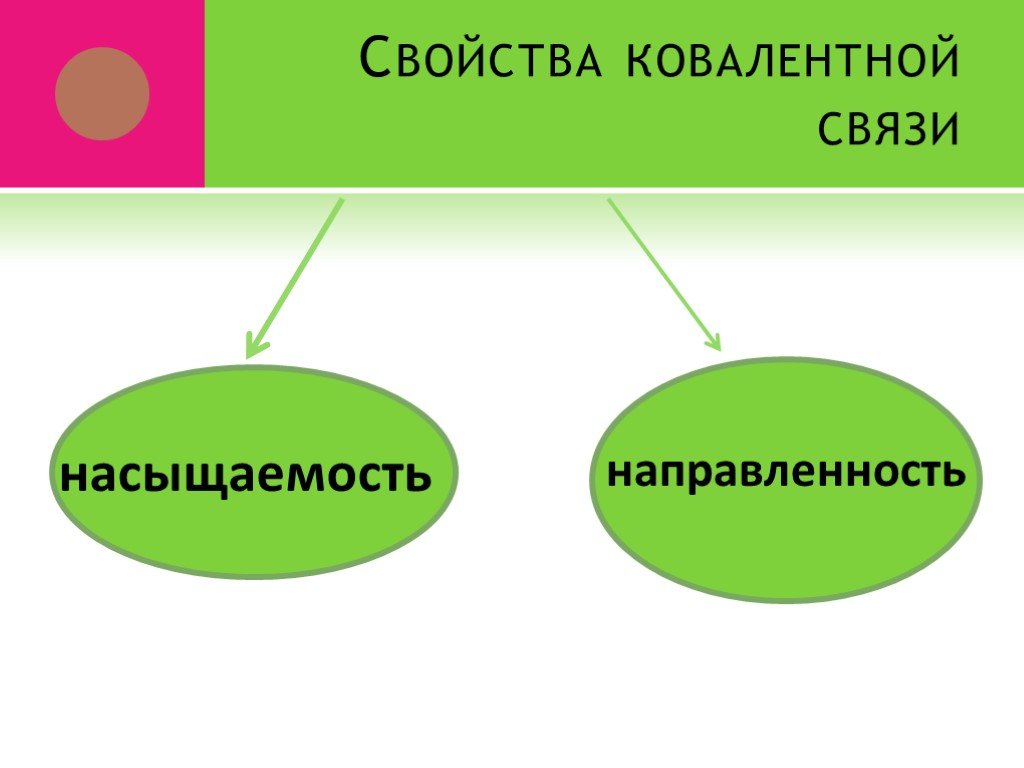
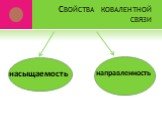
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. ковалентная ионная металлическая неполярная полярная. Al Na Ba Fe Mg. Металлическая – в простых веществах-металлах. Ковалентная ...Свойства химической связи
Введение. Химическая связь – силы, обуславливающие устойчивое существование двух и многоатомных соединений. В результате образования химической связи: ...Понятие о валентности и химической связи. Ковалентная химическая связь
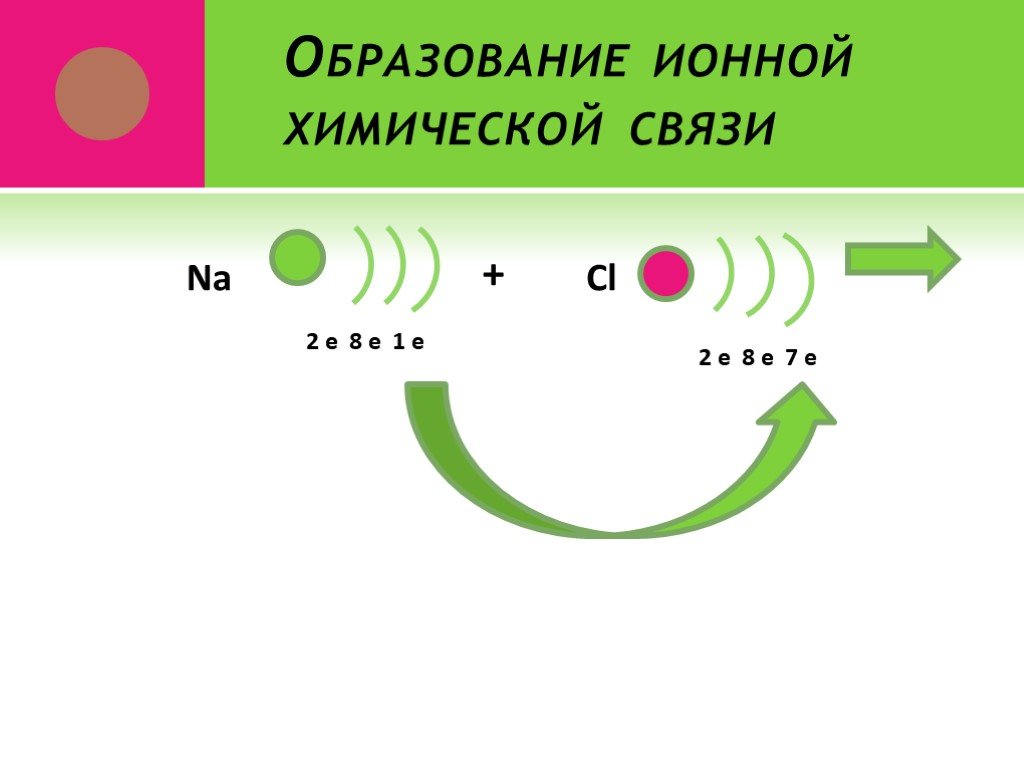
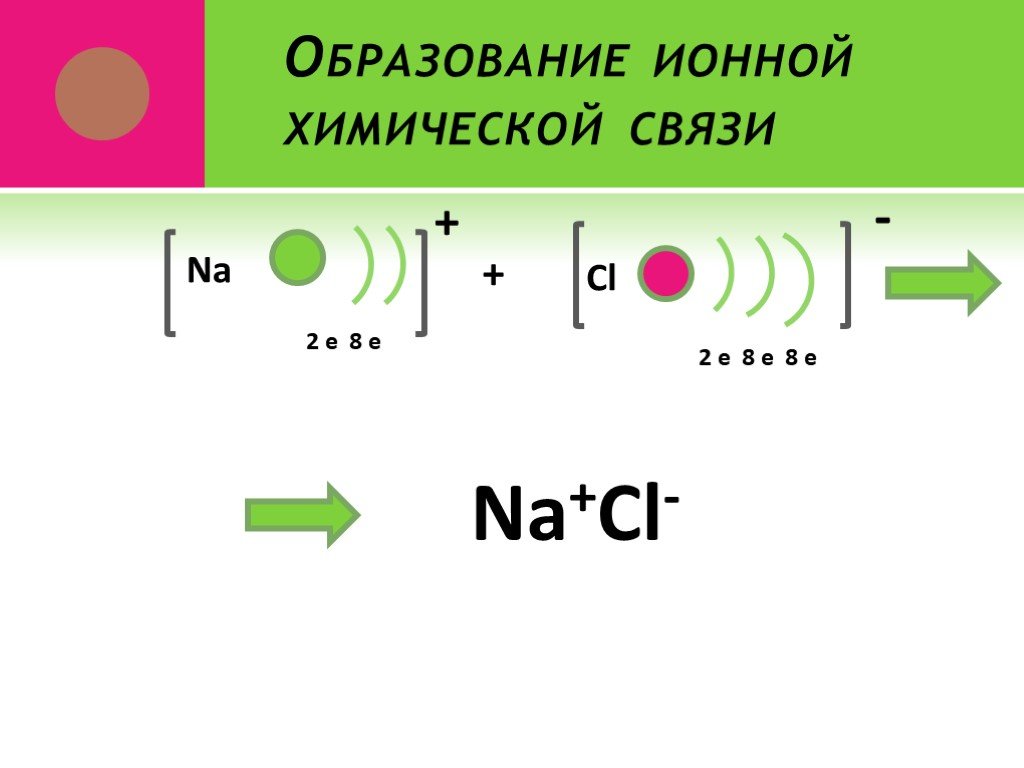
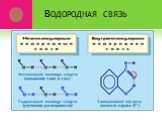
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы. Способность атома элемента образовывать ...электронная природа химической связи
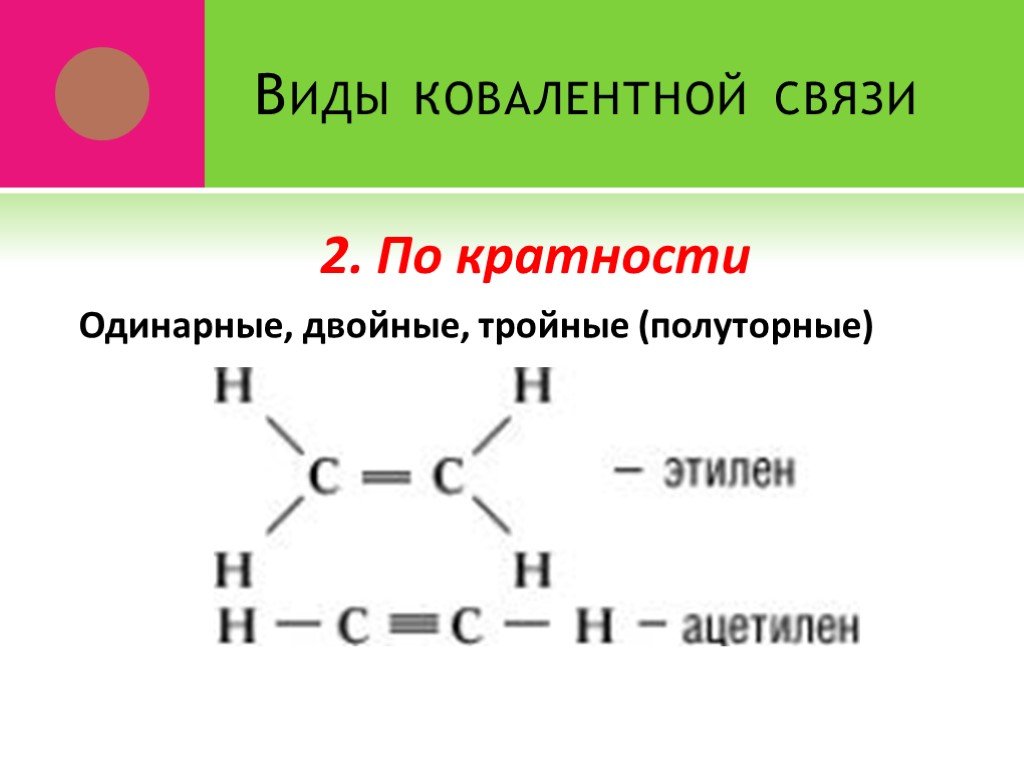
*. Урок 3. Органические вещества обладают молекулярным строением. Органическим соединениям свойственны ковалентные связи. Ковалентная связь характеризуется: ...Основные природные источники углеводородов
Нефть Природный газ. Попутный нефтяной газ. Каменный уголь. Добыча и потребление нефти - важный показатель промышленного развития государств; организация ...Основные понятия химии. Понятия и определения
Химический элемент – вид атомов, характеризующихся определенным зарядом ядра. Моль – количество вещества, которое содержит столько же структурных ...Основные понятия и законы химии
стратегия успеха. посещение, работа на лабораторных занятиях и своевременное оформление отчетов. посещение, восприятие и записывание материала лекций. ...Основные положения МКТ
1. Все вещества состоят из молекул…. Все вещества состоят из молекул, разделенных промежутками (дискретное строение вещества). Опыты и явления. Расширение ...Генетические связи между важнейшими классами неорганических соединений
Тема. Генетические связи между важнейшими классами неорганических соединений. А. С. Макаренко: «Теория и практика неотъемлемы». . SO2 HCl H3PO4 H2O ...Основные теории химии
Тема : « Сравнение двух ведущих теорий химии : Периодического закона Д.И. Менделеева и теории химического строения А.М. Бутлерова». Цели урока. 1. ...Основные законы химии
Закон сохранения массы Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции. Периодический закон Свойства простых веществ, а также ...Основные законы науки химии
Химия – наука о веществах, их строении, свойствах и превращениях. Химические свойства веществ – это способность данного вещества превращаться в другие ...Основные даты жизни Дмитрия Ивановича Менделеева
27 января \8 февраля\ 1834 г. - рождение Дмитрия Ивановича Менделеева 1841 г. - поступление в Тобольскую гимназию 1847 г.- смерть отца Д.И. Менделеева ...Органическая химия. Основные положения. История развития науки
Цель работы:. Получить основную информацию об органической химии и истории её развития. Органическая химия. Органическая химия — раздел химии, изучающий ...Конспекты
Типы химической связи
Составила учитель химии и биологии Хамзина Гульжан Минуллаевна. Р.Казахстан. Маржанбулакская средняя школа. Актюбинской области. . . Самостоятельная ...Виды химической связи
План-конспект урока по учебнику «ХИМИЯ 8 КЛАСС ». . Тема:. «Виды химической связи». (Технологическая карта изучения темы). Тема. «Виды ...Обобщение знаний о видах химической связи
МОУ «СОШ с. Запрудное Питерского района Саратовской области». . Урок химии – 2014 г. Урок химии в 8 классе,. по теме:. . «Обобщение знаний ...Виды химической связи
. . Учитель химии. . Ушакова Галина Григорьевна. Урок – игра. «Покорение вершины». . . . Цел урока. . Обобщить, систематизировать ...Электроотрицательность. Виды химической связи
Тема урока: «Электроотрицательность. Виды химической связи». Цели урока. :. раскрыть сущность образования химической связи между атомами, начать ...Виды химической связи
Технологическая карта урока по химии в соответствии с требованиями ФГОС. План-конспект урока по учебнику «ХИМИЯ 8 КЛАСС ». . . Тема:. «Виды ...Виды химической связи
Урок химии в 8 классе. Тема. «Виды химической связи». . Цель. . . Обобщить знания по теме «Виды химической связи». . . . . ...Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций
Дата ____________ Класс _____________. Тема: Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций. ...Основные типы химических реакций
Муниципальное общеобразовательное учреждение. лицей № 9. имени заслуженного учителя школы Российской Федерации А.Н.Неверова Дзержинского района ...Основные типы химических реакций
8 класс «Основные типы химических реакций». . Образовательная:. Закрепить и расширить знания учащихся о химических реакциях, их признаках и условиях ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:27 слайд(ов)
Поделись с друзьями:
Скачать презентацию