Презентация "Свойства химической связи" по химии – проект, доклад
Презентацию на тему "Свойства химической связи" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 28 слайд(ов).
Слайды презентации
Список похожих презентаций
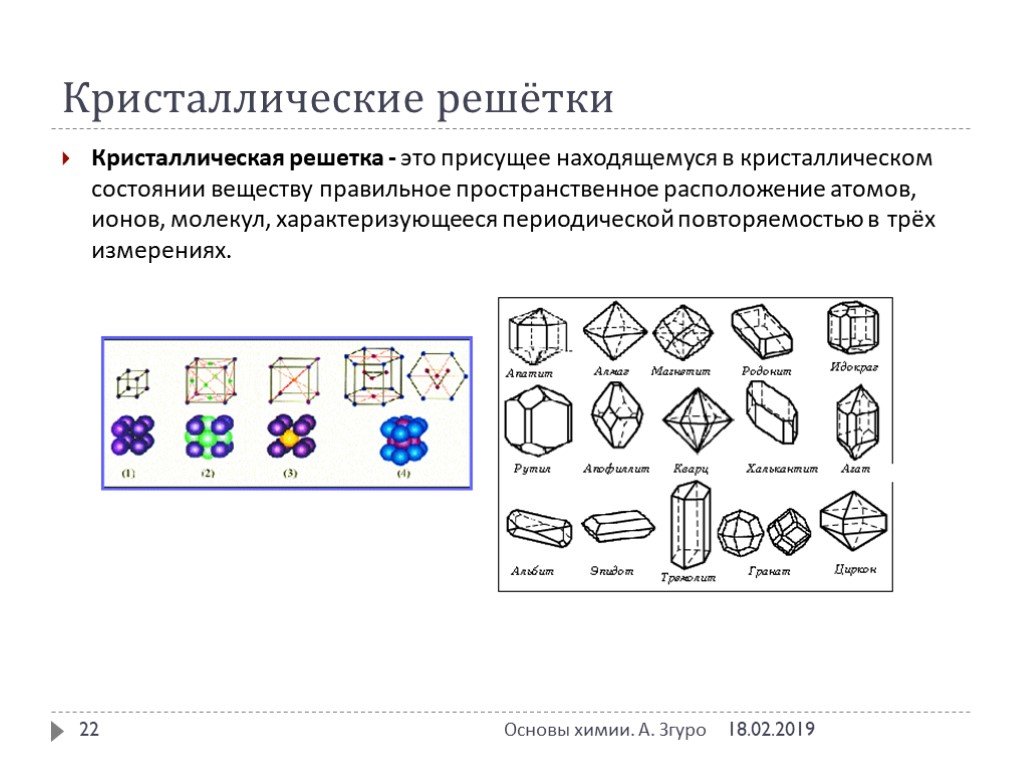
Основные типы химической связи
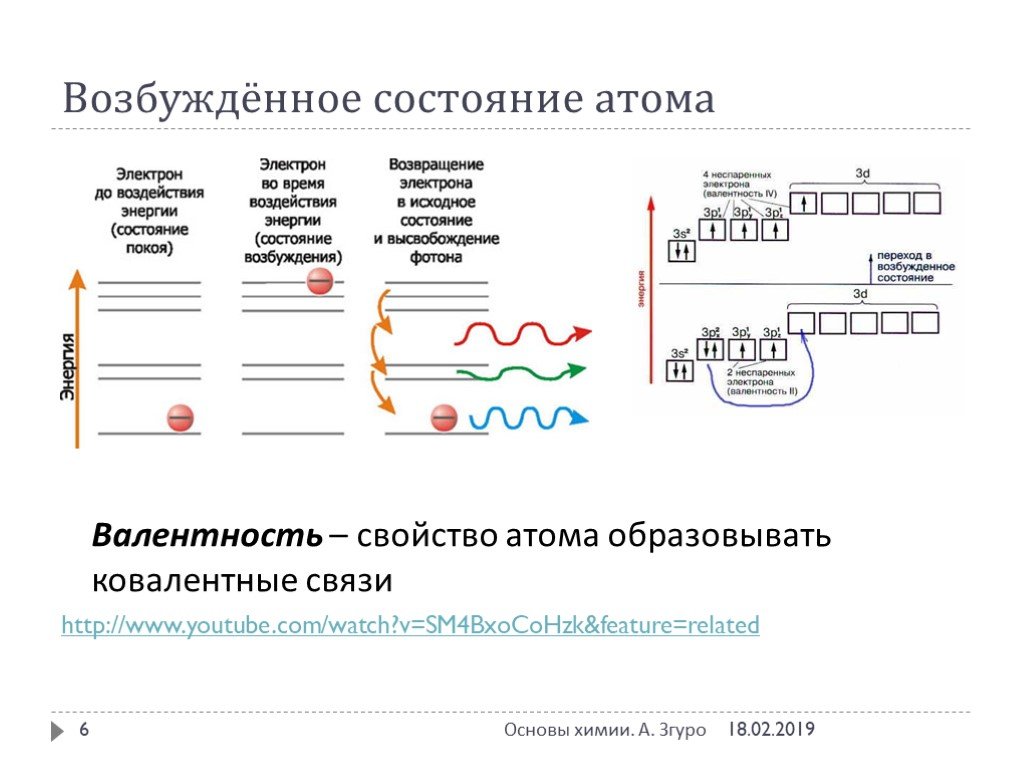
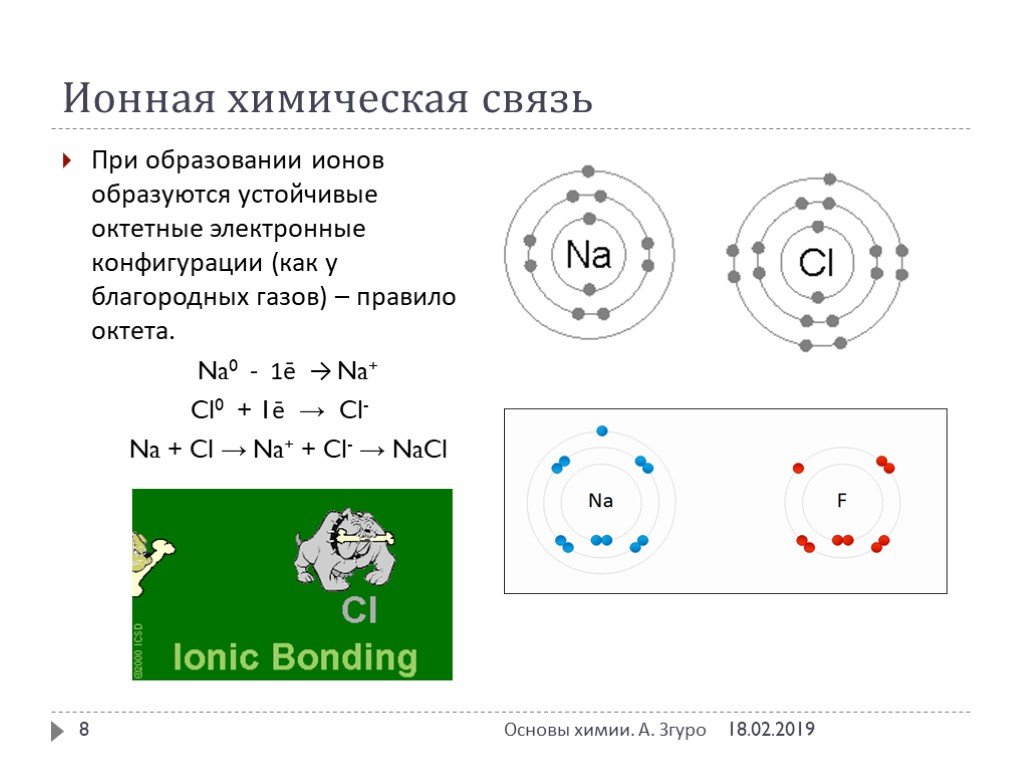
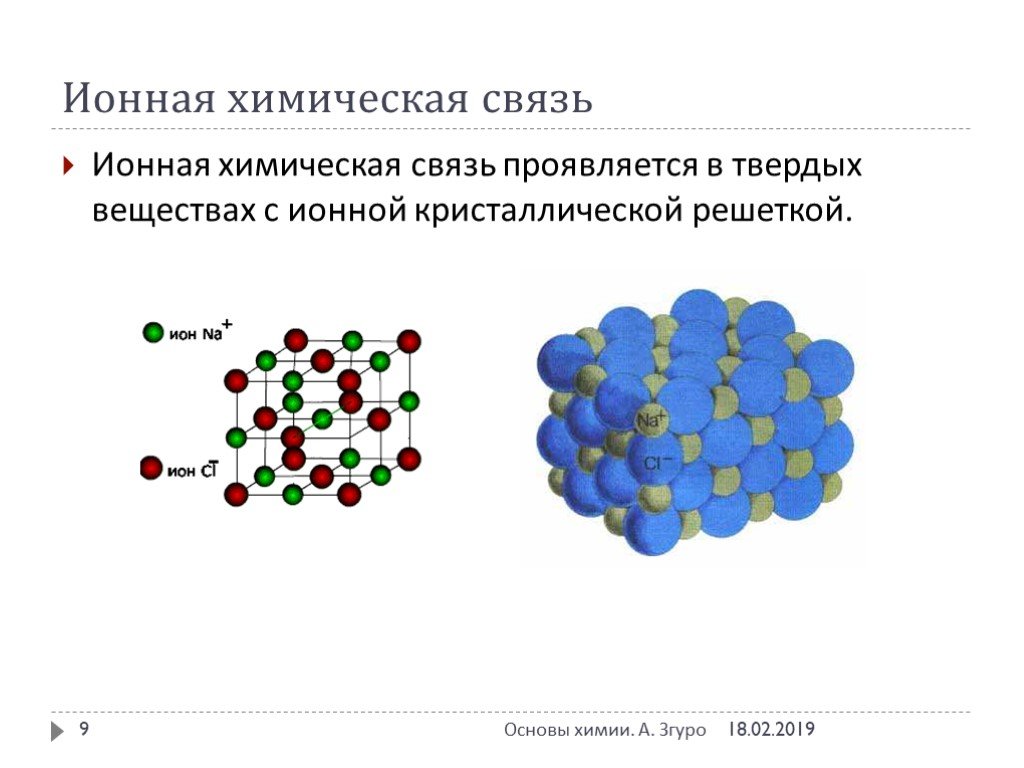
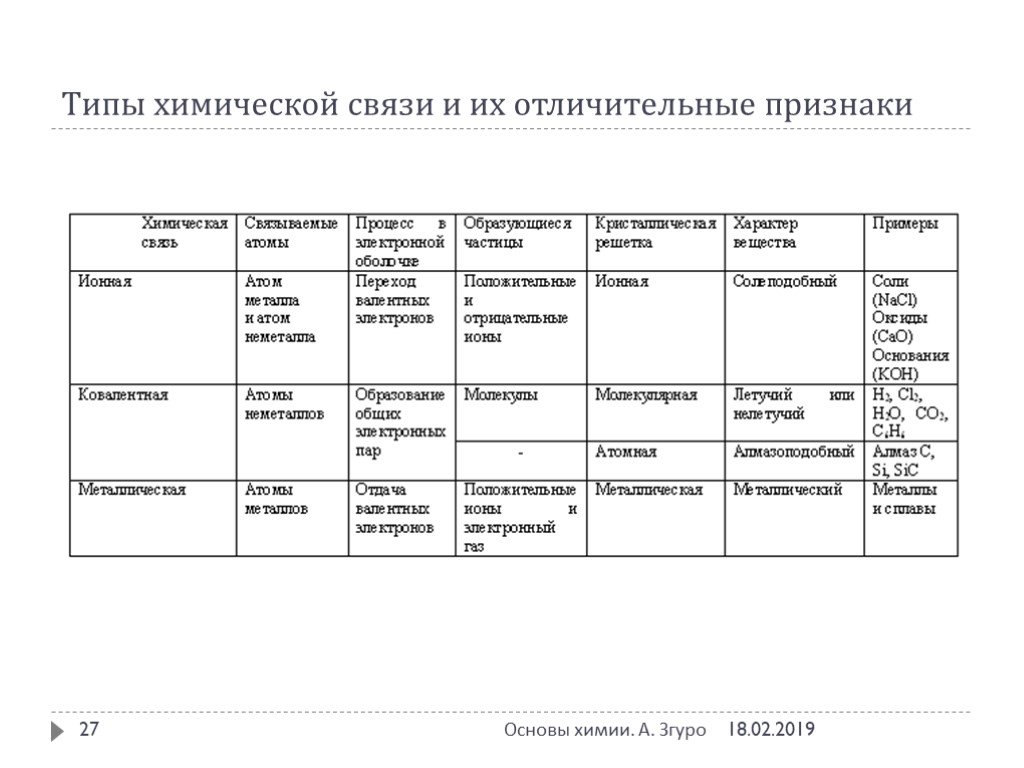
Химическая связь – совокупность сил, обуславливающих взаимодействие атомов в химических соединениях. Химическая связь ковалентная ионная металлическая ...Понятие о валентности и химической связи. Ковалентная химическая связь
Химическая связь – это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы. Способность атома элемента образовывать ...Виды химической связи в неорганических веществах
Знать. определение понятия химическая связь, виды химической связи, механизмы образования каждого вида связи. Уметь. определять вид связи по формуле ...Типы химической связи
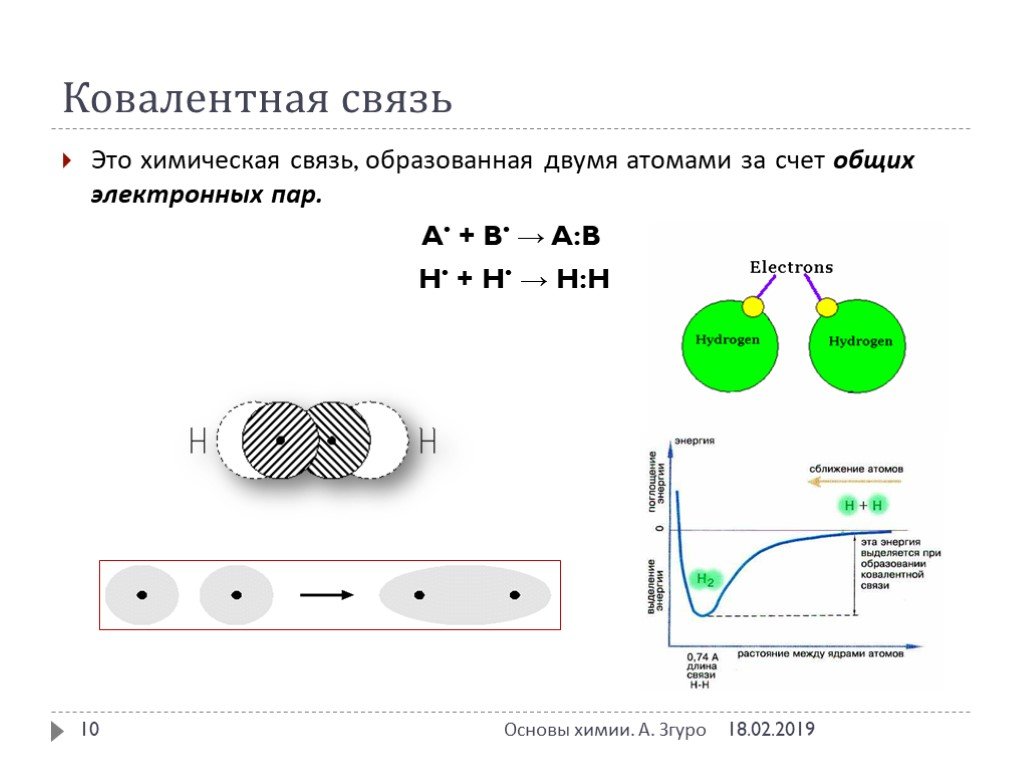
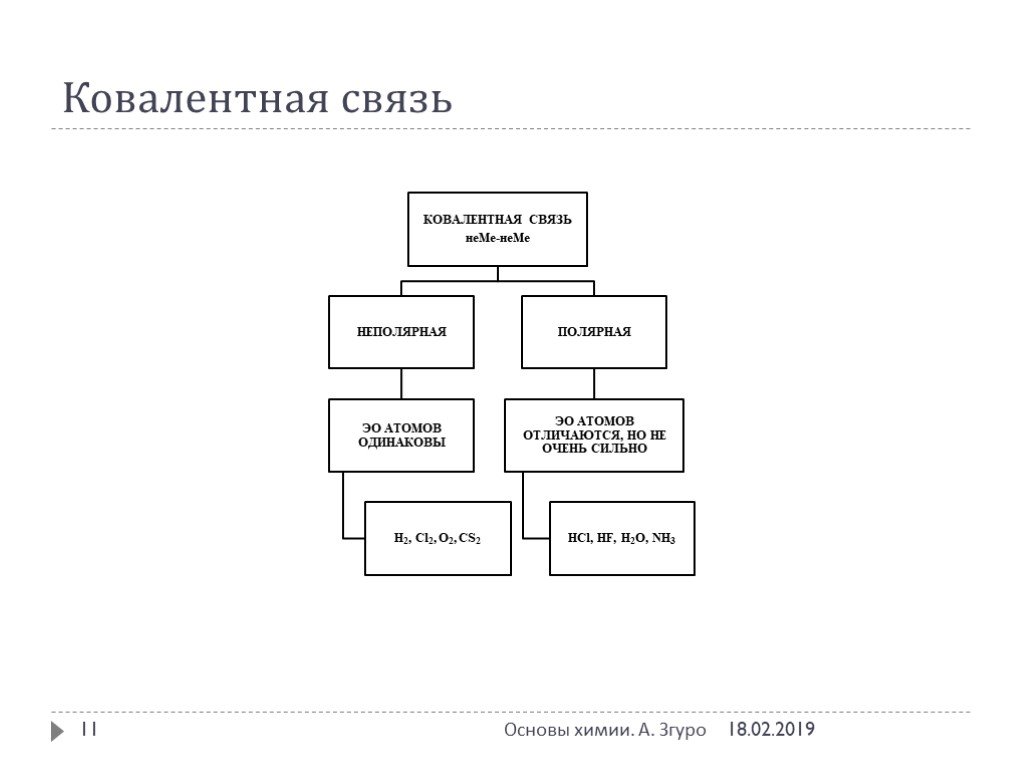
Ковалентная связь. 1916 г. – теория Льюиса Химическая связь – результат образования общей электронной пары между двумя атомами. Правило октета. Валентный ...Виды химической связи и типы кристаллических решеток
Результат теста. Верно: 15 Ошибки: 0 Отметка: 5. Время: 0 мин. 47 сек. ещё. Вопрос 1 В). H2S А). Сl2 Б). NaBr Г). MgCl2. Задание теста с единственным ...Виды химической связи
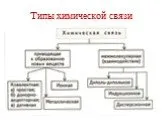
Виды химической связи. Цель урока:. Повторить теоретический материал по данному вопросу. Проделать упражнения из заданий ЕГЭ. Химическая связь – это ...Виды химической связи
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. Охарактеризуйте виды химических связей. К.Н.С. - это … К.П.С. - это … И.С. - это …. I.Выпишите формулы веществ: 1.с К.Н.С. ...Виды химической связи
Связь между ионами металла и блуждающими электронами называется:. КОВАЛЕНТНОЙ ПОЛЯРНОЙ. ИОННОЙ МЕТАЛЛИЧЕСКОЙ. КОВАЛЕНТНОЙ НЕПОЛЯРНОЙ. 2. Химическая ...Виды химической связи
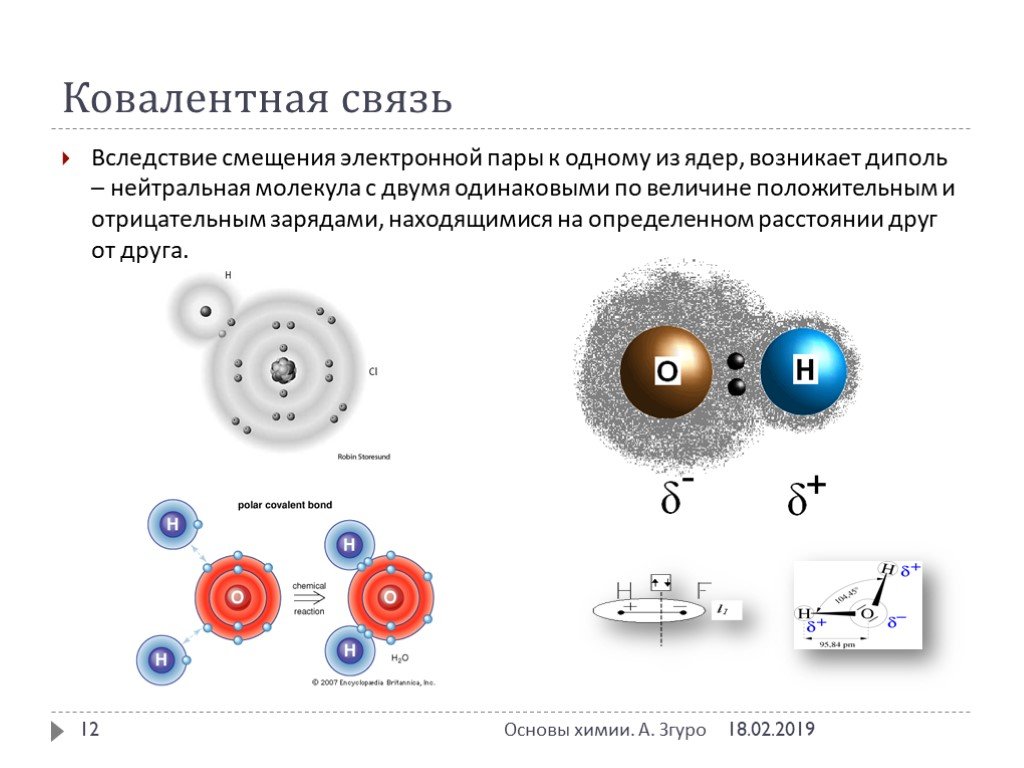
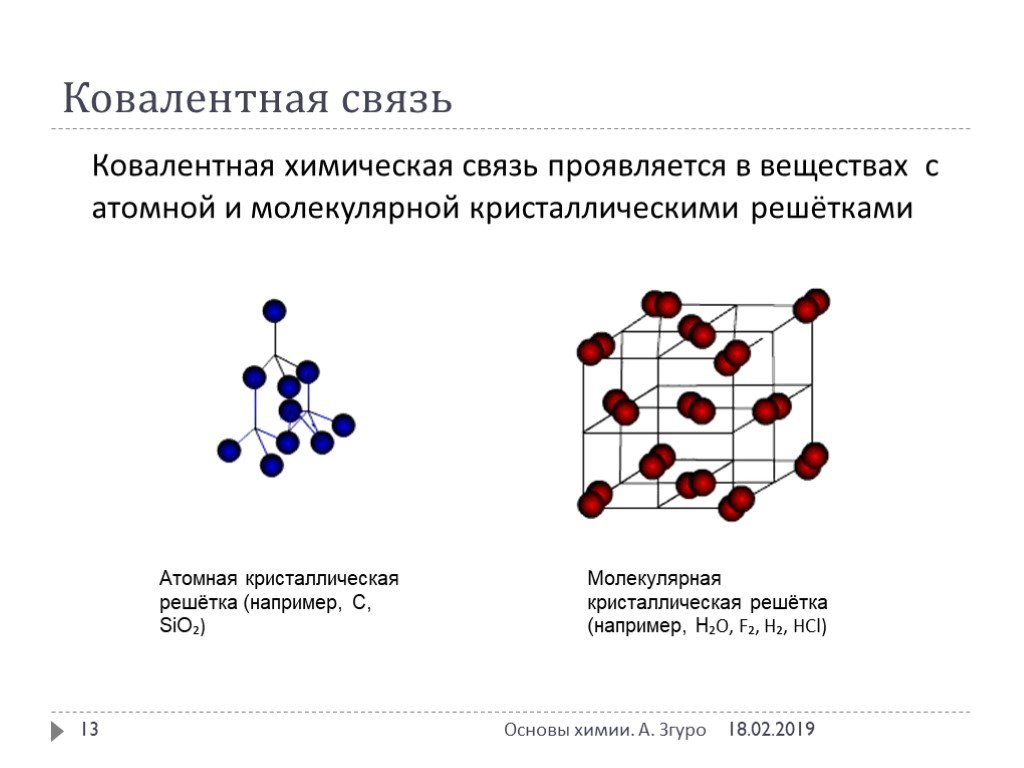
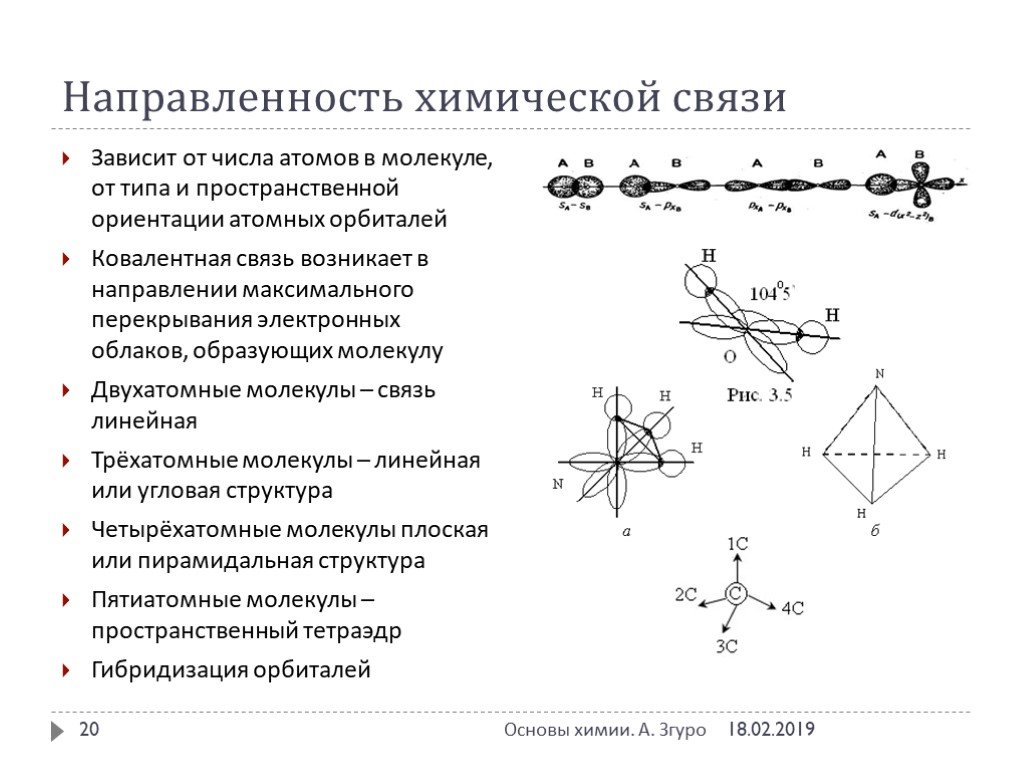
ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ. ковалентная ионная металлическая неполярная полярная. Al Na Ba Fe Mg. Металлическая – в простых веществах-металлах. Ковалентная ...Свойства ковалентной связи
Насыщаемость. Насыщаемость ковалентной связи определяеться числом общих электронных пар,которыми характерезуется тот или иной атом. Насыщенность,это ...Свойства металлов
План реферата. Положение металлов в периодической системе Д.И. Менделеева. Строение атомов металлов, кристаллических решеток. Физические свойства ...Свойства железа
"Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд иксолодр ддрооов золеже. Проверь себя! Положение железа в Периодической системе ...Свойства воды
ВОДА. Девиз урока: Вода – это жизнь! 22 марта — Всемирный день водных ресурсов по календарю ООН, День воды. Аквариум, Акватория, Акваланг, Акварель. ...Скорость химической реакции
План лекции. 1. Основные понятия 2. Классификация процессов 3. Скорость химической реакции 4. Влияние концентрации реагента на скорость реакции 5. ...Свойства уксусной кислоты
Немного истории... Уксус является продуктом брожения вина. Первое упоминание о его практическом применении относится к третьему веку до н. э. Греческий ...Свойства растворов электролитов
Начинаем наш урок, Пригласили к нам в домок, Мы не только всех друзей, И директоров, гостей. Всем хотим мы показать, Как нужно химию нам знать Без ...Вещество. Свойства веществ
Вещество-это то, из чего состоит физическое тело. Задание. Нарисуйте тела для перечисленных веществ. тело вещество. Стекло Пластмасса древесина. Вещество ...Свойства многоатомных спиртов
Содержание. Определение Физические свойства Номенклатура Химические свойства с активными металлами, оксидами активных металлов, с галогеноводородами, ...Великие имена: Творцы химической науки
Введение. Науку химию создавали люди необычной судьбы – вначале алхимики, затем врачи и аптекари и, наконец, собственно химики. Они верили в своё ...Влияние условий на скорость химической реакции
Заполните схему с вопросами о скорости реакции:. Задачи урока. Природа реагирующих веществ Концентрация реагирующих веществ Площадь реагирующих веществ ...Конспекты
Виды химической связи
План-конспект урока по учебнику «ХИМИЯ 8 КЛАСС ». . Тема:. «Виды химической связи». (Технологическая карта изучения темы). Тема. «Виды ...Виды химической связи
. . Учитель химии. . Ушакова Галина Григорьевна. Урок – игра. «Покорение вершины». . . . Цел урока. . Обобщить, систематизировать ...Электроотрицательность. Виды химической связи
Тема урока: «Электроотрицательность. Виды химической связи». Цели урока. :. раскрыть сущность образования химической связи между атомами, начать ...Виды химической связи
Технологическая карта урока по химии в соответствии с требованиями ФГОС. План-конспект урока по учебнику «ХИМИЯ 8 КЛАСС ». . . Тема:. «Виды ...Типы химической связи
Составила учитель химии и биологии Хамзина Гульжан Минуллаевна. Р.Казахстан. Маржанбулакская средняя школа. Актюбинской области. . . Самостоятельная ...Обобщение знаний о видах химической связи
МОУ «СОШ с. Запрудное Питерского района Саратовской области». . Урок химии – 2014 г. Урок химии в 8 классе,. по теме:. . «Обобщение знаний ...Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи
Урок №13. Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи. . . Тип урока:. обобщение и закрепление ...Виды химической связи
Урок химии в 8 классе. Тема. «Виды химической связи». . Цель. . . Обобщить знания по теме «Виды химической связи». . . . . ...Железо. Свойства железа и области применения
МКОУ «Буткинская общеобразовательная школа». Учитель химии: Шарова Л. С. . . Железо. Свойства железа и области применения. (9 класс). Цели ...Факторы, влияющие на скорость химической реакции
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ. СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 81. Урок химии в 9 классе. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:19 февраля 2019
Категория:Химия
Содержит:28 слайд(ов)
Поделись с друзьями:
Скачать презентацию