Презентация "Свойства железа" по химии – проект, доклад
Презентацию на тему "Свойства железа" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 24 слайд(ов).
Слайды презентации
Список похожих презентаций
Свойства спиртов
Спирты (алканолы) -. органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп –OH), соединенных с углеводородным ...Свойства полимеров
Широким применением полимеры обязаны своим свойствам, важнейшими из них являются способность к образованию анизотропных высокоориентированных волокон ...Свойства растворов электролитов
Начинаем наш урок, Пригласили к нам в домок, Мы не только всех друзей, И директоров, гостей. Всем хотим мы показать, Как нужно химию нам знать Без ...Свойства многоатомных спиртов
Содержание. Определение Физические свойства Номенклатура Химические свойства с активными металлами, оксидами активных металлов, с галогеноводородами, ...Свойства основных классов неорганических соединений
Урок-игра. Девиз: «Все познается в сравнении». Повторение основных понятий темы: ОКСИДЫ, КИСЛОТЫ, ОСНОВАНИЯ, СОЛИ. оксиды Na2O MgO BaO Mn2O7 SiO2 ...Соединения железа
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная ...Алюминий, его Свойства и применение
Al 13. Алюминий (лат. Aluminium). 3 8 2 26,9815 3s2 3p1. Был впервые получен датским физиком Х.К. Эрстедом в 1825 г. Название этого элемента происходит ...Нефть. Свойства, состав, переработка
Любая попытка дать характеристику такому многогранному дару природы, как нефть, никогда не может быть исчерпывающей. О нефти писали и будут писать. ...Ниобий и тантал. Свойства элементов и их соединений
Общая характеристика Nb и Ta. Основные физичекие характеристики элементов:. Серый металл, мягкий, пластичный (хруп- кий в присутствии ТаН), тугоплавкий, ...Кислоты. Классификация. Свойства
Определение. КИСЛОТЫ-это сложные вещества, состоящие из атомов водорода и кислотного остатка. Классификация кислот. Названия распространенных кислот. ...Коррозия железа в различных средах
Цель проекта. изучить процесс коррозии металлов в различных средах на примере железа. Задачи. Изучить литературу и другие источники информации по ...Дружи с ионами железа ты всегда, и краски ты получишь без труда
Наша задача. Получить соединения железа, которые могут быть использованы как пигменты для красок цветного фото. Получаем краски. К растворам FeSO4 ...Влияние железа на организм
Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры и промышленности, оно – орудие войны и мирного ...Вещество. Свойства веществ
Вещество-это то, из чего состоит физическое тело. Задание. Нарисуйте тела для перечисленных веществ. тело вещество. Стекло Пластмасса древесина. Вещество ...Свойства уксусной кислоты
Немного истории... Уксус является продуктом брожения вина. Первое упоминание о его практическом применении относится к третьему веку до н. э. Греческий ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Свойства черных и цветных металлов
Что такое металлы и сплавы? Металл — это вещество, обладающее ярким блеском и хорошей проводимостью тепла и электричества. Сплав — макроскопически ...Роль железа в жизни человека
Мы с вами живём в железный век. Поэтому мне хотелось узнать, когда появилось железо, в виде каких соединений встречается, какую роль играет для живых ...Характеристика железа
Сегодня на уроке мы с вами продолжаем изучать металлы. Какие металлы мы уже рассмотрели? Сегодня рассматриваем очень важный металл – основу современной ...Свойства
История открытия металлов. Каменный век Медный век (IV – III тысячелетия до н.э.) Бронзовый век (конец IV – начало I тысячелетия до н.э.) Железный ...Конспекты
Железо. Свойства железа и области применения
МКОУ «Буткинская общеобразовательная школа». Учитель химии: Шарова Л. С. . . Железо. Свойства железа и области применения. (9 класс). Цели ...Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства железа
Дата_____________ Класс_______________. Тема:. Железо. Положение железа в периодической системе и строение его атома. Нахождение в природе. Физические ...Свойства углеводородов
9. . . Серебрянская Нелля Александровна. Учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Аннотация ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Свойства растворов электролитов
"Свойства растворов электролитов". Урок обобщения знаний с мультимедийным сопровождением.(слайд 1). Цели:. - обобщить, систематизировать и углубить ...Свойства основных классов неорганических соединений
. ПЛАН УРОКА « Свойства основных классов неорганических соединений». Учитель Ефименко З.А. Класс, профиль: 11 класс, базовый уровень. . Программно-методическое ...Соединения железа
Класс:. 9. Тема урока:. «. Соединения железа». Цель урока:. организовать деятельность учащихся по усвоению и первичному закреплению знаний ...Соединения железа
. . Тема: «Соединения железа». Урок-исследование. Цель:. изучить состав , получение и свойства гидроксидов железа, научиться распознавать ...Свойства ионов. Качественные реакции на катионы и анионы
Сидорина Г. Н. , учитель химии. . Г У. Средняя общеобразовательная школа. N. 0. 5, г. Актау. . . Тема урока: «Свойства ионов. Качественные ...Свойства воды. Вода – растворитель
Использование ИКТ на уроках в начальной школе по ФГОС. 2014-2015. учебный год. Разработала и провела Храмцова Елена Анатольевна. . ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:9 января 2019
Категория:Химия
Содержит:24 слайд(ов)
Поделись с друзьями:
Скачать презентацию

































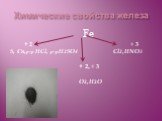









![Качественная реакция на ион Fe+2. Реактив – красная кровяная сольK3[Fe(CN)6] Результат воздействия – синий осадок (турнбуленовой сини) K3[Fe(CN)6] + FeCI2 = 2KCI + KFe[Fe(CN)6] 3K+ + Fe2+ + 2CI- + [Fe(CN)6]3- → KFe[Fe(CN)6] + 2K+ + 2CI- K+ + Fe2+ + [Fe(CN)6]3- → KFe[Fe(CN)6] Красная кровяная соль Качественная реакция на ион Fe+2. Реактив – красная кровяная сольK3[Fe(CN)6] Результат воздействия – синий осадок (турнбуленовой сини) K3[Fe(CN)6] + FeCI2 = 2KCI + KFe[Fe(CN)6] 3K+ + Fe2+ + 2CI- + [Fe(CN)6]3- → KFe[Fe(CN)6] + 2K+ + 2CI- K+ + Fe2+ + [Fe(CN)6]3- → KFe[Fe(CN)6] Красная кровяная соль](https://prezentacii.org/upload/cloud/19/01/112640/images/thumbs/screen21.jpg)
![Качественная реакция на ион Fe+3. 1) Реактив – желтая кровяная сольK4[Fe(CN)6] Результат воздействия – синий осадок (берлинской лазури) K4[Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6] 4K+ + Fe3+ + 3CI- + [Fe(CN)6]4- → KFe[Fe(CN)6] + 3K+ + 3CI- K+ + Fe3+ + [Fe(CN)6]4-→ KFe[Fe(CN)6] 2) Реактив – роданиднатр Качественная реакция на ион Fe+3. 1) Реактив – желтая кровяная сольK4[Fe(CN)6] Результат воздействия – синий осадок (берлинской лазури) K4[Fe(CN)6] + FeCI3 = 3KCI + KFe[Fe(CN)6] 4K+ + Fe3+ + 3CI- + [Fe(CN)6]4- → KFe[Fe(CN)6] + 3K+ + 3CI- K+ + Fe3+ + [Fe(CN)6]4-→ KFe[Fe(CN)6] 2) Реактив – роданиднатр](https://prezentacii.org/upload/cloud/19/01/112640/images/thumbs/screen22.jpg)