Презентация "Характеристика железа" по химии – проект, доклад
Презентацию на тему "Характеристика железа" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 31 слайд(ов).
Слайды презентации
Список похожих презентаций
Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Закономерности изменения некоторых свойств химических элементов в ПС. 1. Положение элемента в ПС и строение его атома. ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА. ...Характеристика неметаллов
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы: III IV V VI VII B С N O F Si P S CI As Se Br Te I At. ...Характеристика нефти
Состав нефти. Элементный состав нефти (технический): мальтены (легкие фракции, растворяющиеся в петролейном эфире) асфальтены (растворимы в бензоле) ...Характеристика элементов VII группы главной подгруппы. Хлор
. . . . Нахождение в природе.В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...
Дружи с ионами железа ты всегда, и краски ты получишь без труда
Наша задача. Получить соединения железа, которые могут быть использованы как пигменты для красок цветного фото. Получаем краски. К растворам FeSO4 ...Структура ячейки на примере атома железа
Периоды Группы 1 3 4 5 6 7 I II III IV V VII VIII VI малые большие А Б. Условная граница от бора до астата. Бор Кремний Мышьяк Теллур Астат Металлы ...Характеристика элемента - металла
Особенности элементов металлов. На внешнем уровне …. …Са + О2 =…СаО Металлы могут проявлять ….. свойства 3. Металлы проявляют общие физических свойства ...Свойства железа
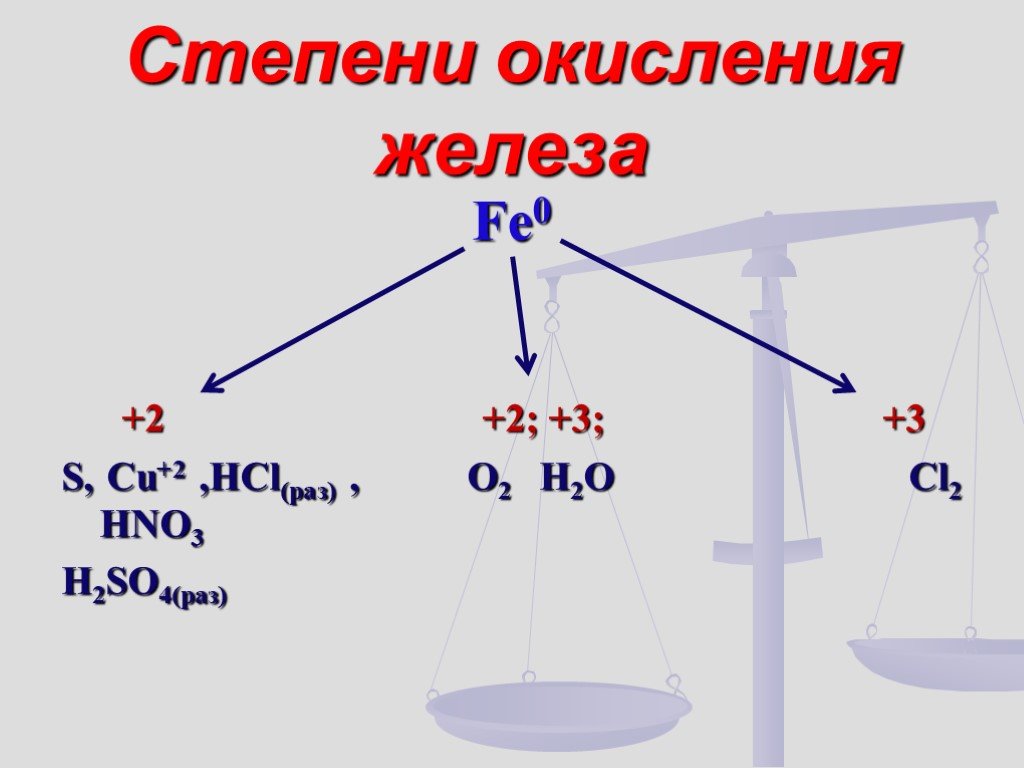
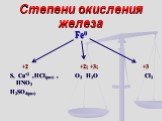
"Третий лишний». Задание: Решите анаграммы и исключите лишнее. леруогд иксолодр ддрооов золеже. Проверь себя! Положение железа в Периодической системе ...Соединения железа
Железо расположено в 4 периоде, в побочной подгруппе VIII группы Периодической системы химических элементов Д.И.Менделеева. Относительная атомная ...Роль железа в жизни человека
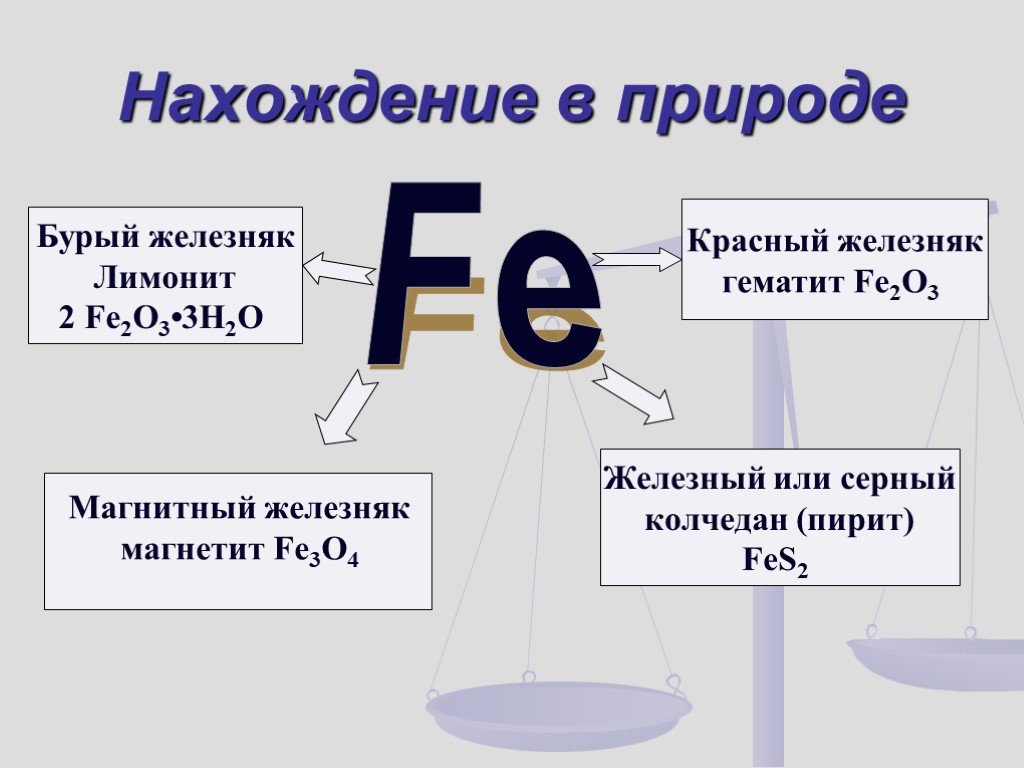
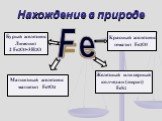
Мы с вами живём в железный век. Поэтому мне хотелось узнать, когда появилось железо, в виде каких соединений встречается, какую роль играет для живых ...Органические соединения железа
Почему наш век можно назвать железным веком? Элементы и атомы, В менделеевский взятые круг, Сделали химию самой богатой И самой творческой из наук. ...Коррозия железа в различных средах
Цель проекта. изучить процесс коррозии металлов в различных средах на примере железа. Задачи. Изучить литературу и другие источники информации по ...Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Характеристика азота как химического элемента и простого вещества
Вслед за Резерфордом такие же опыты провели Шееле, Пристли и Кавендиш, которые называли исследуемое вещество «удушливым воздухом», «дурным воздухом». ...Характеристика щелочных металлов
ПЛАН УРОКА. Строение атомов элементов главной подгруппы I группы. Щелочные металлы – простые вещества. Химические свойства щелочных металлов. Соединения ...Характеристика АХОВ и их поражающие факторы
Разработать классификацию АХОВ по характеру воздействия на человека. повторение. Какие вещества относятся к АХОВ? Химические вещества или соединения, ...Характеристика элемента фосфор
Фосфор был открыт немецким алхимиком X. Брэндом в 1669 г. Позже А. Лавуазье доказал, что фосфор самостоятельный химический элемент. Ж. Пруст и М. ...Характеристика высокомолекулярных соединений
Высокомолекулярными соединениями (ВМС) или полимерами. Природные полимеры. Синтетические полимеры. называются вещества, имеющие большую молекулярную ...Химия железа
Почему из такого количества металлов побочных подгрупп для изучения выбрали один- именно железо ? Наиболее широко используется в современной промышленности. ...Конспекты
Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
1001 идея интересного занятия с детьми. . ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ КРИТИЧЕСКОГО МЫШЛЕНИЯ НА УРОКАХ ХИМИИИ. Бурдакова Кристина Олеговна, МБОУ СОШ ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Тема урока: Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева. Цельурока:. Расширить и углубить ...Соединения железа
Класс:. 9. Тема урока:. «. Соединения железа». Цель урока:. организовать деятельность учащихся по усвоению и первичному закреплению знаний ...Соединения железа
МКОУ Богучарская общеобразовательная школа № 2. Учитель химии Хаустова Ольга Анатольевна. . Класс:. 9. Тема урока:. . Соединения железа. Тип ...Соединения железа
. . Тема: «Соединения железа». Урок-исследование. Цель:. изучить состав , получение и свойства гидроксидов железа, научиться распознавать ...Соединения железа
Конспект урока в 9 классе на тему «Соединения железа». Цель урока: изучить свойства соединений железа (II. ) и (III. ), понять, какое практическое ...Соединения железа
Конспект урока по химии для 9 класса на тему: «Соединения железа». Урок строится на элементах личностно ориентированного обучения и проводится по ...Периодический закон и периодическая система в свете учения о строении атома. Характеристика химического элемента
. План урока химии. 8 класс (2 часа). Тема занятия:. . . Периодический закон и периодическая система в свете учения о строении атома. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 февраля 2019
Категория:Химия
Содержит:31 слайд(ов)
Поделись с друзьями:
Скачать презентацию
























































![Качественные реакции на ионы железа. На ион Fe+2 – красная кровяная соль: K3[Fe(CN)6] – гексацианоферрат (III) калия На ион Fe+3 – желтая кровяная соль: K4[Fe(CN)6] – гексацианоферрат (II) калия Оба этих реактива с ионом Fe+2 и с ионом Fe+3 дают синее окрашивание. Качественные реакции на ионы железа. На ион Fe+2 – красная кровяная соль: K3[Fe(CN)6] – гексацианоферрат (III) калия На ион Fe+3 – желтая кровяная соль: K4[Fe(CN)6] – гексацианоферрат (II) калия Оба этих реактива с ионом Fe+2 и с ионом Fe+3 дают синее окрашивание.](https://prezentacii.org/upload/cloud/19/02/128771/images/thumbs/screen29.jpg)
![K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая кровяная соль FeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6] турнбуллева синь FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] берлинская лазурь KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6] Турнбуллева синь берлинская лазурь K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая кровяная соль FeCl2+ K3[Fe(CN)6 = KFe[Fe(CN)6] турнбуллева синь FeCl3 + K4[Fe(CN)6] = KFe[Fe(CN)6] берлинская лазурь KFe+2 [Fe+3 (CN)6] = KFe+3 [Fe+2 (CN)6] Турнбуллева синь берлинская лазурь](https://prezentacii.org/upload/cloud/19/02/128771/images/thumbs/screen30.jpg)































