Презентация "Характеристика элемента фосфор" по химии – проект, доклад
Презентацию на тему "Характеристика элемента фосфор" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 25 слайд(ов).
Слайды презентации
Список похожих презентаций
Характеристика элемента - металла
Особенности элементов металлов. На внешнем уровне …. …Са + О2 =…СаО Металлы могут проявлять ….. свойства 3. Металлы проявляют общие физических свойства ...Характеристика азота как химического элемента и простого вещества
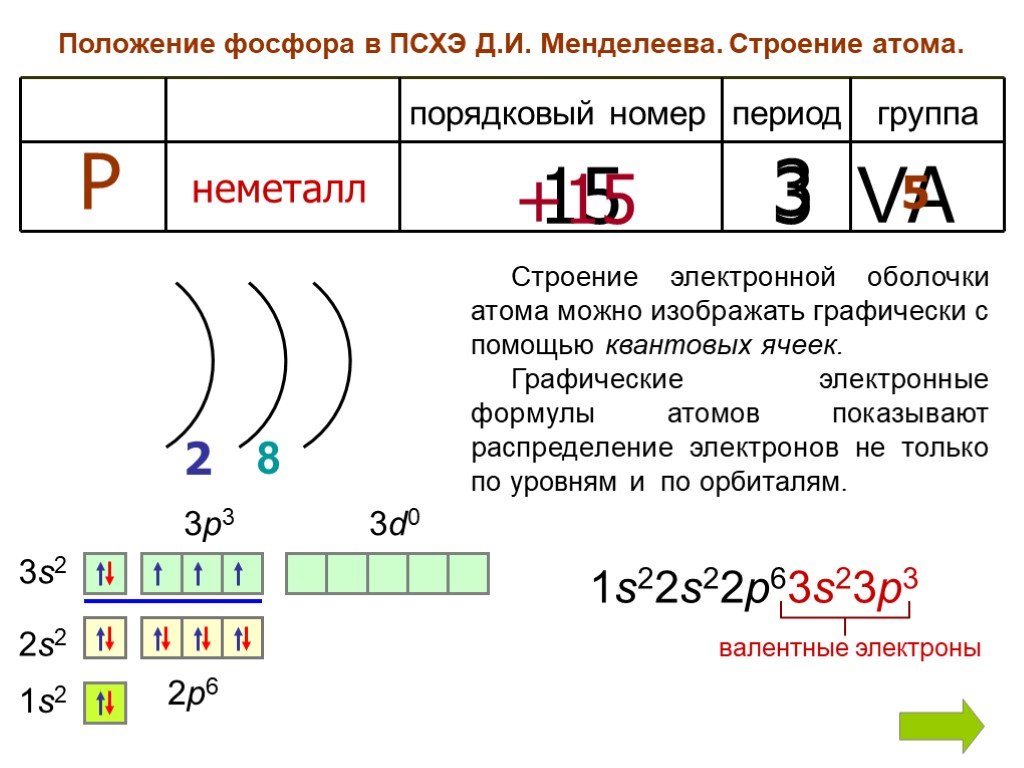
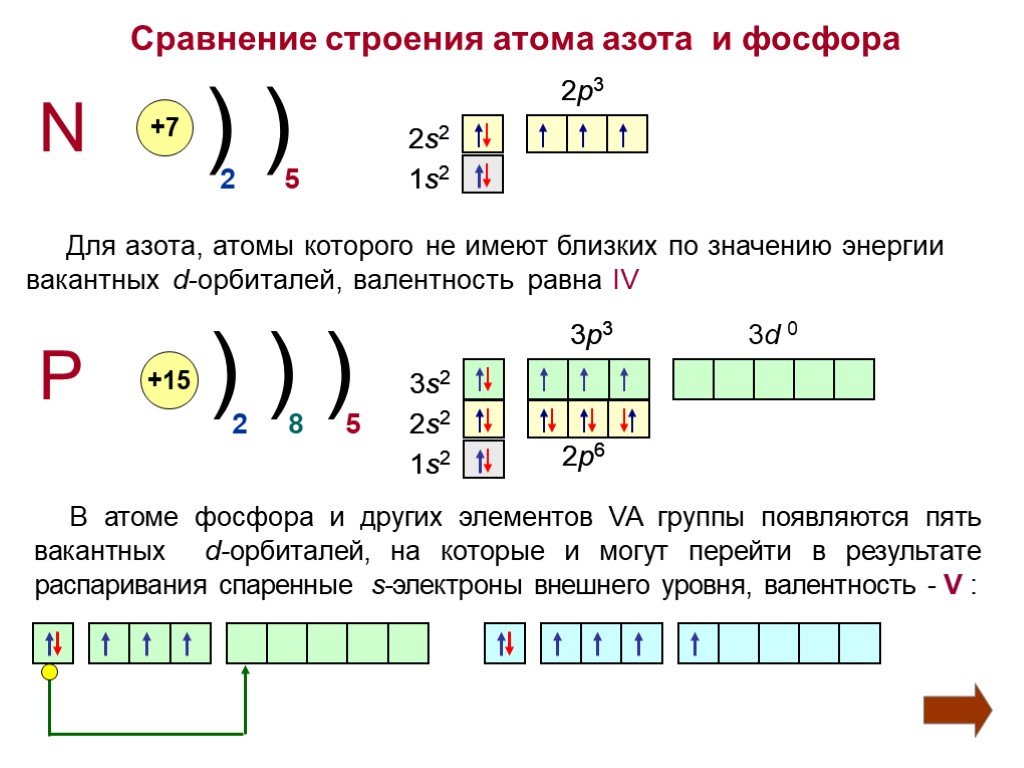
Вслед за Резерфордом такие же опыты провели Шееле, Пристли и Кавендиш, которые называли исследуемое вещество «удушливым воздухом», «дурным воздухом». ...Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева
Закономерности изменения некоторых свойств химических элементов в ПС. 1. Положение элемента в ПС и строение его атома. ПЛАН ХАРАКТЕРИСТИКИ ХИМ. ЭЛЕМЕНТА. ...Характеристика щелочных металлов
ПЛАН УРОКА. Строение атомов элементов главной подгруппы I группы. Щелочные металлы – простые вещества. Химические свойства щелочных металлов. Соединения ...Характеристика щелочных металлов
Металлы Сu, Au, Ag не взаимодействуют с водой даже при нагревании. Металлы обладают электропроводностью и теплопроводностью. Для металлов характерна ...Характеристика химических элементов и их соединений на основе положения элементов в периодической системе.
Цель урока? Химический элемент. Семейство Щелочные Ме Халькогены Период Группы Изотопы Валентность Д.И.Менделеев. Горячий стул. Химический диктант ...Характеристика нефти
Состав нефти. Элементный состав нефти (технический): мальтены (легкие фракции, растворяющиеся в петролейном эфире) асфальтены (растворимы в бензоле) ...Характеристика неметаллов
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы: III IV V VI VII B С N O F Si P S CI As Se Br Te I At. ...Характеристика железа
Сегодня на уроке мы с вами продолжаем изучать металлы. Какие металлы мы уже рассмотрели? Сегодня рассматриваем очень важный металл – основу современной ...Характеристика высокомолекулярных соединений
Высокомолекулярными соединениями (ВМС) или полимерами. Природные полимеры. Синтетические полимеры. называются вещества, имеющие большую молекулярную ...Характеристика АХОВ и их поражающие факторы
Разработать классификацию АХОВ по характеру воздействия на человека. повторение. Какие вещества относятся к АХОВ? Химические вещества или соединения, ...Три элемента таблицы Менделеева
Таблица Менделеева, (или периодическая система химических элементов) - это таблица, которая квалифицирует химические элементы по различным свойствам, ...Характеристика элементов VII группы главной подгруппы. Хлор
. . . . Нахождение в природе.В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только ...
Химический элемент фосфор
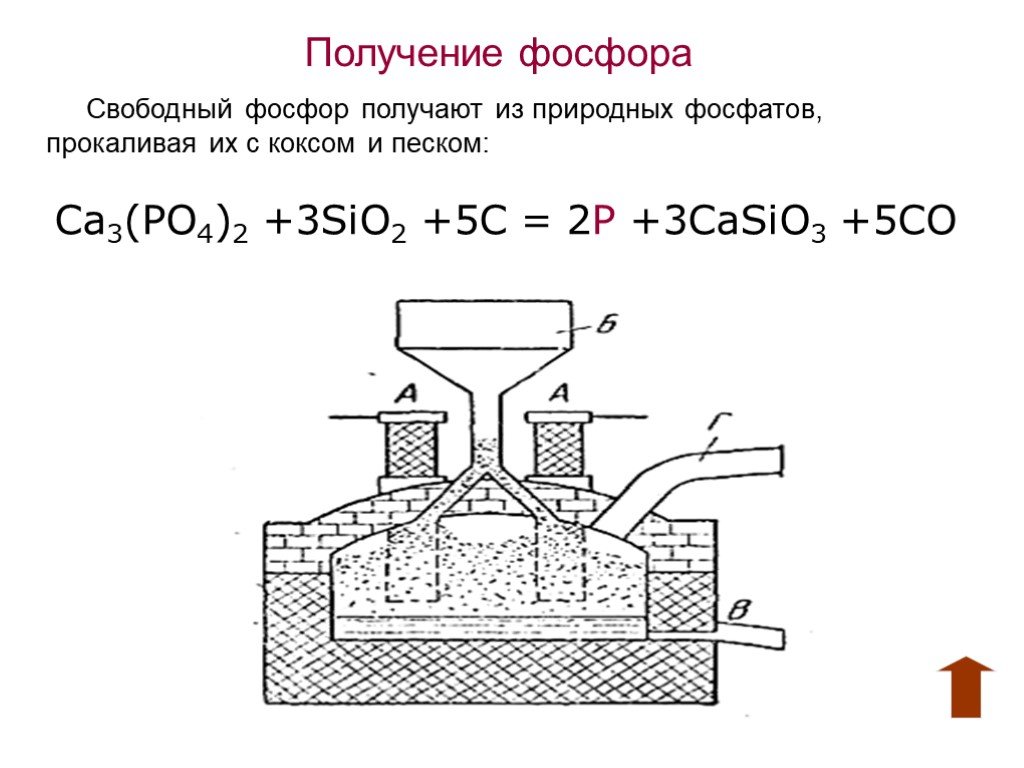
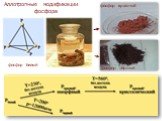
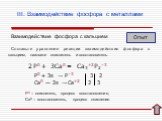
Цель: рассмотреть особенности фосфора как химического элемента и простого вещества. Задачи:. 1)Изучить теоретический материал о фосфоре ( строение ...Белый фосфор
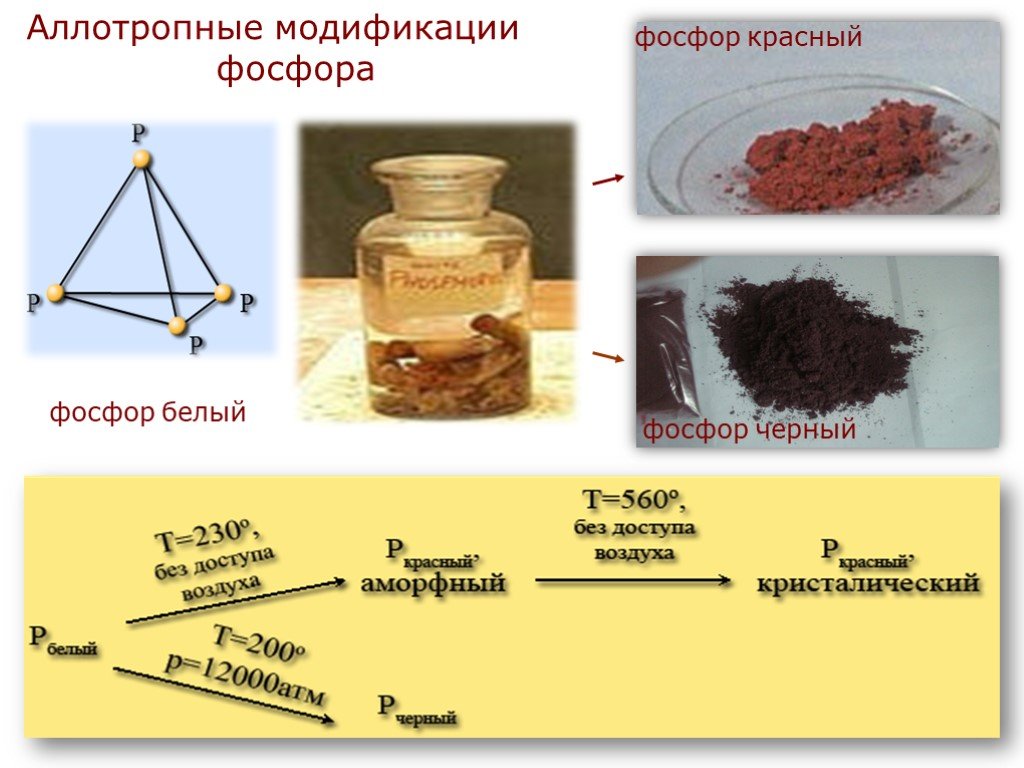
Белый фосфор представляет собой белое вещество (из-за примесей может иметь желтоватый оттенок) с температурой плавления 44,1 °С. По внешнему виду ...Массовая доля элемента в веществе
Химические формулы. 1. Индекс показывает ….. 2. Коэффициент показывает …. 3. Индекс записывают …. 4. Коэффициент записывают ….. 5. Условная запись ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Конспекты
Характеристика элемента по его положению в периодической системе химических элементов Д.И. Менделеева
1001 идея интересного занятия с детьми. . ПРИМЕНЕНИЕ ТЕХНОЛОГИЙ КРИТИЧЕСКОГО МЫШЛЕНИЯ НА УРОКАХ ХИМИИИ. Бурдакова Кристина Олеговна, МБОУ СОШ ...Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Тема урока: Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева. Цельурока:. Расширить и углубить ...Периодический закон и периодическая система в свете учения о строении атома. Характеристика химического элемента
. План урока химии. 8 класс (2 часа). Тема занятия:. . . Периодический закон и периодическая система в свете учения о строении атома. ...Электронные формулы. Тип элемента
Муниципальное бюджетное общеобразовательное учреждение. «Ковылкинская средняя общеобразовательная школа № 2». Тема урока. «Электронные ...Химические формулы. Относительные атомная и молекулярная мас-сы. Массовая доля элемента в соединении
Автор: Учитель химии и биологии Карякина Екатерина Николаевна. МБОУ СОШ № 139 городского округа Самара. Конспект урока по химии для 8 класса. ...Характеристика щелочных металлов
Тема урока: Характеристика щелочных металлов. Цель урока:. . дать общую характеристику щелочных металлов по положению в периодической таблице ...Характеристика металлов II группы главной подгруппы
Тема урока:. . Характеристика металлов. II. группы главной подгруппы. Цель урока: дать характеристику металлов II. группы главной подгруппы. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Химия
Содержит:25 слайд(ов)
Поделись с друзьями:
Скачать презентацию