Презентация "Основные законы науки химии" – проект, доклад
Презентацию на тему "Основные законы науки химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 21 слайд(ов).
Слайды презентации
Список похожих презентаций
Основные законы химии
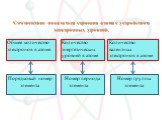
Закон сохранения массы Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции. Периодический закон Свойства простых веществ, а также ...Основные понятия и законы химии
стратегия успеха. посещение, работа на лабораторных занятиях и своевременное оформление отчетов. посещение, восприятие и записывание материала лекций. ...Основные понятия химии. Понятия и определения
Химический элемент – вид атомов, характеризующихся определенным зарядом ядра. Моль – количество вещества, которое содержит столько же структурных ...Основные теории химии
Тема : « Сравнение двух ведущих теорий химии : Периодического закона Д.И. Менделеева и теории химического строения А.М. Бутлерова». Цели урока. 1. ...Основные этапы развития химии комплексных соединений
В общем случае: комплексными соединениями называют химические соединения, образованные сочетанием отдельных компонентов, содержащие в своем составе ...Органическая химия. Основные положения. История развития науки
Цель работы:. Получить основную информацию об органической химии и истории её развития. Органическая химия. Органическая химия — раздел химии, изучающий ...Основные понятия химии
Химия – это наука о веществах, их свойствах и превращениях Физическое тело вещество Химический элемент - определенный вид атомов. . Вещества – это ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Основные классы органических соединений организма человека
3 основные группы: (от количества составляющих мономеров). МОНОСАХАРИДЫ производные многоатомных спиртов, содержащие кроме гидроксильных групп, функциональную ...Основные классы неорганических соединений
Цель: Обобщить и систематизировать знания учащихся о составе, строении и свойствах классов неорганических соединений. Задачи: Обучающие: закрепить ...Организация самостоятельной работы учащихся на уроках химии
Кабинет химии. «Обучая других, мы учимся сами». Сенека. “ТО, ЧТО Я СЛЫШУ, Я ЗАБЫВАЮ, ТО, ЧТО Я ВИЖУ, Я ПОМНЮ, ТО, ЧТО Я ДЕЛАЮ, Я ПОНИМАЮ”. КОНФУЦИЙ. ...Роль химии
« Явления жизнедеятельности организма, как больного, так и здорового, можно понять лишь рассматривая и оценивая происходящие в нем химические процессы, ...Применение интерактивной доски на уроках химии
«Что вам интересно на уроках химии?». На протяжении года изучения химии с использованием возможностей интерактивной доски позволило в большей мере ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Взаимосвязь химии и русского языка
В процессе изучения химии мы сталкиваемся с одной из проблем: освоение химического языка. Что такое химический язык? В широком смысле В узком смысле. ...Вещество в химии
Сегодня мы начинаем изучать одну из самых древних из важных наук- химию. А что же изучает химия? Химия – это наука о веществах, их свойствах и превращениях. ...Великие учёные, внёсшие значительный вклад в развитие химии
Дмитрий Иванович Менделеев. Родился в Тобольске в семье директора гимназии. После окончания гимназии он поступил в Главный педагогический институт ...Великие имена: Творцы химической науки
Введение. Науку химию создавали люди необычной судьбы – вначале алхимики, затем врачи и аптекари и, наконец, собственно химики. Они верили в своё ...Безопасность на уроке химии
Пробовать вещества на вкус, есть и пить в химическом кабинете. Осторожно направляйте к себе газ рукой. ЗАПРЕЩАЕТСЯ. . . . . ЗАПРЕЩАЮЩИЕ ЗНАКИ. Запрещается ...Конспекты
Основные законы общей химии
Конспект урока по теме:. «Основные законы общей химии»Класс:. 11 классЦель урока. : создать условия для актуализации и систематизации знаний учащихся ...Основные классы неорганических соединений
Урок-повторение по теме. «Основные классы неорганических соединений». Цель урока:. систематизировать знания учащихся по теме «Основные классы ...Основные классы неорганических соединений
План-конспект учебного занятия по химии. Автор:. Серова Елена Петровна. Класс:. 8. Тема:. Основные классы неорганических соединений. Форма ...Школьный кабинет химии
Урок-экскурсия «Школьный кабинет химии». Цели мероприятия:. Предметная:. познакомить с новой наукой - химией, что она изучает;. Методологическая:. ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. Орловская средняя общеобразовательная школа №3. Открытый урок. по теме «Предмет ...Основные типы химических реакций
8 класс «Основные типы химических реакций». . Образовательная:. Закрепить и расширить знания учащихся о химических реакциях, их признаках и условиях ...Основные сведения о строении атома
Унковская Светлана Андреевна. МБОУ СОШ №18 г.Ставрополь. учитель химии. Тема урока: «Основные сведения о строении атома». Цель урока. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Интересные факты о химии
Интересные факты о химии. Химия – царица наук. ХИМИЯ- это. наука о составе, строении, свойствах веществ и их превращениях. . Один литр морской ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:12 мая 2015
Категория:Химия
Автор презентации:учитель биологии и химии, Г. П. Яценко
Содержит:21 слайд(ов)
Поделись с друзьями:
Скачать презентацию