Презентация "Основные понятия химии" – проект, доклад
Презентацию на тему "Основные понятия химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 40 слайд(ов).
Слайды презентации
Список похожих презентаций
Основные понятия химии. Понятия и определения
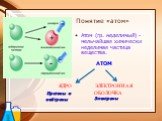
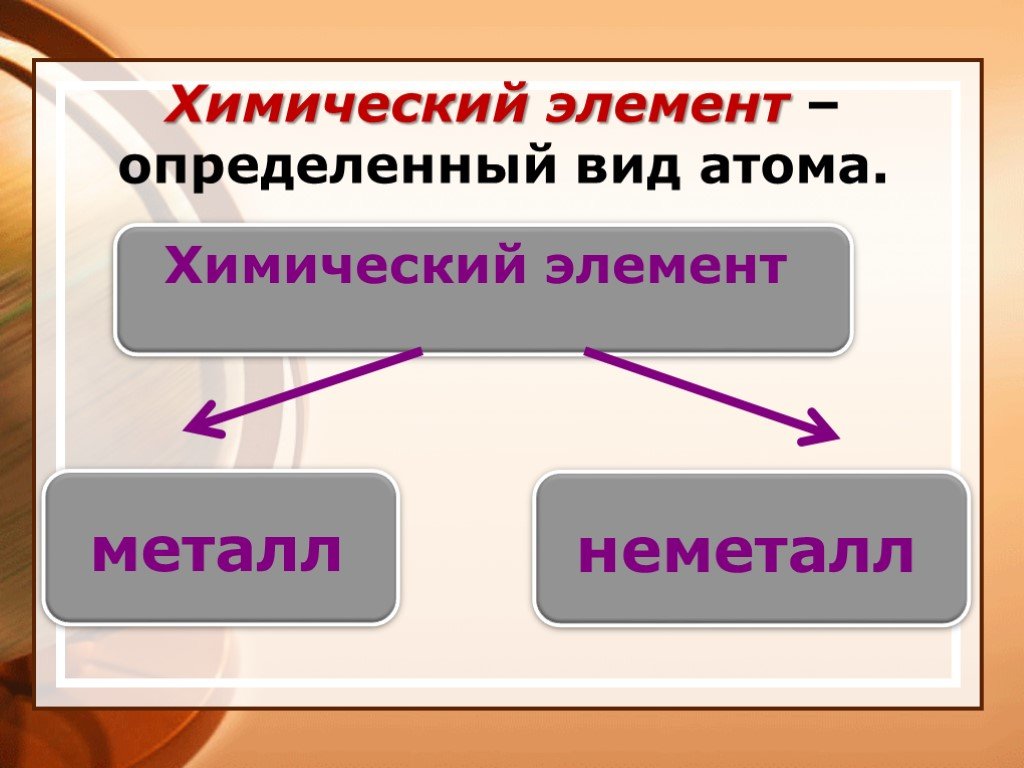
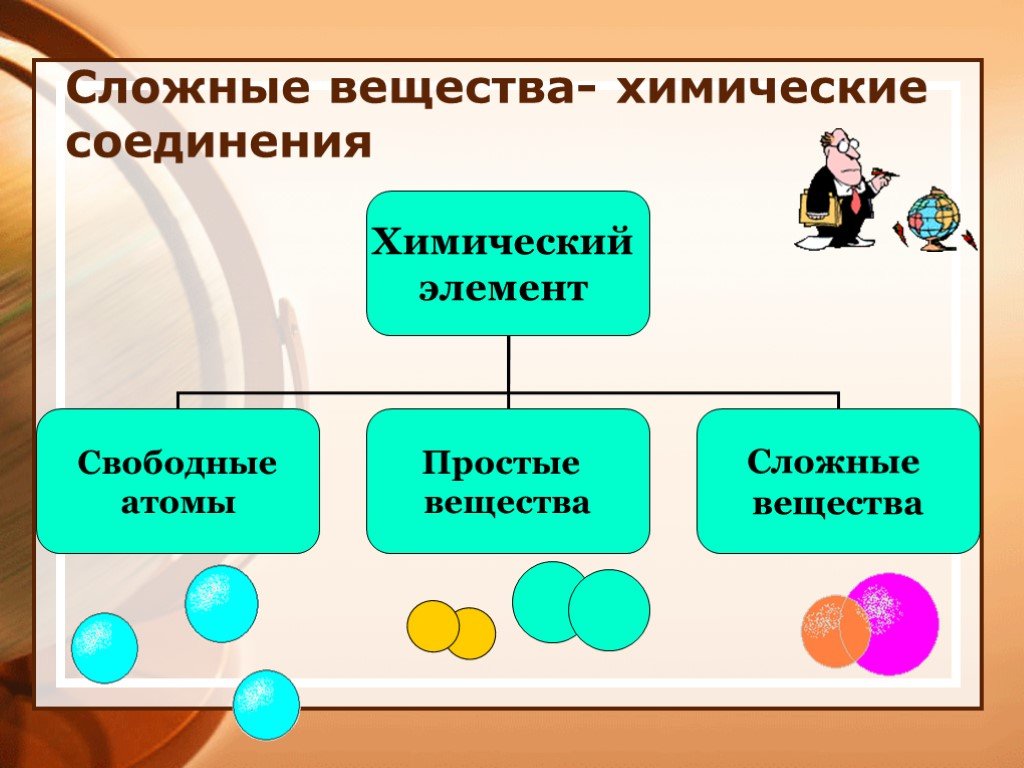
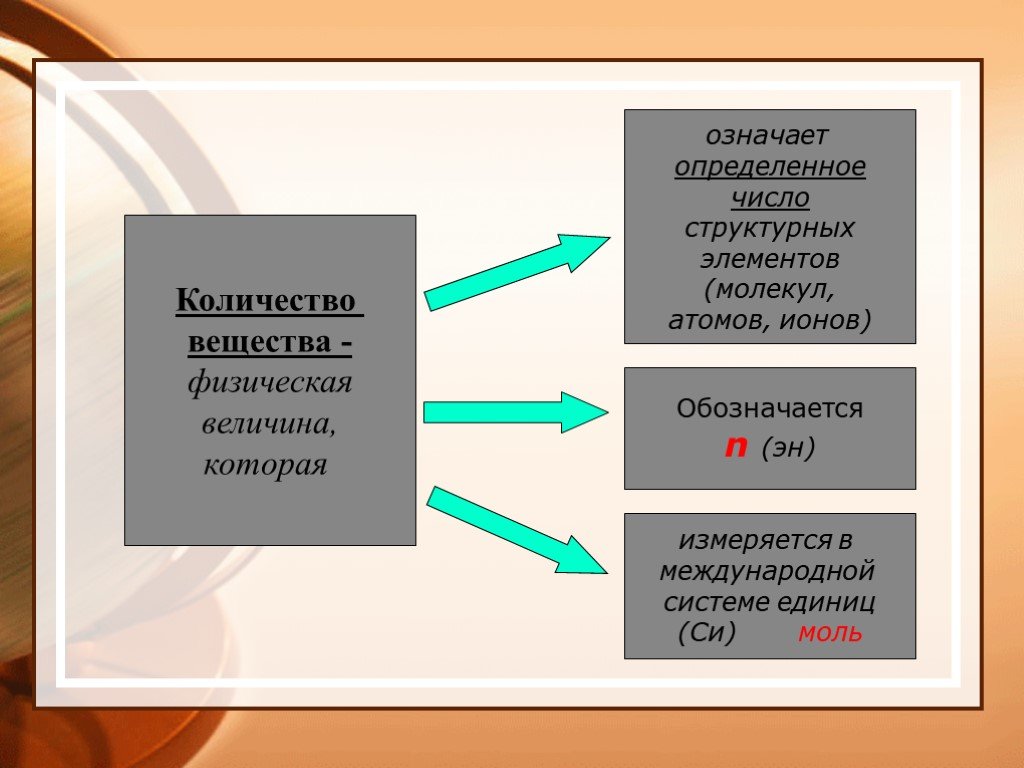
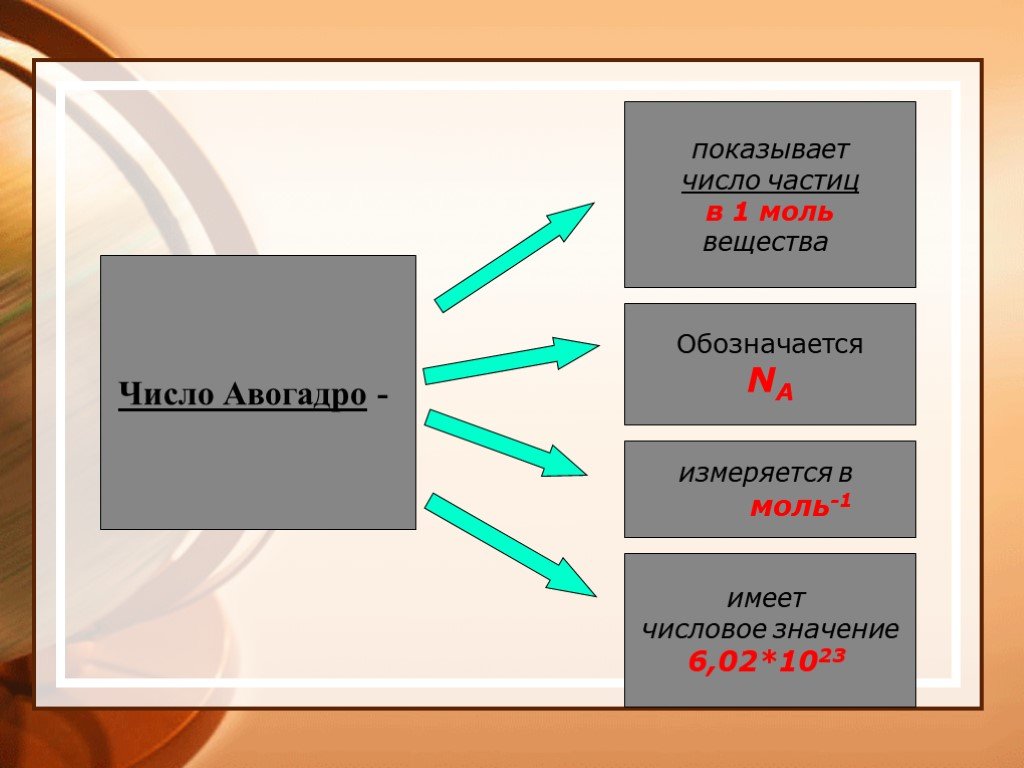
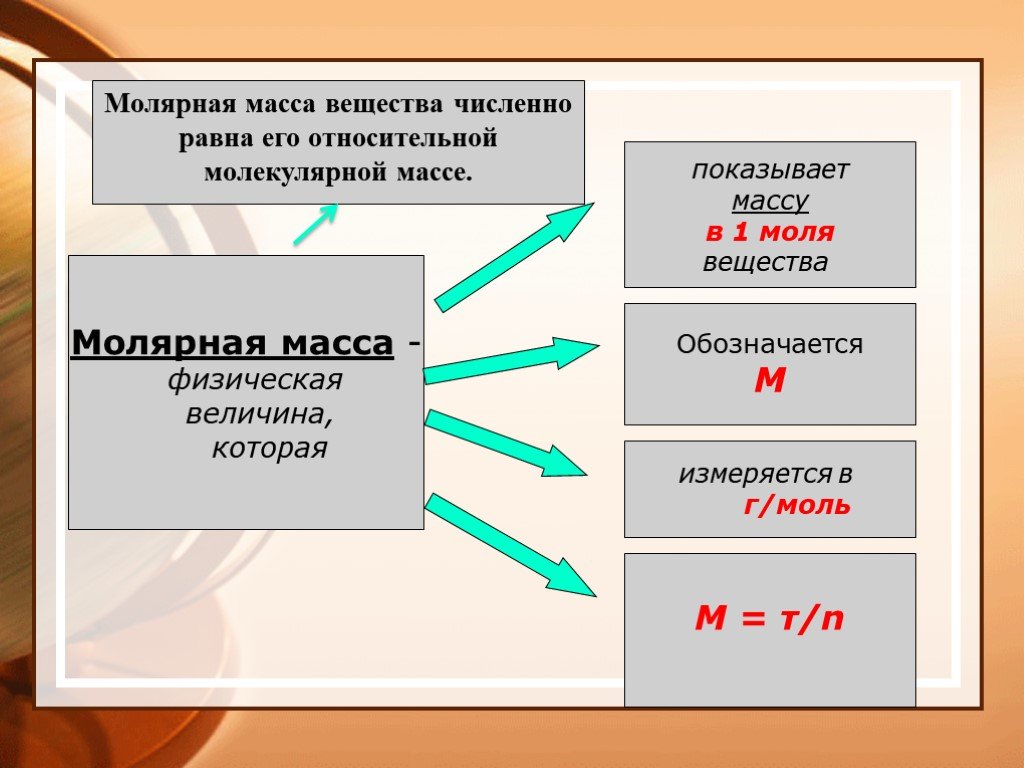
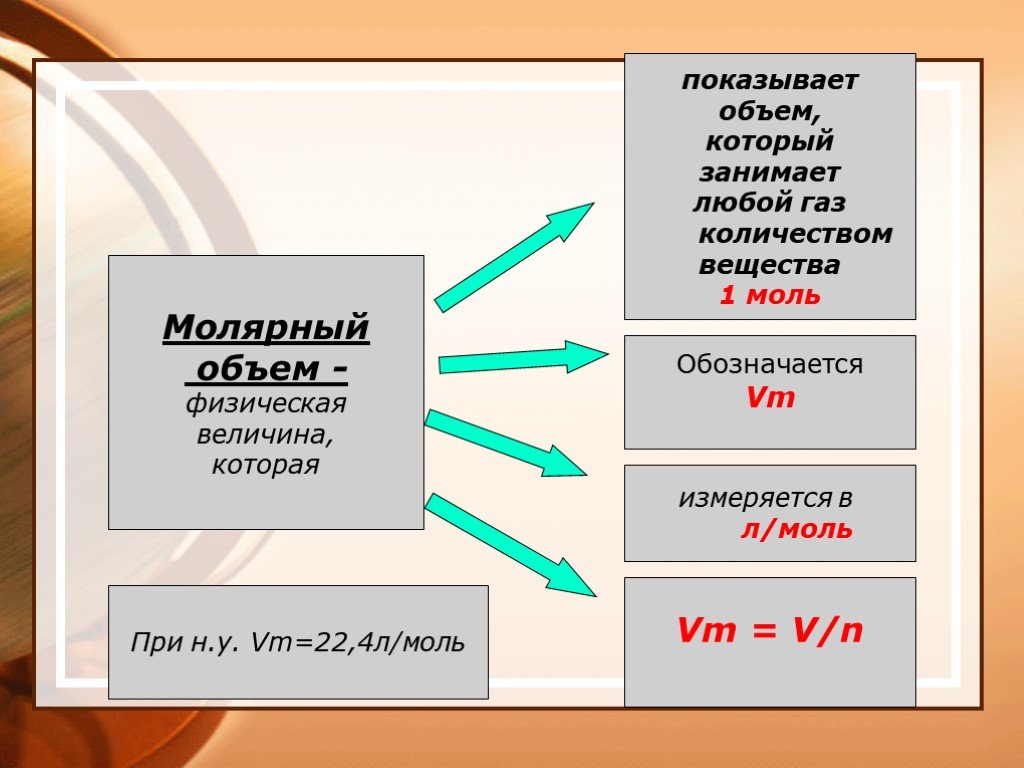
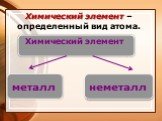
Химический элемент – вид атомов, характеризующихся определенным зарядом ядра. Моль – количество вещества, которое содержит столько же структурных ...Основные понятия и законы химии
стратегия успеха. посещение, работа на лабораторных занятиях и своевременное оформление отчетов. посещение, восприятие и записывание материала лекций. ...Основные этапы развития химии комплексных соединений
В общем случае: комплексными соединениями называют химические соединения, образованные сочетанием отдельных компонентов, содержащие в своем составе ...Основные теории химии
Тема : « Сравнение двух ведущих теорий химии : Периодического закона Д.И. Менделеева и теории химического строения А.М. Бутлерова». Цели урока. 1. ...Основные законы химии
Закон сохранения массы Масса веществ, вступивших в реакцию, равна массе всех продуктов реакции. Периодический закон Свойства простых веществ, а также ...Основные химические понятия
Инструкция к проведению тестирования. Тест можно применять как на уроке для закрепления нескольких пройденных тем, так и для проверки знаний учащихся ...Азотная кислота основные понятия
Физические и физико-химические свойства. Молекула имеет плоскую структуру (длины связей в нм): азот в азотной кислоте четырёхвалентен, степень окисления ...Основные законы науки химии
Химия – наука о веществах, их строении, свойствах и превращениях. Химические свойства веществ – это способность данного вещества превращаться в другие ...по химии витамины
Витамины. Низкомолекулярные органические соединения различной химической природы, необходимые для осуществления важнейших процессов, протекающих в ...Отчет по месячнику химии
План месячника. Оформление газеты Олимпиады (8-11классы) Конкурсы: «Химия в рисунках», «Составление кроссвордов, викторин» «Химическая эстафета» ( ...Основные положения ТЭД
1-Е положение ТЭД. Все вещества по их способности проводить электрический ток в растворах делятся на электролиты и неэлектролиты. Вещества в растворах. ...Основные классы неорганических соединений Соли
Классификация неорганических веществ 1.Определение 2.Классификация СОЛЕЙ; 3.НОМЕНКЛАТУРА. 4.Получение СОЛЕЙ; 5.Химические свойства СОЛЕЙ. Содержание:. ...Основные классы неогранических соединений
ЦЕЛИ УРОКА: дать определение кислотам, рассмотреть состав кислот, классифицировать кислоты, рассмотреть схему образования кислотных дождей, ознакомиться ...Олимпиадные задачи по химии
Как войти в задачу. Олимпиадные задачи по неорганической химии. Вещество З – черно-серые кристаллы; легко образуют фиолетовые пары, обладающие резким ...Проблемы химии
Философские проблемы химии. Вопросы:. Концептуальные системы химии История химии Синергетика как современная научная методология. Концептуальные системы ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Взаимосвязь химии и русского языка
В процессе изучения химии мы сталкиваемся с одной из проблем: освоение химического языка. Что такое химический язык? В широком смысле В узком смысле. ...Вещество в химии
Сегодня мы начинаем изучать одну из самых древних из важных наук- химию. А что же изучает химия? Химия – это наука о веществах, их свойствах и превращениях. ...Великие учёные, внёсшие значительный вклад в развитие химии
Дмитрий Иванович Менделеев. Родился в Тобольске в семье директора гимназии. После окончания гимназии он поступил в Главный педагогический институт ...Конспекты
Основные законы общей химии
Конспект урока по теме:. «Основные законы общей химии»Класс:. 11 классЦель урока. : создать условия для актуализации и систематизации знаний учащихся ...Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций
Дата ____________ Класс _____________. Тема: Основные классы неорганических соединений: кислоты, оксиды, основания, соли. Типы химических реакций. ...Школьный кабинет химии
Урок-экскурсия «Школьный кабинет химии». Цели мероприятия:. Предметная:. познакомить с новой наукой - химией, что она изучает;. Методологическая:. ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Предмет органической химии
Муниципальное бюджетное общеобразовательное учреждение. Орловская средняя общеобразовательная школа №3. Открытый урок. по теме «Предмет ...Первоначальные сведения о строении органических веществ. Основные положения теории строения органических соединений А. М. Бутлерова
Дата_____________ Класс_______________. Тема: Первоначальные сведения о строении органических веществ. Основные положения теории строения органических ...Основные сведения о строении атома
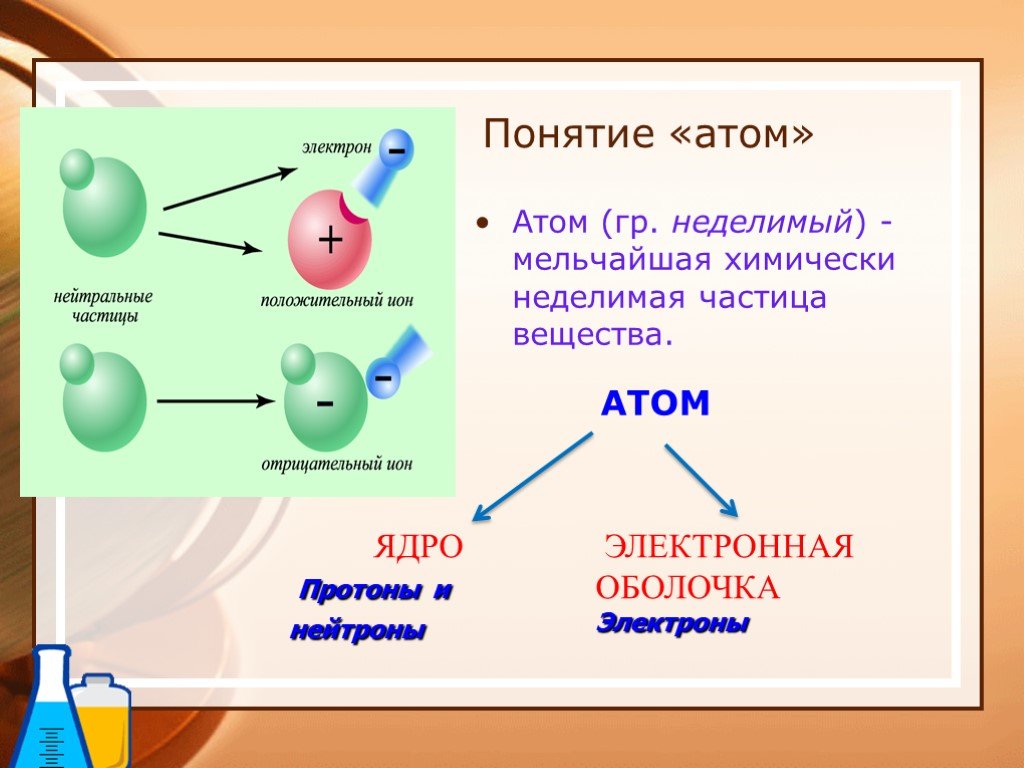
Урок по химии 8 класс. «Основные сведения о строении атома». Запольская Елена Николаевна учитель химии и биологии. . МБОУ «СОШ№3 г.Мамадыш». ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:23 мая 2019
Категория:Химия
Автор презентации:Л.И.Настина, учитель химии
Содержит:40 слайд(ов)
Поделись с друзьями:
Скачать презентацию















































![Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %. Массовые доли элементов. ФОРМУЛА: Ar (эл.)• n W(эл.) Mr (в-ва) Единицы измерения [доли] или [%], в этом случае умножаем на 100 %.](https://prezentacii.org/upload/cloud/19/05/4701/images/thumbs/screen26.jpg)