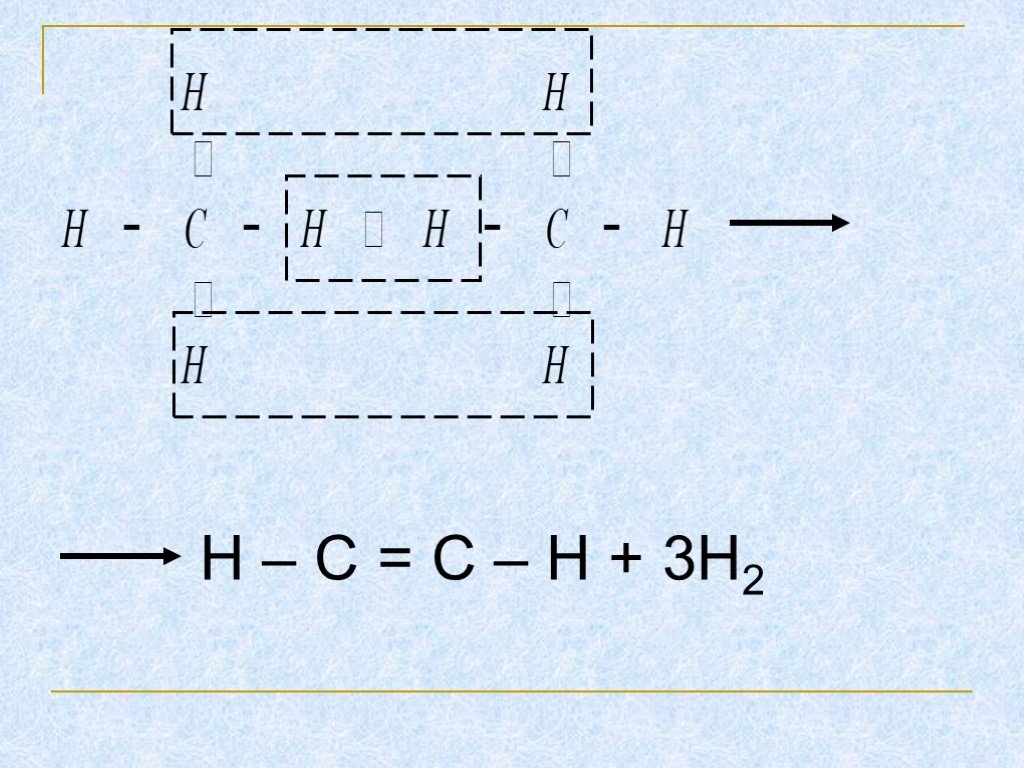Презентация "Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)" по химии – проект, доклад
Презентацию на тему "Правила образования названий разветвленных алканов по международной номенклатуре (ИЮПАК)" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 26 слайд(ов).
Слайды презентации
Список похожих презентаций
Использование разнообразных форм и средств контроля за качеством образования на уроках химии
В.Д.Шаталов утверждал, что для того, чтобы работа в школе была эффективной, должен сработать «эффект соленого огурца». Главное – создать рассол, тогда ...Игра по химии «Остров Периодическая Система»
«Остров Периодическая Система». Изучение Периодической Зависимости свойств элементов от строения атома. Периодическая Система. Схема учебного занятия. ...Задачки по химии
1.Какую массу соли и воды нужно взять для приготовления 400 г. 18% -ного раствора? 2.В качестве противовоспалительного лекарства применяется 2% -ный ...Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам курса неорганической химии
Х И М И Ч Е С К А Я В И К Т О Р И Н А «Знаешь ли ты это? 11 класс. ТЕМА: «Закрепление, совершенствование, обобщение знаний и подготовка к ЕГЭ по темам ...Отчет по месячнику химии
План месячника. Оформление газеты Олимпиады (8-11классы) Конкурсы: «Химия в рисунках», «Составление кроссвордов, викторин» «Химическая эстафета» ( ...Задачи по химии
Муниципальное бюджетное образовательное учреждение «Средняя общеобразовательная школа № 7». Составитель: Маклакова Т.С. Вид: Электронный задачник ...Алгоритм решения задач с расчётами по химическим уравнениям
Задача: Определи объём воздуха, необходимый для сжигания 24 г магния, содержащего 10 % негорючих примесей. 2Mg + O2 = 2 MgO. Составь уравнение реакции: ...Обобщение по теме "Металлы"
Эпиграф. «Металлов много есть, но дело не в количестве В команде работящей металлической Такие мастера, такие личности! Преуменьшать нам вовсе не ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...8 класс Обобщение знаний по теме СЛОЖНЫЕ ВЕЩЕСТВА
Вещества Простые Сложные Металлы Неметаллы Оксиды Основания Кислоты Соли. ЭnОm. Сложные вещества, состоящие из двух элементов, один из которых кислород ...«Систематизация и обобщение знаний по теме «Типы химических реакций»»
1) Что называют химической реакцией? 2) По каким признакам можно утверждать, что произошла или происходит химическая реакция? 3) Какие условия необходимы ...«Своя игра» по химии
Необходим в составе костей скелета. Меню. Лечебные элементы 20. Дезинфектор ран. Лечебные элементы 40. Избыток ионов этого элемента может вызвать ...Консультация экспертов ЕГЭ по химии 2012 год
С1. Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O. 2 Cr+3 – 3e- → Cr+6 ок-е 3 Br2 + 2e- → 2Br -1 в-е. 3 6 16 8. C2-2012. Демо-2012. Соль, ...Анализ ЕГЭ по химии 2011
Уровни выполнения экзаменационной работы. неудовлетворительный – 0–31 / 0–12, удовлетворительный –32–56 / 13–35, хороший – 57–77 / 36–56, отличный ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Олимпиадные задачи по химии
Как войти в задачу. Олимпиадные задачи по неорганической химии. Вещество З – черно-серые кристаллы; легко образуют фиолетовые пары, обладающие резким ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Конспекты
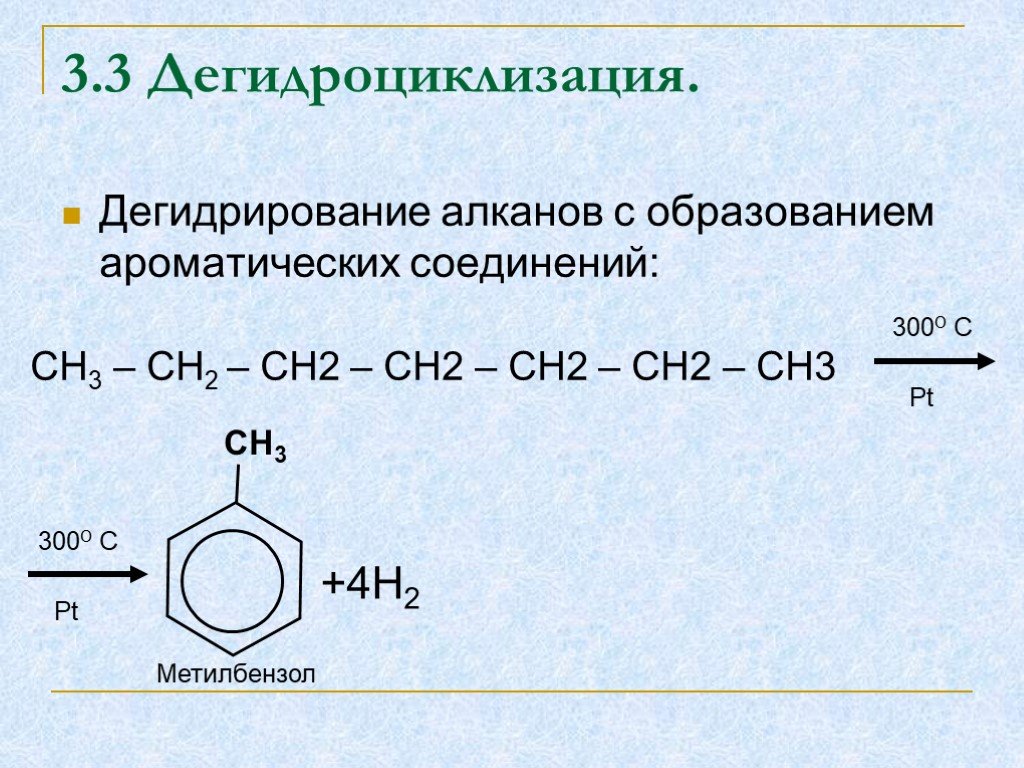
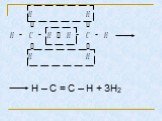
Строение, способы получения и свойства алканов
Тема урока: Строение, способы получения и свойства алканов. . . Цель урока:. Изучить. . способы получения, физические и химические свойства, ...Алканы. Гомологический ряд, изомеры, номенклатура, свойства и получение алканов Цели: Изучить алканы, как один из классов ациклических соединений
План учебного занятия №. 19. Дата Предмет. Химия. группа. Ф.И.О. преподавателя: Кайырбекова И.А. . Тема. :. Алканы. Гомологический ряд, изомеры, ...Расследование по теме
I Региональный конкурс профессионального мастерства педагогов. «Мой лучший урок» (ЕСТЕСТВЕННО-НАУЧНОЕ направление). Чернышёва Татьяна Викторовна, ...Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным оборудованием и нагревательными приборами
Муниципальное общеобразовательное бюджетное учреждение. «Средняя Общеобразовательная школа № 7. . г.Соль-Илецка»Оренбургской области. ...Правила техники безопасности при работе в химическом кабинете. Приёмы обращения с лабораторным оборудованием и нагревательными приборами
Муниципальное общеобразовательное бюджетное учреждение. «Средняя Общеобразовательная школа № 7. . г.Соль-Илецка»Оренбургской области. ...Составление химических формул по валентности
Муниципальное казённое общеобразовательное учреждение «Тальменская средняя общеобразовательная школа №1». Тальменского района Алтайского края. ...Вывод молекулярных формул органических веществ по продуктам сгорания
Львова Елена Михайловна. . Учитель-методист Почетный работник образования. КГУ гимназия город Балхаш Казахстан. Вывод молекулярных формул ...Решение задач по воде
Дата:. 14.03.14 г. Класс: 8 «А». Учитель:. Рощина Н.В. Роспись зам директора по УВР. __________________. Тема занятия № 4. Решение задач ...Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...методическая разработка урока по химии
Муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа села Алексеевка ». Базарно – Карабулакского района Саратовской ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:10 января 2019
Категория:Химия
Содержит:26 слайд(ов)
Поделись с друзьями:
Скачать презентацию