Презентация "Задачи по химии" – проект, доклад
Презентацию на тему "Задачи по химии" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 72 слайд(ов).
Слайды презентации
Список похожих презентаций
Задачи по химии для 10 класса
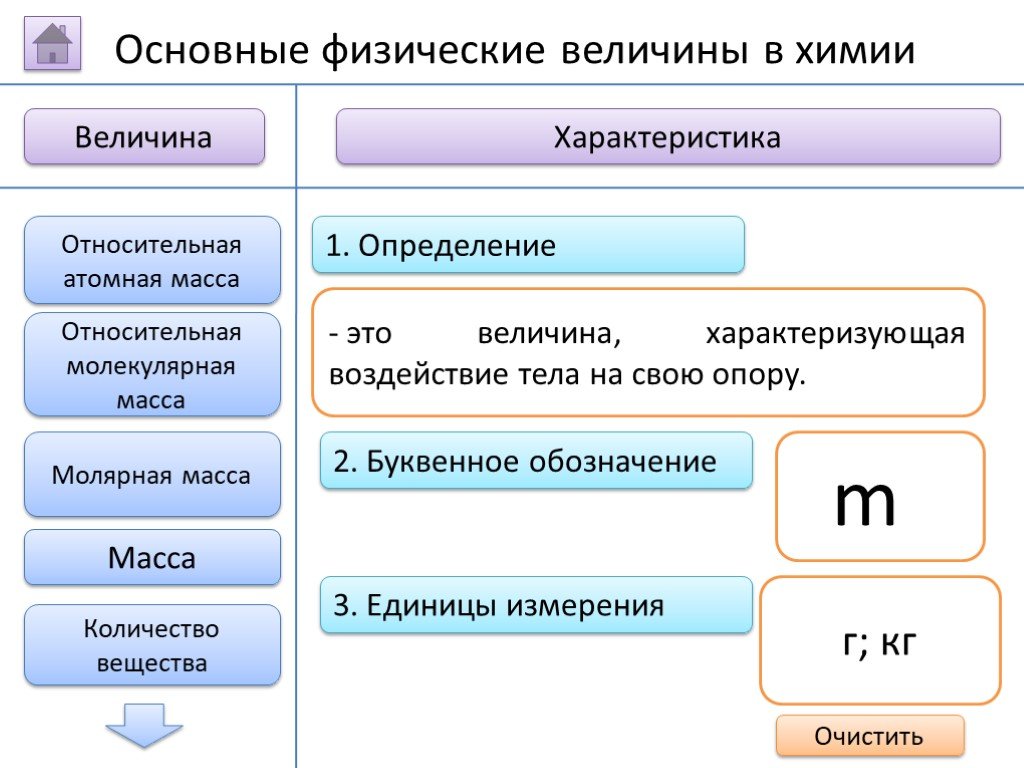
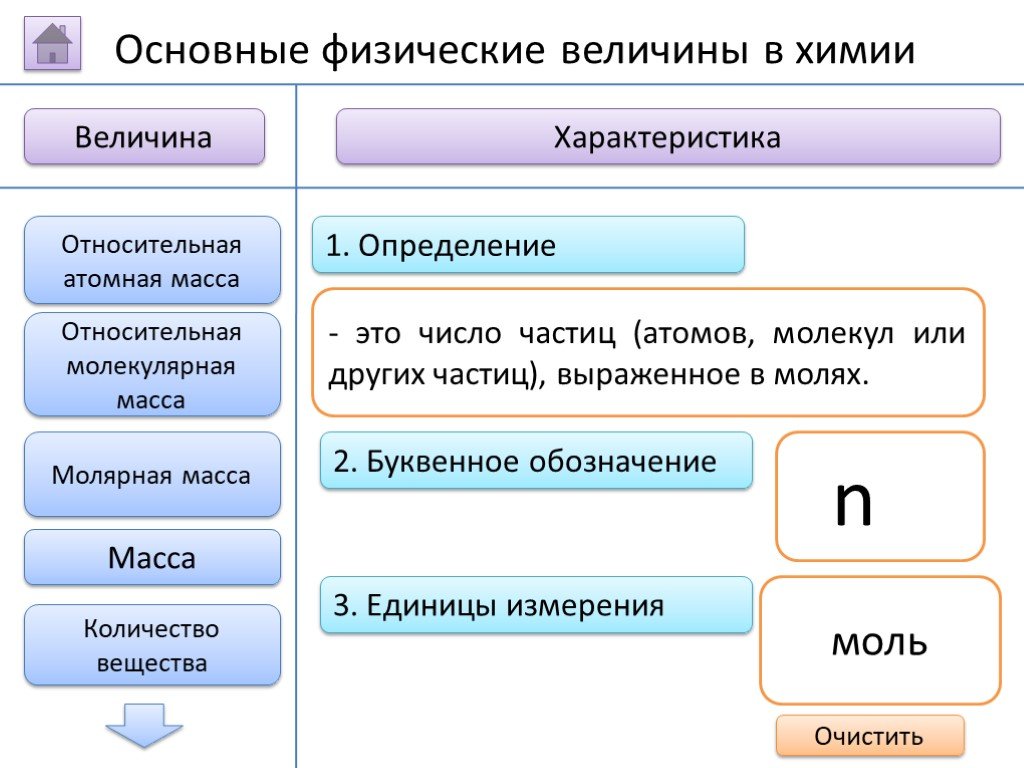
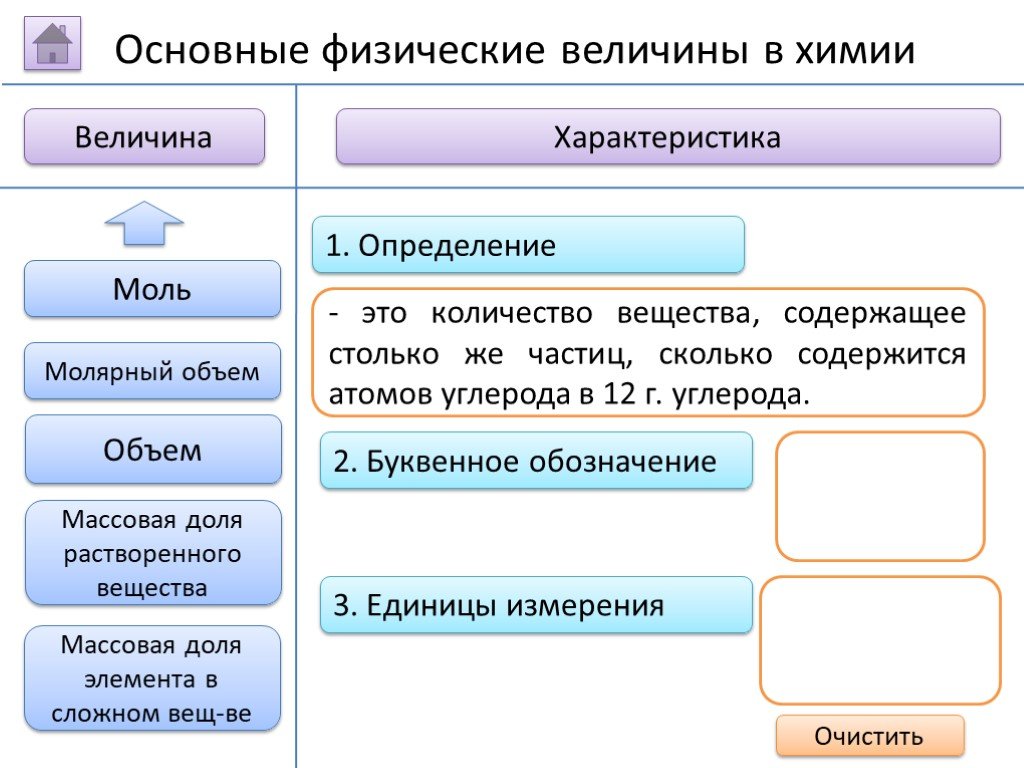
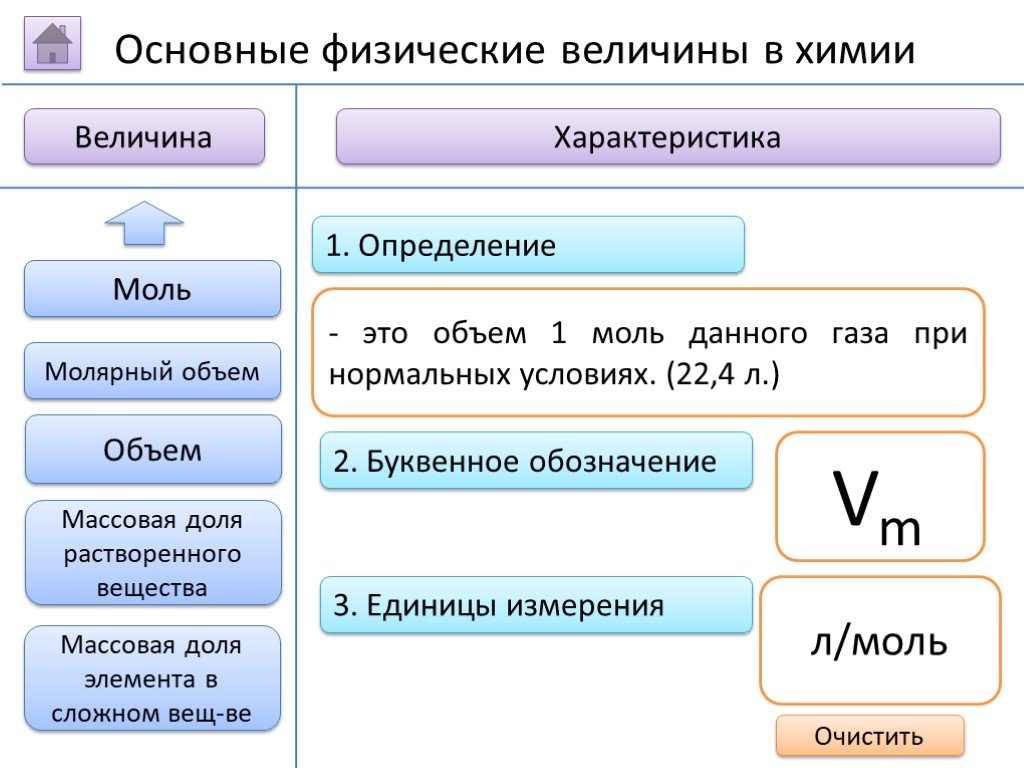
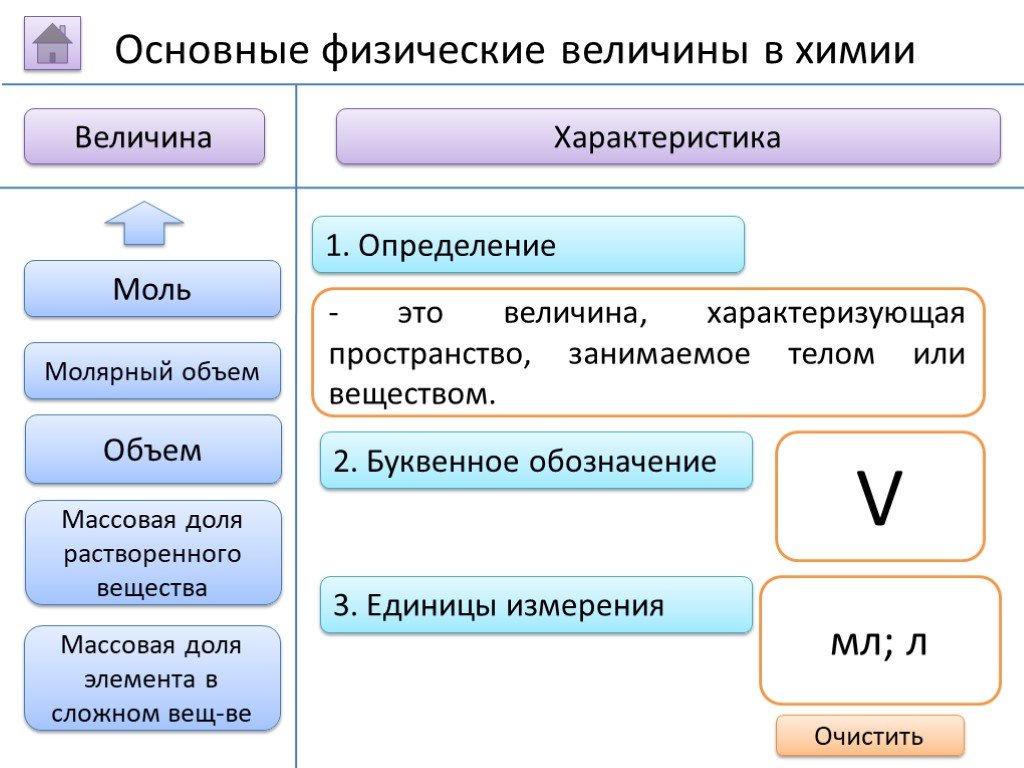
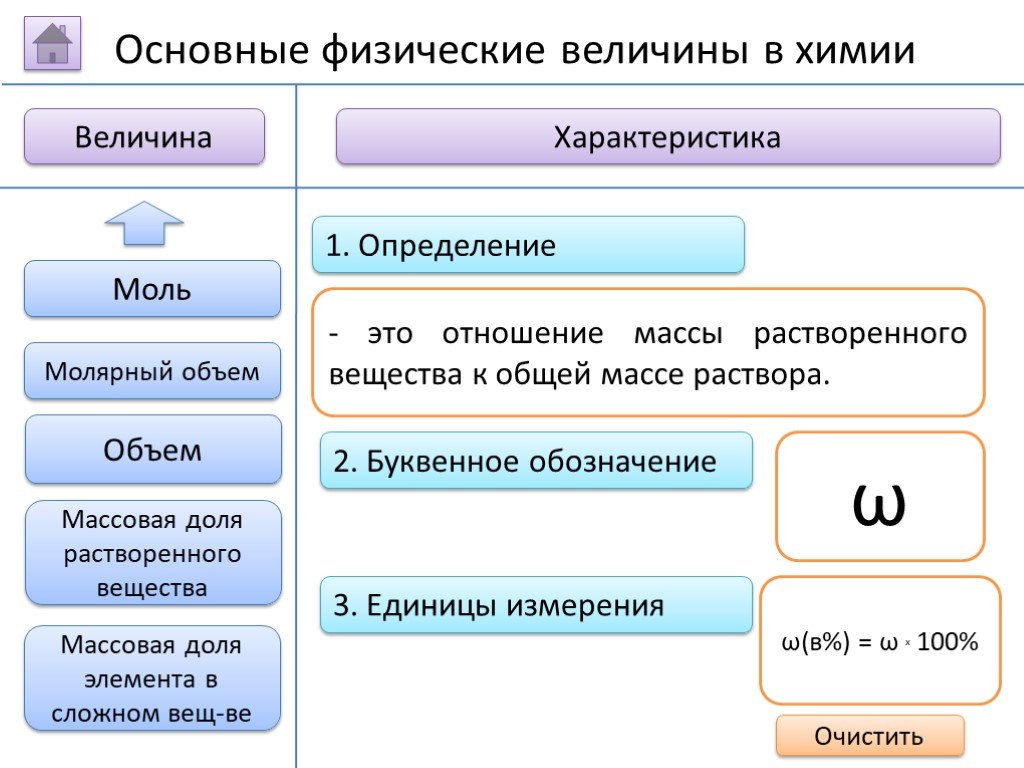
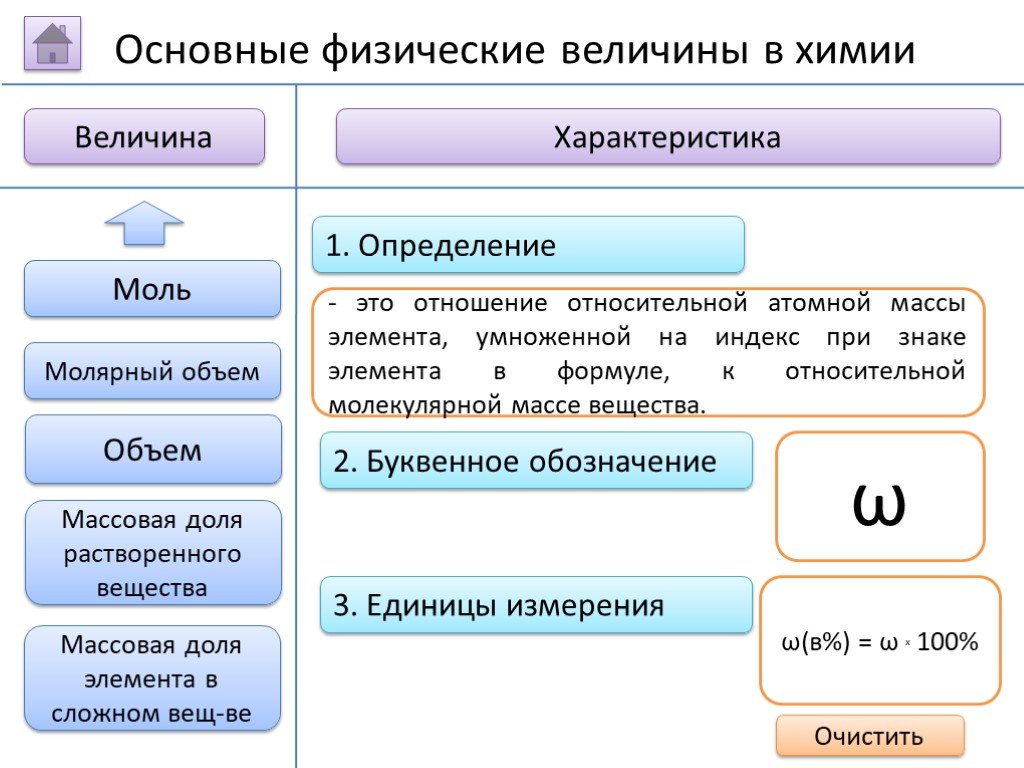
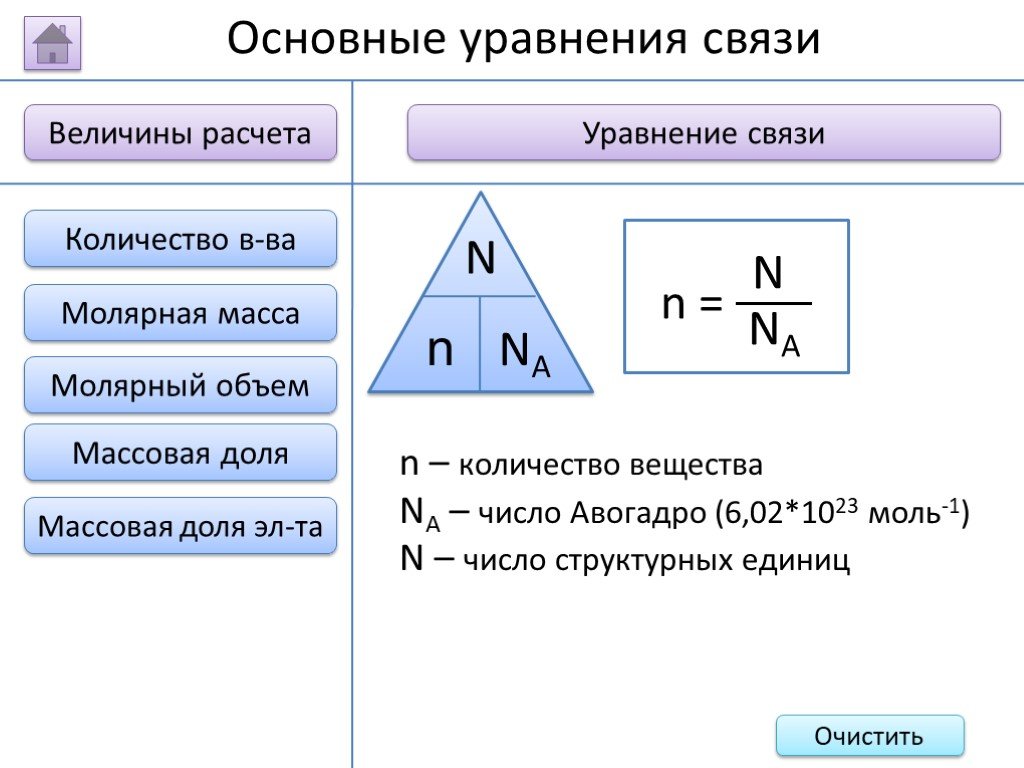
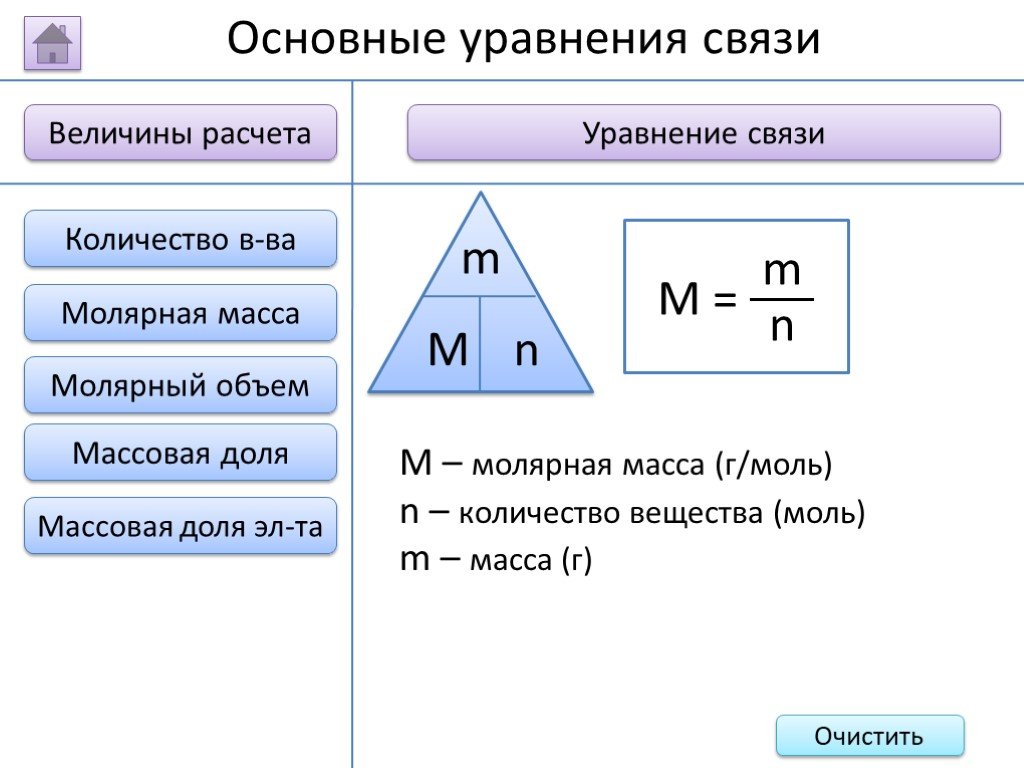
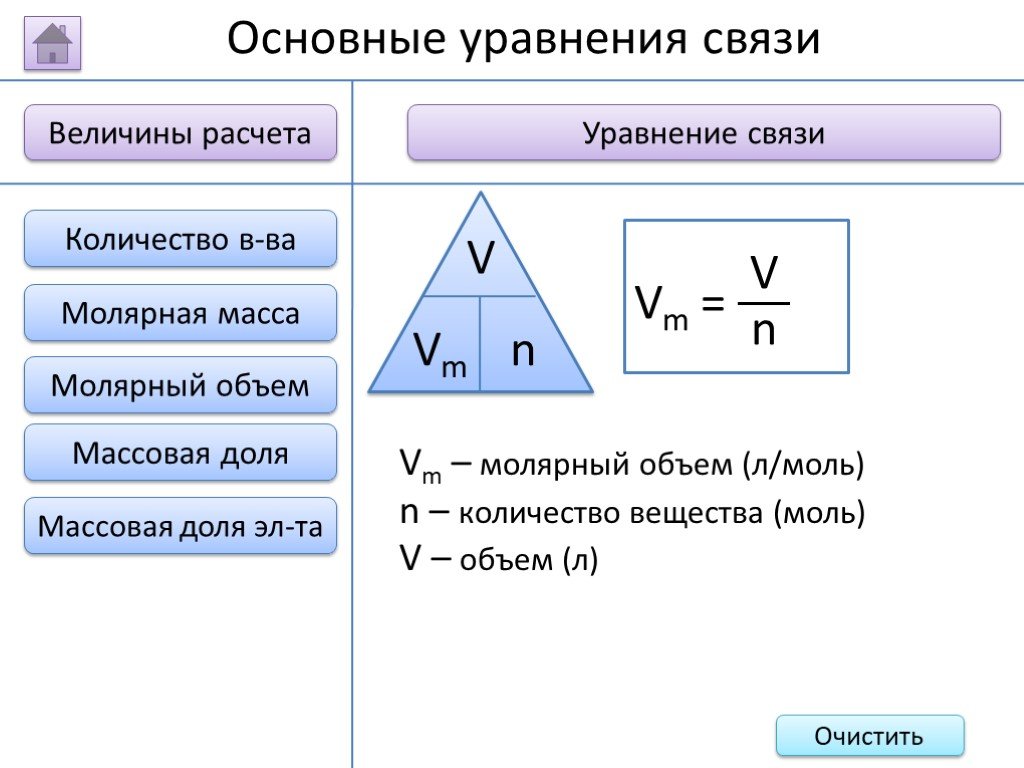
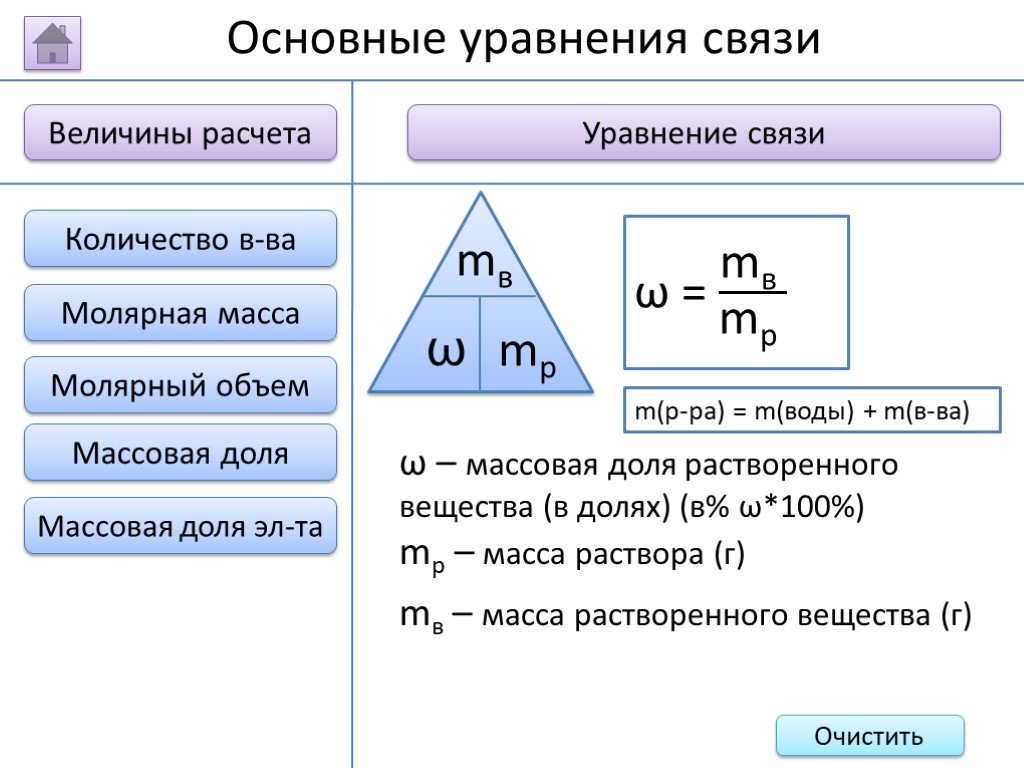
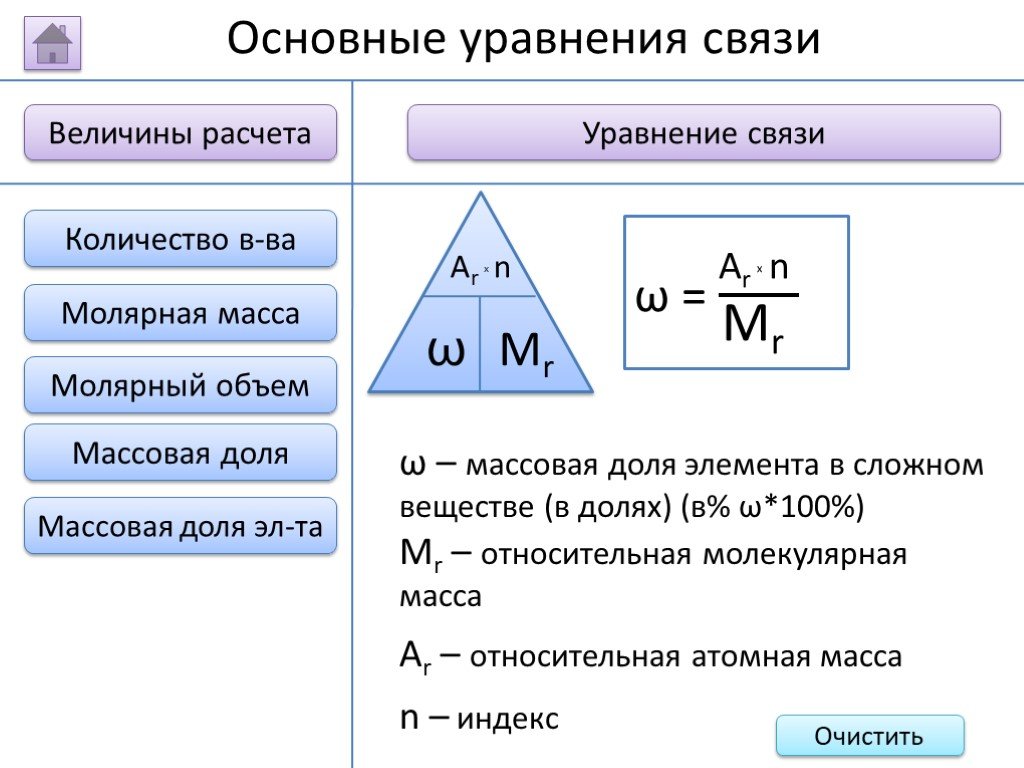
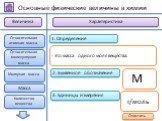
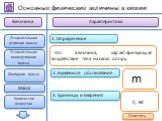
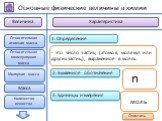
- на основании массовых долей (%) атомов элементов М где n - число атомов Определить химическую формулу соединения, имеющего состав: натрий – 27,06%; ...Занимательные задачи по химии
Физические и химические явления. Задача №1. Прочитайте отрывок из стихотворения С. Я. Маршака «Вчера и сегодня». Лампа плакала в углу, За дровами ...«Своя игра» по химии
Необходим в составе костей скелета. Меню. Лечебные элементы 20. Дезинфектор ран. Лечебные элементы 40. Избыток ионов этого элемента может вызвать ...«Деятельностно-компетентностный подход к преподаванию химии в средней школе через современные образовательные технологии»
КЛЮЧЕВЫЕ КОМПЕТЕНТНОСТИ. Общепредметные компетенции:. Предметные компетенции:. понятие о химии, как неотъемлемой составляющей естественно-научной ...Методы познания химии
09.09.2018. Метод (от греческого слова «методос» — путь к чему-либо) означает совокупность приемов и операций практического и теоретического освоения ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Химическая среда. Сама вода является очень слабым электролитом. При её электролитической диссоциации образуются катионы водорода и гидроксид-ионы ...Активизация обучающихся на уроках химии как показатель развития их мыслительной деятельности.
Приёмы активизации мыслительной деятельности обучающихся:. Приём стимулирующих звеньев Приём реконструкции Приём прогнозирования. Приём стимулирующих ...Алгоритм решения задач по химии
Алгоритм решения задач по химии:. Записать краткое условие задачи; *В случае необходимости произвести предварительный расчет; Перевести величины, ...Азотная кислота по химии
Тема: «Азотная кислота» Цель урока: Рассмотреть свойства азотной кислоты и области ее применения. План урока: 1. Проверка Д/З (письменная работа); ...Методика преподавания химии в школе. УМК по химии
Учебник. Дидактические материалы. 8 класс: 9 класс. Методическое пособие. Цифровые ресурсы. Лабораторный журнал. Учебная книга Задачник. Автор: Жилин ..."Гидролиз солей". Готовимся к ОГЭ и ЕГЭ по химии.
Содержание химии очень обширно и часто предстает копилкой огромного числа формул, уравнений, фактов и законов, запомнить которые не просто трудно, ...Анализ результатов ЕГЭ по химии 2010 (окружной семинар учителей химии)
Результаты ЕГЭ 2010. Граница минимального балла -33 тестовых балла (12 первичных баллов). Уровни оценивания: неудовлетворительный – 0–32 / 0–11; удовлетворительный ...Личностно – ориентированный подход в обучении химии
Когда людей станут учить не тому, что они должны думать, а тому как они должны думать, то тогда исчезнут всякие недоразумения. Г. Лихтенберг. Как ...Методические рекомендации по подготовке к ЕГЭ по химии
Кодификатор. Программа элективного курса «окислительно-восстановительные реакции». H2O2 H2SO4. «окислительно-восстановительные реакции в органической ...Консультация экспертов ЕГЭ по химии 2012 год
С1. Cr2(SO4)3 + Br2 + NaOH = = Na2CrO4 + NaBr + Na2SO4+ H2O. 2 Cr+3 – 3e- → Cr+6 ок-е 3 Br2 + 2e- → 2Br -1 в-е. 3 6 16 8. C2-2012. Демо-2012. Соль, ...Методика преподавания химии
ПРИМЕРНАЯ СХЕМА НАКОПЛЕНИЯ БАЛЛОВ. Самостоятельная домашняя работа. 7 – 9 неделя. Составление алгоритма выполнения заданий. Составление тематического ...Викторина по химии
1.Газ, который применили во время первой мировой войны в качестве химического оружия. 2. Единственный жидкий металл. 3.Русский учёный - энциклопедист. ...Викторина по химии "Что это?"
РЕБЯТА!!! ЗА МНОЙ!!! К ВИКТОРИНЕ «ЧТО ЭТО?». ОПРЕДЕЛЯЕМ, О КАКИХ ВЕЩЕСТВАХ ИДЕТ РЕЧЬ??? 1 2 4 5 6 7 8 9 10 11 12 ВЫБИРАЙ!! Трудно представить, что ...Викторина «Своя игра» по химии
Вопрос. Отечественный ученый, назвавший человека – «мощной геологической силой, способной изменить лик Земли»? Как называется нарушение природной ...Использование исследовательских и информационно-коммуникационных технологий в обучении химии
Период модернизации. Образование. Вчера Ориентировано на знания, умения, навыки, учебные достижения ученика Результат Человек знающий, обученный. ...Конспекты
Решение экспериментальных задач по органической химии
Конспект открытого урока . Практическая работа №4 «Решение экспериментальных задач по органической химии». Класс:10. УМК: Рудзитис Г.Е., ФельдманФ.Г. ...Обобщающее повторение по неорганической химии
Обобщающее повторение по неорганической химии за курс 8 класса. Разработан Савич Еленой Николаевной учителем биологии, химии Донецкой СШ с. Донецкое, ...Материалы для индивидуальной работы по химии
Предмет: химия. Учитель: Пестова Татьяна Михайловна. Класс: 8. Материалы для индивидуальной работы по химии. Индивидуальные задания разнообразны ...Развитие интеллекта и творческих способностей учащихся на уроках химии
Перед современной школой стоит задача воспитания грамотного, продуктивно мыслящего человека, адаптированного к условиям жизни в обществе. Проблема ...Задачи по теме «Галогены
Задачи по теме «Галогены». №1. Сколько миллилитров раствора с массовой долей соляной кислоты 36 % (пл. 1,2 г/мл) необходимо для взаимодействия 0,1 ...Развитие познавательной самостоятельности на уроках химии через составление химических задач
Развитие познавательной самостоятельности на уроках химии через составление химических задач. «Не мыслям надо учить, а мыслить…». . И.Кант. ...методическая разработка урока по химии
Муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа села Алексеевка ». Базарно – Карабулакского района Саратовской ...Лабораторные опыты по неорганической химии (свойства кислот, оснований, солей)
III. . . . Технологическая карта урока. ЭТАПЫ УРОКА. ДЕЯТЕЛЬНОСТЬ УЧИТЕЛЯ. . ДЕЯТЕЛЬНОСТЬ УЧЕНИКА. . 1.Организационный. . момент. ...Использование опорных схем на уроках химии
Муниципальное образовательное автономное учреждение средняя общеобразовательная школа с углубленным изучением отдельных предметов №1 г. Белогорск, ...Определение валентности элементов по формулам их соединений
Название образовательного учреждения:. Муниципальное казённое общеобразовательное учреждение. «Тальменская средняя общеобразовательная школа №1». ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:2 ноября 2018
Категория:Химия
Содержит:72 слайд(ов)
Поделись с друзьями:
Скачать презентацию