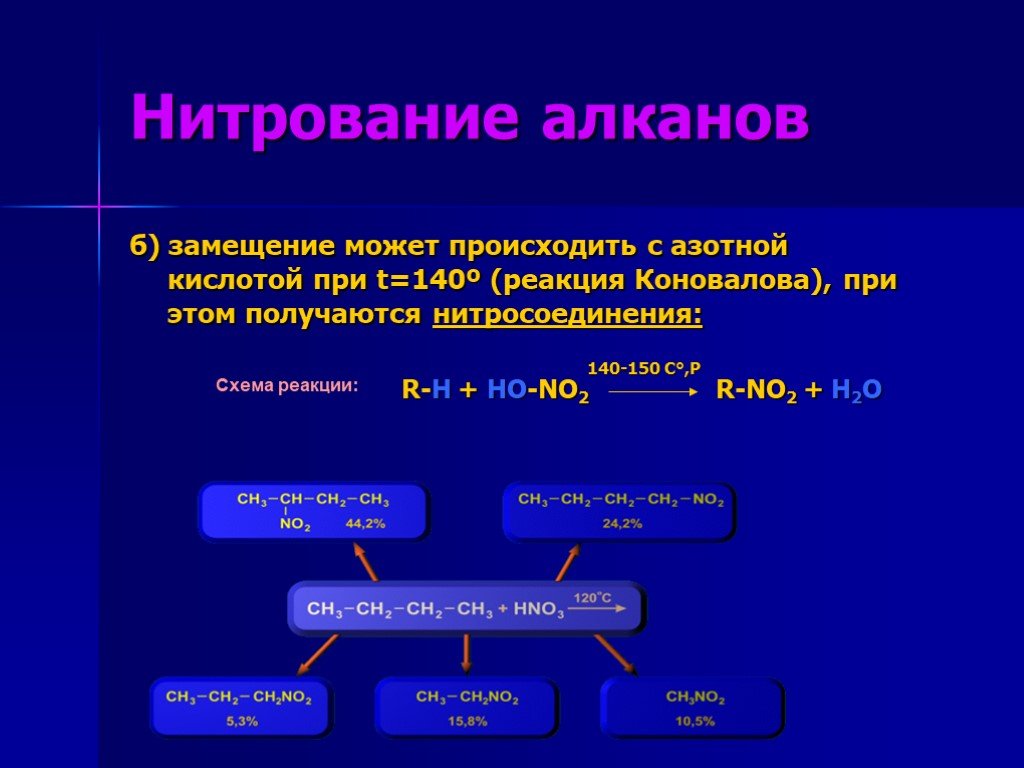
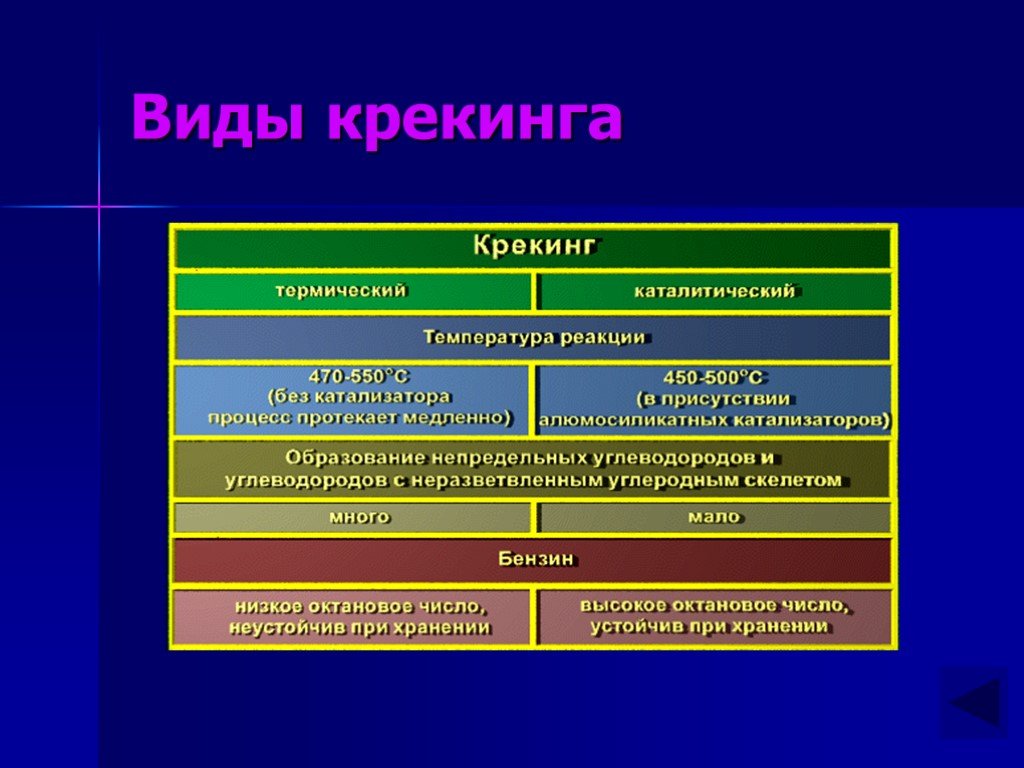
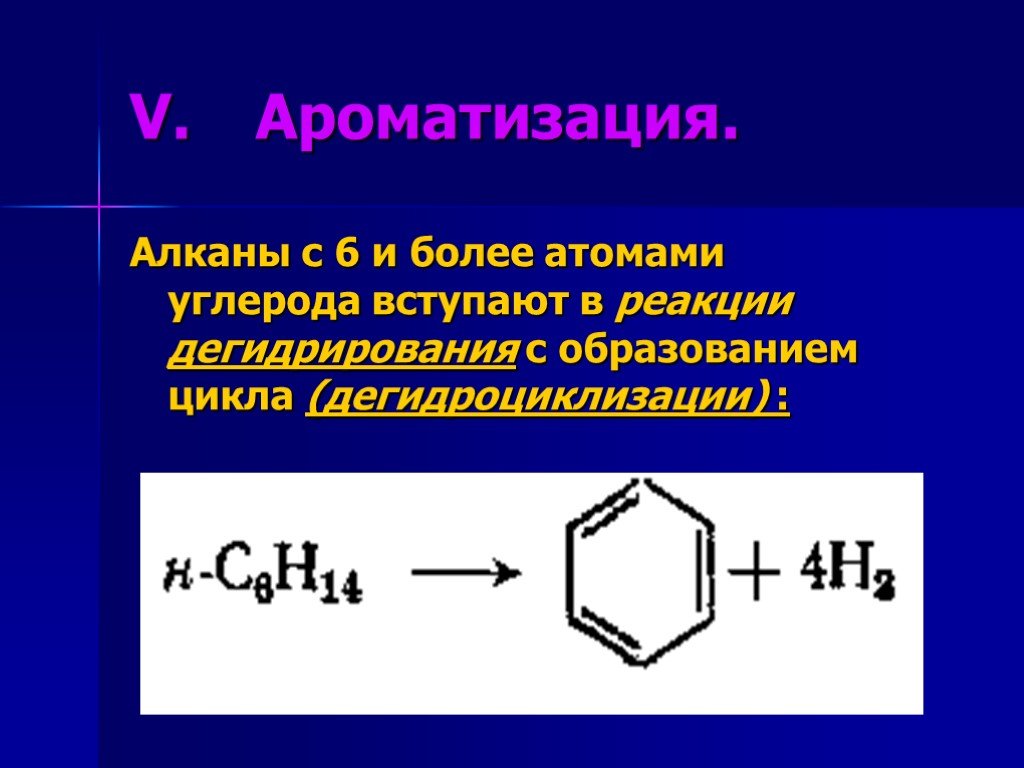
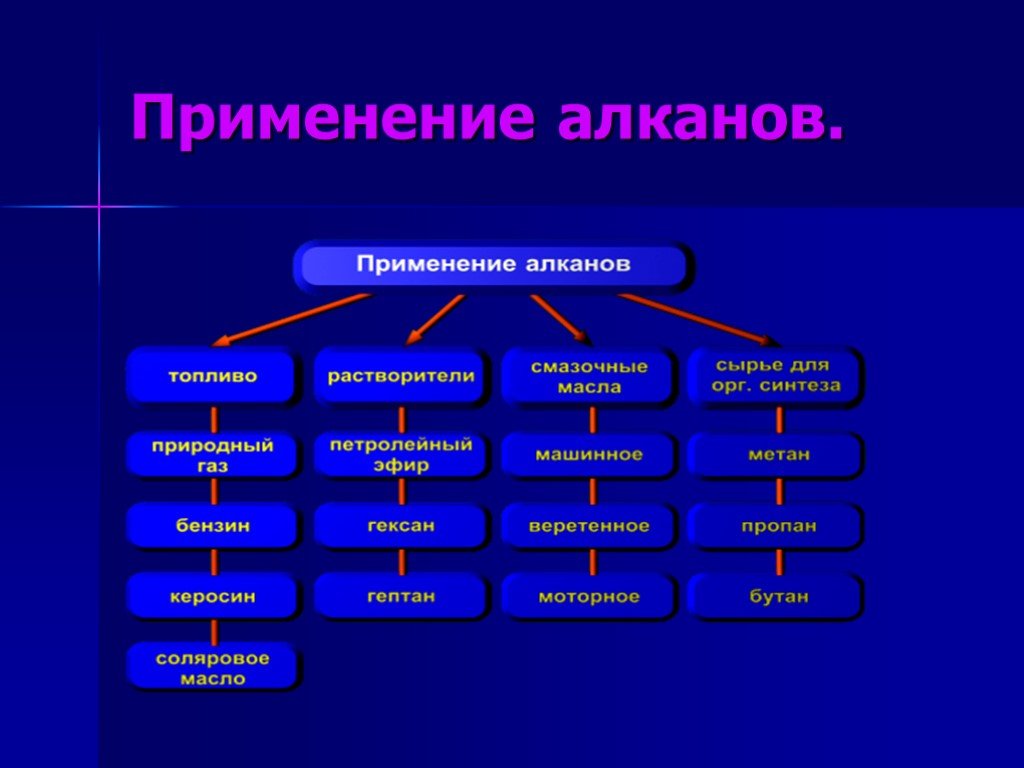
Презентация "Химические свойства алканов" по химии – проект, доклад
Презентацию на тему "Химические свойства алканов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Основания. Химические свойства оснований
Классификация оснований. Растворимые в воде (щелочи). Нерастворимые в воде. NaOH Ca(OH)2 Al(OH)3 Сu(OH)2. Название оснований. Гидроксид +. Название ...Основания. Химические свойства. Способы получения
Химические свойства. Гидроксид – ионы (ОН-), образующиеся при диссоциации оснований, обуславливают их химические свойства 1. Действие на индикаторы. ...Физические и химические свойства воды
Цели урока:. Изучить химические свойства воды. Начать формировать представления о важнейших классах неорганических соединений: кислотах и основаниях. ...Физические и химические свойства кислот. 8-й класс
Классификация кислот. 1. По составу (по наличию атомов кислорода). кислоты бескислородные. кислородосодержащие. HCl, HBr, HI, HF,H2S HNO3, H2SO4, ...Алкены. Строение. Изомерия. Химические свойства. Получение
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Физические и химические свойства кислот
Ожидаемые результаты:. Знать состав формул, определение кислот, индикаторов, физические и химические свойства кислот. Совершенствовать: учебные умения ...Физико-химические свойства алкинов
Физические свойства алкинов. С2 – С4 газы С5 – С 15 жидкости Свыше С16 – твердые вещества tпл и t кип алкинов увеличиваются с ростом молекулярной ...Алкены. Строение. Изомерия. Химические свойства
Элементный анализ этилена показывает, что в его состав входят примерно 87,5% углерода и 14,3% водорода. Плотность этилена по отношению к водороду ...Физические и химические свойства оснований
Цель урока:. Рассмотреть физические и химические свойства оснований. НАЗОВИТЕ ОСНОВАНИЯ:. Ca(OH)2 NaOH Zn(OH)2 Cu(OH)2 Fe(OH)3. СОСТАВЬТЕ ФОРМУЛЫ ...Физические и химические свойства бензола
Цель и задачи урока: систематизировать знания учащихся о строении молекулы бензола, о способах его получения; - сформировать представление о физических ...Алкины-способы получения и химические свойства
Тема и цели урока:. Тема: «Ацетилен. Алкины». Цель урока: Дать представления об углеводородах с тройной связью. О их физико-химических свойствах и ...Сера. Ее физические и химические свойства
«В древней магии присутствую при рождении огня, называют серой издавна меня". 1вариант –О2 2вариант-О3. Газ без запаха Проявляет окислительные и восстановительные ...Металлы. Химические и физические свойства металлов
Физические свойства металлов. Очень важным свойством металлов является их сравнительно легкая механическая деформируемость. Металлы пластичны, они ...Понятие об углеводах. Моносахариды. Химические свойства глюкозы
Классификация углеводов. Углеводы Cn(H2O)m Моносахариды Дисахариды Полисахариды. Моносахариды – углеводы, не подвергающиеся гидролизу. триозы тетрозы ...Кремний, его физические и химические свойства
Цели урока: - рассмотреть положение кремния в периодической системе Д.И.Менделеева и строении его атома; - рассмотреть нахождение кремния в природе; ..."Электрохимический ряд напряжений металлов. Общие химические свойства металлов". 11-й класс
Цель урока:. Повторить и обобщить общие химические свойства металлов с учетом их положения в ЭХРНМ. Задачи урока:. Повторить общие химические свойства ...Получение и свойства алканов
ПОЛУЧЕНИЕ АЛКАНОВ:. ФРАКЦИОННАЯ ПЕРЕГОНКА НЕФТИ Нефть поступает в ректификационные колонны на атмосферную перегонку (перегонку при атмосферном давлении), ...Альдегиды получение, применение, физические и химические свойства
Парфюмерная продукция. Верхние ноты: бергамота, нероли, лимона Средние ноты: ландыша, ириса, жасмина Базовые ноты: мускуса, ванили, сандалового дерева. ...Получение и свойства алканов
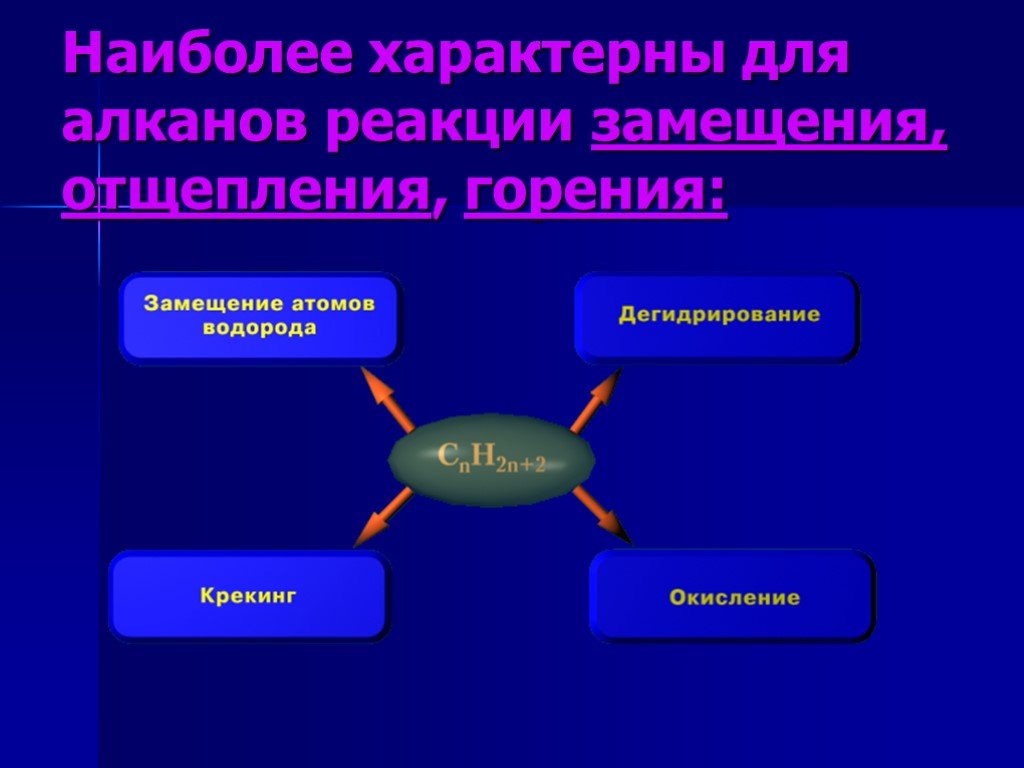
Оглавление. Определение Гомологического ряд метана Строение молекулы метана Номенклатура Изомерия Получение Физические свойства Химические свойства ...Карбоновые кислоты в природе, химические свойства, применение
План конференции:. 1. «мозговой штурм» 2. Блицопрос 3.Презентация (часть1): номенклатура, строение, классификация 4. Пресс-конференция 5. Презентация ...Конспекты
Соли, их классификация и химические свойства в свете теории электролитической диссоциации
Муниципальное общеобразовательное учреждение. . средняя общеобразовательная школа №2. г. Алексеевки Белгородской области. Конспект ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Химические свойства солей
. Зайчикова Ирина Николаевна. МБОУ «Пригородная СОШ». Учитель химии, биологии. Разработка урока по химии в 8 классе «Химические свойства ...Химические свойства щелочных металлов
. МБОУ «Леплейская СОШ». Урок на тему:. «Химические свойства щелочных металлов». Класс:9. Продолжительность урока:45 ...Химические свойства углерода. Адсорбция
Дата_____________ Класс_______________. Тема:. . Химические свойства углерода. Адсорбция. Цели урока:. знать понятие адсорбции, применение углерода; ...Химические свойства соединений щелочных и щелочноземельных металлов. Жесткость воды
Муниципальное общеобразовательное учреждение. Бельская средняя общеобразовательная школа. г. Белый Тверской области. Конспект урока по химии ...Химические свойства солей
Методическая разработка к уроку химии. по теме «Химические свойства солей». Цель урока:. На основании знаний учащихся о свойствах оксидов, кислот ...Химические свойства серной кислоты
. Химические свойства серной кислоты. Данный урок- презентация по теме « Химические свойства серной кислоты» позволяет реализовать ...Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические и химические свойства алюминия
Дата_____________ Класс_______________. Тема: Алюминий. Положение алюминия в периодической системе и строение его атома. Нахождение в природе. Физические ...Алюминий, его физические и химические свойства
План – конспект урока. Тема урока:. Алюминий, его физические и химические свойства. Тип урока:. изучение нового материала. Цель:. обучающиеся ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:20 февраля 2019
Категория:Химия
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию