Презентация "Азот. Аммиак" по химии – проект, доклад
Презентацию на тему "Азот. Аммиак" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 14 слайд(ов).
Слайды презентации
Список похожих презентаций
Аммиак
Строение молекулы. Водородная связь. Водородная связь – это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных ...Аммиак
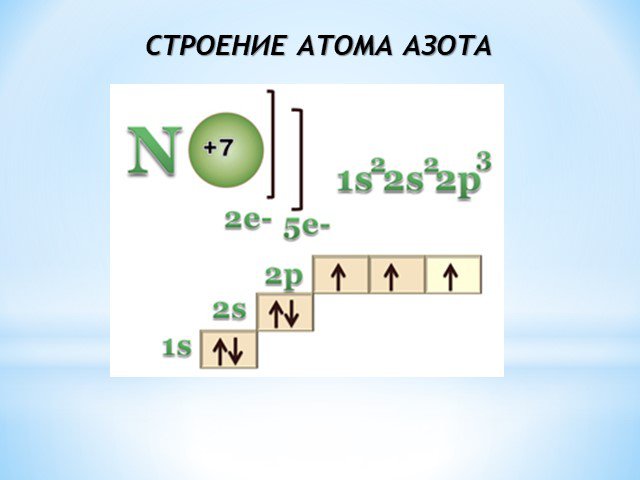
Состав вещества Строение Свойства Применение Получение аммиак. +7N ) ) 2 5 2s2.электронная формула.
1s2.
валентные возможности.
III, IV +1H ) ...
Аммиак
Проблемно- исследовательский урок химии в 9-м классе. Аммиак. План урока. 1. Актуализация знаний. 2. Значение связывания азота. 3. Строение молекулы ...Азот
Проблемно-поисковый метод урока Цели урока:. Закрепить знания учащихся о строении атома и молекулы азота; Изучить физические и химические свойства ...Аммиак
Из истории химических имён. Строение молекулы аммиака. Физические свойства аммиака. Действие на организм. Правила обращения с аммиаком. Химические ...Аммиак NH3
Содержание. Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические ...Общая характеристика элементов VA-группы. Азот
Элементы VA-группы. Элементы VА-группы. Общая электронная формула: […] ns 2 (n–1)d 10np 3. Степени окисления: –III, 0, +III, +V. Валентные возможности: ...Азот и фосфор-характеристика
V группа А подгруппа. К элементам этой подгруппы относятся: N ; P ; As ; Sb; Bi. Особенно большое значение имеют азот и фосфор Азот входит в состав ...Азот урок химии
ЦЕЛИ :. Сформировать представление о строении атома и молекулы азота. Рассмотреть физические и химические свойства азота в свете ОВР. Показать значение ...Азот и его свойства
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот и его соединения
Содержание. Открытие Происхождение названия Круговорот азота в природе Азот в природе Получение Свойства Соединения азота Применение. Открытие. В ...Азот (N2)
Азот (от греч. azoos - безжизненный, лат. Nitrogenium), N, химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная ...Азот
История открытия азота:. В 1772 г. Англичанин Д. Резерфорд установил, что воздух, оставшийся под колоколом, где жила несколько дней мышь, освобожденный ...Азот
ИСТОРИЯ ОТКРЫТИЯ. 1772г. К.Шееле и Г.Кавендиш получили азот Д.Резерфорд описал получение и свойства 1787г. Лавуазье предложил название азот – «безжизненный» ...Аммиак
… NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха. ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Аммиак
Аммиак – это.. — NH₃, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом. Плотность аммиака почти вдвое меньше, ...Аммиак
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Аммиак
Аммиак NH3 – это самое важное из водородных соединений азота. В чистом виде аммиак впервые был собран в конце XVIII в. англичанином Дж. Пристли. Однако ...Конспекты
Круговорот азота в природе. Аммиак
Урок 18. Круговорот азота в природе. Аммиак. Цели урока:. 1. Рассмотреть нахождение азота в природе, его биологическую роль, круговорот в природе. ...Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, физические и химические свойства, получение и применение
Дата_____________ Класс_______________. Тема:. . Положение азота и фосфора в периодической системе химических элементов, строение их атомов. Азот, ...Аммиак
Васильева Ирина Александровна, «СОШ № 1» г. Белоярский, учитель химии и биологии. . Урок химии в 9 классе. Тема: «Аммиак». Цель урока: изучение ...Аммиак
. ПЛАН-КОНСПЕКТ УРОКА. . Аммиак. (Тема урока). . ФИО (полностью). . . Панова Людмила Валентиновна. . . . Место работы. ...Аммиак
МБОУ Нижнеангарская средняя общеобразовательная школа №1. Открытый урок по теме «Аммиак». 9 «Б» класс. Учитель Живоглядова Валентина Михайловна. ...Аммиак
Селиверстова Ольга Александровна,. учитель химии, МОУ СОШ № 64, г. Волгограда. «Аммиак». Разработка урока химии для 9 класса с использованием ...Азот положение в ПСХЭ. Строение атома и молекулы. Физические и химические свойства
Опорный конспект по теме: «Азот положение в ПСХЭ. . Строение атома и молекулы. Физические и химические свойства. I. .Положение азота в ПСХЭ:. ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия №32». Конспект урока по химии в 9 классе. тема урока " Азот". ...Азот
Тема урока: Азот. . . (Первый уровень). Интегрирующая цель:. . . - знать физические и химические свойствах азота, показать значение азота ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:29 мая 2016
Категория:Химия
Содержит:14 слайд(ов)
Поделись с друзьями:
Скачать презентацию