Презентация "Аммиак" (10 класс) по химии – проект, доклад
Презентацию на тему "Аммиак" (10 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Аммиак
Аммиак (в европейских языках его название звучит как «аммониак») своим названием обязан оазису Аммона в Северной Африке, расположенному на перекрестке ...Аммиак состав, строение, свойства, применение
Аммиак может быть обязан своим названием оазису бога Аммона в Северной Африке, находящемуся на перекрестке караванных путей. В очень жарком климате ...Аммиак
Аммиак – это.. — NH₃, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом. Плотность аммиака почти вдвое меньше, ...Аммиак NH3
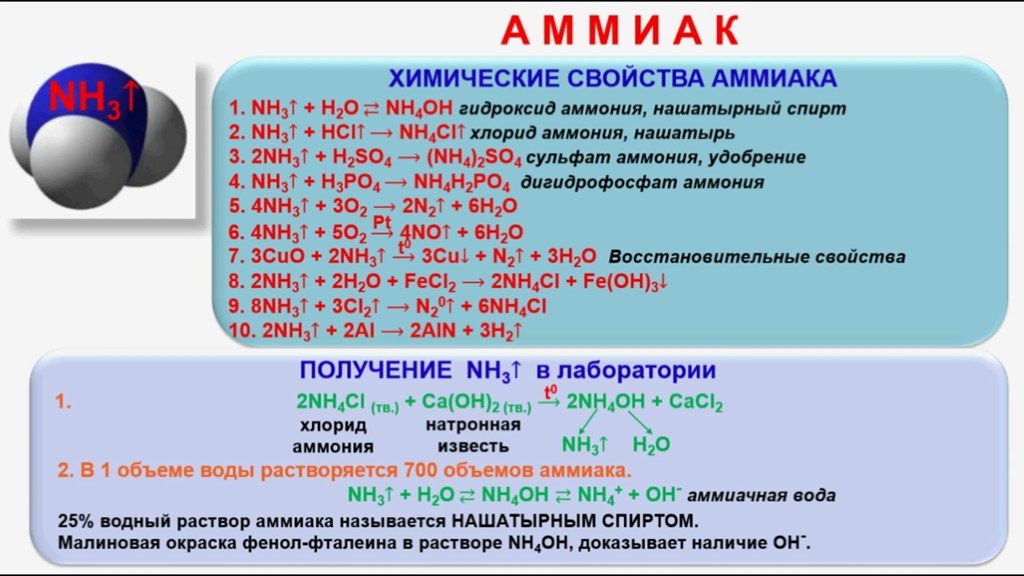
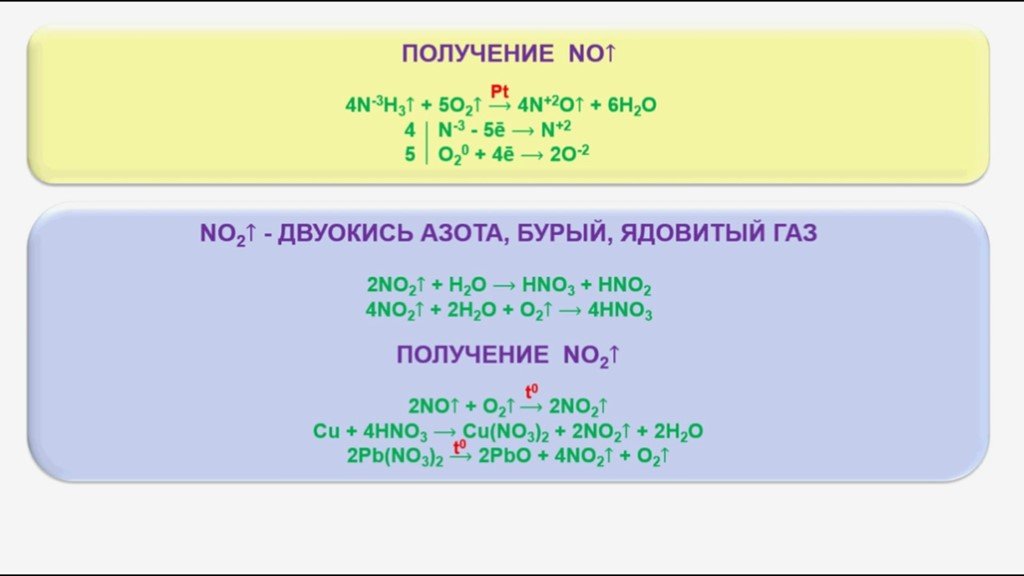
Содержание. Строение атома азота. Образование молекулы аммиака. Строение молекулы аммиака. Физические свойства. Способы получения аммиака. Химические ...Аммиак
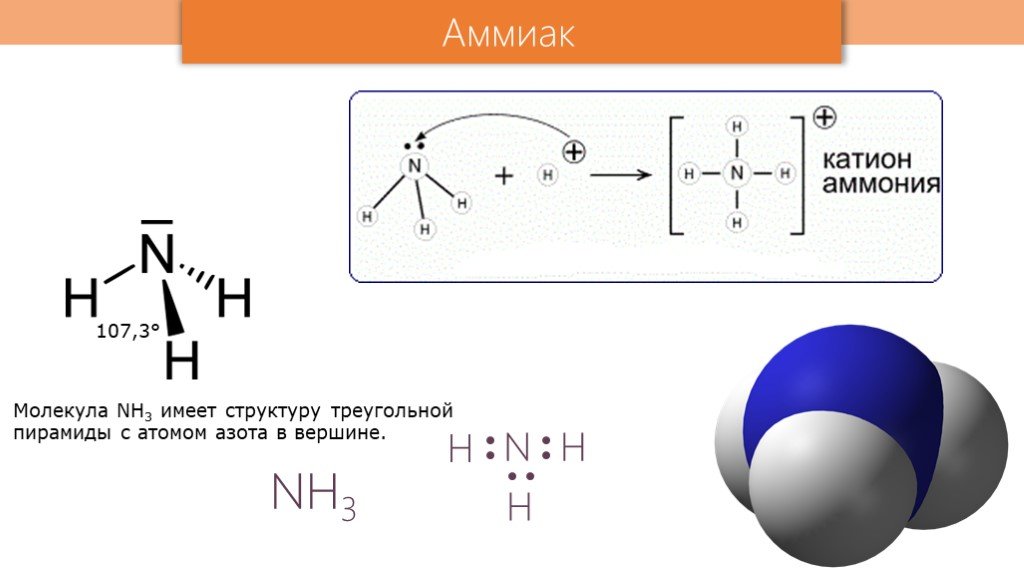
Строение молекулы. Водородная связь. Водородная связь – это химическая связь между атомами водорода одной молекулы и атомами очень электроотрицательных ...Аммиак
… NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха. ...Аммиак
Проблемно- исследовательский урок химии в 9-м классе. Аммиак. План урока. 1. Актуализация знаний. 2. Значение связывания азота. 3. Строение молекулы ...Аммиак
Состав вещества Строение Свойства Применение Получение аммиак. +7N ) ) 2 5 2s2.электронная формула.
1s2.
валентные возможности.
III, IV +1H ) ...
Аммиак
Из истории химических имён. Строение молекулы аммиака. Физические свойства аммиака. Действие на организм. Правила обращения с аммиаком. Химические ...Азот. Аммиак
СТРОЕНИЕ АТОМА АЗОТА. Распростаненность азота Азот, в форме двухатомных молекул N2 составляет большую часть атмосферы, где его содержание составляет ...«Электролитическая диссоциация» химия
Электролитическая диссоциация. H2O. Процесс распада электролита на ионы при растворении его в воде или расплавлении называется электролитической диссоциацией. ...«Окислительно-восстановительные реакции» химия
СОДЕРЖАНИЕ:. 1. Какие реакции называются окислительно-восстановительными? 2. Что называют окислителем, восстановителем? 3. Окислительно-восстановительный ...«Нуклеиновые кислоты» химия
Цель урока: сформировать у студентов понимание взаимосвязанности и взаимозависимости веществ в клетке. Задачи урока: повторить строение и основные ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...«Жиры» химия
жиры. Оглавление. Определение и общая формула Физические свойства Химические свойства Классификация жиров Животные жиры Растительные жиры Роль жиров ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Химический состав клетки. Неорганические соединения
Что же до первоначал, то они еще больше имеют Средств для того, чтоб из них возникали различные вещи, Нет ни одной из вещей, доступных для нашего ...Коллоидная химия
3 Пособия. Лекции, конспекты практических занятий. Фридрихсберг Д.А. Курс коллоидной химии. Л., «Химия». 1984. 368 с. Сумм Б.Д. Коллоидная химия. ...Токсикологическая химия
Токсикологическая химия. Токсикологическая химия – это наука о химических превращениях токсических веществ и их метаболитов в организме, методах их ...Аналитическая химия
Цель программы:. Фундаментальная подготовка магистрантов в области аналитической химии со знанием современных физико-химических методов анализа (хроматографических, ...Конспекты
Круговорот азота в природе. Аммиак
Урок 18. Круговорот азота в природе. Аммиак. Цели урока:. 1. Рассмотреть нахождение азота в природе, его биологическую роль, круговорот в природе. ...Аммиак
Васильева Ирина Александровна, «СОШ № 1» г. Белоярский, учитель химии и биологии. . Урок химии в 9 классе. Тема: «Аммиак». Цель урока: изучение ...Аммиак
. ПЛАН-КОНСПЕКТ УРОКА. . Аммиак. (Тема урока). . ФИО (полностью). . . Панова Людмила Валентиновна. . . . Место работы. ...Аммиак
МБОУ Нижнеангарская средняя общеобразовательная школа №1. Открытый урок по теме «Аммиак». 9 «Б» класс. Учитель Живоглядова Валентина Михайловна. ...Аммиак
Селиверстова Ольга Александровна,. учитель химии, МОУ СОШ № 64, г. Волгограда. «Аммиак». Разработка урока химии для 9 класса с использованием ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:24 февраля 2019
Категория:Химия
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию