Слайд 1Теория электролитической диссоциации. Протолитическая теория кислот и оснований. Специальность: «Лабораторная диагностика» Дисциплина: «Химия» Преподаватель: Шакурова Н.С. 2010 г.
ГАОУ СПО «Казанский медицинский колледж»
Электронный дидактический материал информационного типа на тему:
Слайд 2Содержание ЭДМ
Введение. Требования ГОС. Цели занятия. Электролиты. Неэлектролиты С.Аррениус-основоположник теории электролитической диссоциации Основные положения электролитической диссоциации Гидратация ионов Механизм электролитической диссоциации. Степень диссоциации (ионизации) Сильные и слабые электролиты Факторы, влияющие на диссоциацию Константа диссоциации (ионизации)
Слайд 313. Диссоциация кислот 14. Диссоциация оснований 15. Диссоциация амфотерных гидроксидов 16. Диссоциация солей 17.Электролитическая диссоциация комплексных и двойных солей 18. Протонная теория кислот и оснований 19. Диссоциация воды. рН 20. Реакции обмена в водных растворах электролитов 21. Ионные реакции и уравнения 22. Термины и определения 23. Литература.
Слайд 4Введение
Электронный дидактический материал на тему: «Теория электролитической диссоциации. Протолитическая теория кислот и оснований» предназначен для проведения контроля знаний, практических умений и навыков, самостоятельной работы студентов медицинских училищ и колледжей СМОУ РТ и РФ. Рекомендации по работе с ЭДМ: 1. Ознакомьтесь с требованиями ГОС по данной теме 2. Изучите информационный материал занятия. 3. Выучите термины и определения. 4. Выполните задания для закрепления знаний по учебнику Ерохин Ю.М. Сборник задач и упражнений - стр.-55 вопросы 1-12; упр.1-14.

Слайд 5Требования ГОС к уровню подготовки специалистов в области химии для специальности «Лабораторная диагностика»
После изучения темы «Теория электролитической диссоциации. Протолитическая теория кислот и оснований». студент должен ЗНАТЬ: основные положения теории электролитической диссоциации; понятия: электролитическая диссоциация, сильный и слабый электролит, степень и константа диссоциации, кислота и основания Бренстеда; роль электролитов в процессах жизнедеятельности организма.
Слайд 6Цели занятия
Учебная: добиться прочного усвоения системы знаний, формирование практических умений и навыков. Развивающая: формирование навыков самообразования, самореализации личности и развитие речи, мышления, памяти. Воспитательная: привитие умений и навыков учебной работы и коллективного труда. Формирование у студентов целостного миропонимания и современного научного мировоззрения.
Слайд 7Электролиты. Неэлектролиты
Водные растворы солей, кислот и оснований проводят электрический ток. Аналогично ведут себя расплавы солей и щелочей. В то же время водные растворы и расплавы многих органических веществ, например сахарозы, глюкозы, ацетона, этилового спирта и других, не проводят электрический ток.
Слайд 8По способности проводить электрический ток в водном растворе или в расплаве все вещества можно разделить на электролиты и неэлектролиты. Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток.
Слайд 9К электролитам относятся соли, кислоты и основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Слайд 10Неэлектролитами называют вещества, водные растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества. В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Слайд 11В 1887г. Шведский учёный С.Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации. В дальнейшем эта теория была развита многими учёными, в том числе И.А. Каблуковым и В.А. Кистяковским.
Сванте Аррениус
С.Аррениус-основоположник теории электролитической диссоциации
Слайд 12Основные положения электролитической диссоциации
1.Молекулы электролитов при растворении в воде или расплавлении распадаются на ионы. Процесс распада молекул электролитов на ионы в водном растворе или в расплаве называется электролитической диссоциацией или ионизацией.
Слайд 13Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд. Ионы могут быть простые (Na+, Mg2+ , S2-, Cl- ): сложные (SO32-, NH4+, SO42-, PO43-).
Слайд 142. В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду).
Слайд 15Положительные ионы называются катионами, отрицательные ионы-анионами. К катионам относятся ион водорода Н+, ион аммония NH4+, ионы металлов Na+, K+, Fe2+,Fe3+, Al3+, катионы основных солей CuOH+, A1(OH)2+, FeOH2+ К анионам относятся гидроксид-ион ОН-, ионы кислотных остатков I-, Вr-, Сl-, NO3-, SO32-, Сr2О7 ; кислых солей НСО3-, Н2РО4-, Н2РО4-
Слайд 16Диссоциация многих электролитов —процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация или диссоциация) и соединение ионов в молекулы (ассоциация или моляризация).
Слайд 17Диссоциацию молекул электролитов выражают уравнениями, в которых ставят знак обратимости ( ). В левой части уравнения электролитической диссоциации записывают формулу молекулы электролита, а в правой — формулы образующихся ионов.
Слайд 18Уравнение диссоциации азотистой кислоты HNO2 записывается таким образом: ионизация (диссоциация) НNO2 H+ + NO2- моляризация (ассоциация) Общая сумма зарядов катионов равна общей сумме зарядов анионов, так как растворы и расплавы нейтральны.
Слайд 19Гидратация ионов
Электролитическая диссоциация в растворе происходит за счет сложного физико-химического взаимодействия молекул растворителя с электролитом.
Слайд 20Согласно химической теории растворов Д.И. Менделеева, при растворении веществ в воде происходит химическое взаимодействие растворенного вещества с молекулами воды.
Слайд 21В результате взаимодействия растворенного вещества с молекулами воды образуются химические соединения -гидраты. И.А. Каблуков развил это положение Д.И. Менделеева, впервые высказав мысль о возможной гидратации не только молекул, но и ионов, которые особенно склонны к гидратации. Соединяясь с молекулами воды, ионы становятся гидратированными и более устойчивыми.
Слайд 22Механизм электролитической диссоциации.
I. Диссоциация электролитов с ионной связью. При растворении в воде ионных соединений, например, хлорида натрия, его ионы, находящиеся в узлах кристаллической решетки, взаимодействуют с диполями воды. При этом положительные полюсы молекул воды притягиваются к отрицательным хлорид-ионам С1-, отрицательные полюсы - к положительным ионам натрия Na+.
Слайд 23Между ионами электролита и диполями воды возникают силы взаимного притяжения, которые оказываются прочнее межионных связей в кристалле. В результате связь между ионами в кристалле ослабляется, кристаллическая решетка ионного соединения разрушается, и ионы в гидратированном виде переходят в раствор NaCl Na+ + Cl-
Слайд 24При растворении в воде веществ НС1 происходит ориентация диполей воды и возникают междипольные связи. В результате такого диполь-дипольного взаимодействия изменяется характер химической связи в молекуле НС1.
Механизм электролитической диссоциации
Диссоциации электролитов с полярной ковалентной связью.
Слайд 25Связь в молекуле электролита становится более полярной, а затем превращается в ионную. Эта связь легко разрывается с образованием гидратированных ионов, которые переходят в раствор. Главной причиной диссоциации молекул электролитов на ионы в водных растворах является гидратация ионов.
Слайд 26Степень диссоциации (ионизации)
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично. Большая часть их молекул остается в растворе в недиссоциированном виде. В растворах таких электролитов одновременно присутствуют ионы и недиссоциированные молекулы растворенного вещества.
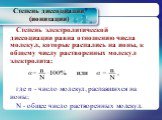
Слайд 27Для количественной характеристики соотношения диссоциированных и недиссоциированных молекул электролита используют понятие «степень электролитической диссоциации». Степень диссоциации обозначают буквой «α» и часто выражают в процентах, реже в долях единицы.
Слайд 28Степень электролитической диссоциации равна отношению числа молекул, которые распались на ионы, к общему числу растворенных молекул электролита: где n - число молекул, распавшихся на ионы; N - общее число растворенных молекул.
Слайд 29Степень диссоциации зависит от природы растворителя и природы растворенного вещества. Одно и то же вещество в одних растворителях может вести себя как электролит, в других — как неэлектролит.
Слайд 30Молекулы серной кислоты H2SO4 хорошо диссоциируют в воде, слабее в этаноле и совсем не диссоциируют в бензоле. Это объясняется тем, что вода является одним из наиболее полярных растворителей, этанол — слабополярный, а бензол — неполярный растворитель.
Слайд 31Сильные электролиты — это такие электролиты, для которых степень диссоциации в водных растворах равна 1 (100%). К сильным электролитам относятся: 1. Практически все соли; 2. Кислоты - НС1О4, НС1О3, HNO3, H2SO4, HMnO4, H2Cr2О7, HI, HBr, НС1, H2CrО4; 3. Щелочи- LiOH, NaOH, KOH, CsOH, RbOH, Ca(OH)2 ,Sr(OH)2, Ba(OH)2.
Сильные и слабые электролиты
Слайд 32Слабые электролиты — это такие электролиты, для которых степень диссоциации в водных растворах меньше 1 (100%).
Слайд 33К слабым электролитам относятся: 1. Слабые кислоты - НС1О2, НС1О, HNO2, H2CO3, H2SiО3, H3PO4, HF, H3BO3; CH3COOH, H3S, HCN 2. Слабые малорастворимые в воде основания и амфотерные гидроксиды: Fe(OH)2 Fe(OH)3 Cu(OH)2 Pb(OH)2, A1(OH)3, Cr(OH)3; 3. Вода Н2О. 4. NH4 OH.
Слайд 34Принадлежность вещества к сильным и слабым электролитам нельзя связывать с его растворимостью. Например, хлорид серебра AgCl имеет очень низкую растворимость в воде, однако вся растворившаяся соль находится в растворе в виде ионов Ag+ и С1-, поэтому AgCl относят к числу сильных электролитов.
Слайд 35Газ аммиак NH3 очень хорошо растворяется в воде, но только часть молекул NH3 взаимодействуют с водой с образованием ионов NH4+ и ОН-. Значит гидроксид аммония является слабым электролитом.
Слайд 36Степень ионизации электролита зависит от его концентрации в растворе. Разбавление раствора ведет к повышению степени диссоциации электролита, потому что с уменьшением его концентрации уменьшается вероятность встречи ионов в растворе. Повышение концентрации электролита в растворе понижает степень его ионизации.
Факторы, влияющие на диссоциацию
Слайд 37Степень ионизации зависит и от изменения температуры раствора электролита. При повышении температуры степень диссоциации электролита увеличивается.
Слайд 38С повышением температуры энергия молекул увеличивается, химическая связь в них ослабляется, что облегчает процесс диссоциации электролитов, то есть их распад на ионы. И наоборот, понижение температуры уменьшает степень ионизации электролита.
Слайд 39На степень диссоциации влияет добавление одноименных ионов к раствору слабого электролита. Например, если к раствору уксусной кислоты СН3СО-ОН прилить раствор ацетата натрия CH3COONa, то равновесие обратимого процесса диссоциации уксусной кислоты СН3СООН СН3СОО- + Н+ согласно принципу Ле-Шателье смещается влево. Поэтому степень диссоциации уксусной кислоты уменьшается.
Слайд 40Константа диссоциации (ионизации)
Для количественной характеристики слабых электролитов применяют константу диссоциации (К). Любая обратимая реакция характеризуется константой равновесия. В случае диссоциации константу равновесия называют константой диссоциации (Кд) или константой ионизации.
Слайд 41Для слабого электролита общей формулы: AnBm AnBm пАm+ + mBn- согласно закону действия масс, в состоянии равновесия, константа диссоциации равна: Кд=[Аm+]n ∙ [Bn-]m [AnBm]
Слайд 42Величина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит. Например: Кд(СН3СООН)=[СН3СОО-] ∙ [Н+] = 2∙10-5; [СН3СООН] Кд(HCN)= [Н+] ∙ [CN-] = 7∙10-10 при25°С. [HCN]
Слайд 43Из значений констант диссоциации этих кислот видно, что уксусная кислота приблизительно в 30 000 раз сильнее диссоциирует, чем циановодородная кислота. Константа диссоциации не зависит от концентрации раствора.
Слайд 44Для любой концентрации раствора электролита величина константы ионизации постоянна, но изменяется с изменением температуры. Понятие константы диссоциации для сильных электролитов не имеет смысла, так как в водных растворах они полностью диссоциируют на ионы.
Слайд 45Диссоциация кислот
Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н+. Например: H2SO4 = 2Н++ SO42- Слабые многоосновные кислоты (H2SO3, Н2СО3, H2S, Н3РО4) диссоциируют ступенчато и характеризуются несколькими константами диссоциации.
Слайд 46Число ступеней диссоциации равно основности слабой кислоты. На первой ступени диссоциации сероводородной кислоты: H2S Н+ + HS-, К΄д=[Н+] ∙ [HS-] = 6,0 ∙10-8 [H2S]
Слайд 47На второй ступени диссоциации от сложного гидросульфид-иона HS- отщепляется катион водорода Н+по уравнению: HS- Н+ + S2-, К΄΄д(HS-)= [Н+] ∙ [S2-] = 1,0 ∙10-14. [HS-]
Слайд 48К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14 [HS-] Сравнение величин К΄д и К˝д показывает, что диссоциация по второй ступени протекает в значительно меньшей степени, чем по первой.
Слайд 49Диссоциация оснований
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН-. Например: NaOH = Na++ OH-
Слайд 50Слабые многокислотные основания диссоциируют ступенчато и характеризуются несколькими константами диссоциации. Число ступеней диссоциации равно кислотности слабого основания. Рb(ОН)2 РbОН2++ОН- д=[РbОН+] ∙ [ОН-] =9,6 ∙10-4(tо=25оС ) [Рb(ОН)2 ]
Слайд 51На второй ступени диссоциации происходит отщепление гидроксид-иона от сложного катиона РbОН+ Рb(ОН)2 РbОН2++ОН-
Слайд 52Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями, то есть имеют двойственные свойства. Двойственный характер амфотерных гидроксидов объясняет теория электролитической диссоциации.
Диссоциация амфотерных гидроксидов
Слайд 53Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н+ и гидроксид-анионы ОН-, т. е. диссоциируют по типу кислоты и по типу основания. 2Н++ZnO22- H2ZnO2 Zn(OH)2 Zn2++2ОН - диссоциация в растворе диссоциация по типу кислоты Zn(OH)2 по типу основания (осадок)
Слайд 54Диссоциация солей
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка. Например: Al2(SO4)3 2А13+ + 3SО42-
Слайд 55Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток. Например: NaHCO3 Na+ + НСО3- (α = 1) Гидрокарбонат-ион в незначительной степени диссоциирует по уравнению: НСО3- Н+ + СО3- (α
Слайд 56В водных растворах кислых солей содержатся следующие ионы: катионы металла Меn+, катионы водорода Н+, сложные анионы, содержащие атомы водорода и анионы кислотного остатка Ах-.
Слайд 57Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы, состоящие из атомов металла и гидроксогрупп ОН-. Fe(OH)2Cl Fe(OH)2+ + Cl- (α = 1) Fe(OH)2+ FeOH2+ + ОH- (α
Слайд 58Основные соли, как и кислые соли, сначала диссоциируют как сильные электролиты. Незначительно диссоциируют сложные ионы. В водных растворах основных солей находятся ионы: катионы металла Меn+, сложные катимы, содержащие гидроксогруппы, анионы кислотного остатка Асх- и анионы гидроксогрупп ОН-.
Слайд 59Электролитическая диссоциация комплексных и двойных солей
Электролитическая диссоциация комплексных солей в водных растворах происходит по двум ступеням. I ступень: диссоциация на комплексный и простой ионы с сохранением внутренней сферы комплекса. II ступень: диссоциация внутренней сферы, приводящая к разрушению комплекса.
Слайд 60Диссоциация по первой ступени происходит по типу диссоциации сильных электролитов, а диссоциация комплексного иона — по типу диссоциации слабых электролитов. Например: [Ag(NH3)2]Cl [Ag(NH3)2]++C1- (сильный электролит) [Ag(NH3)2]+ Ag+ + 2NH30 (слабый электролит)
Слайд 61Двойные соли могут существовать только в твердом виде, так как в водном растворе они диссоциируют на катионы двух металлов (или аммония) и анионы кислотного остатка: KA1(SO4)2 = К+ + А13+ + 2SO4 2- NH4Fe(SO4)2 = NH4+ + Fe3+ + 2SO4 2-
Слайд 62Протонная теория кислот и оснований
В 1923 г. И. Бренстед и Т. Лоури разработали протонную теорию кислот и оснований. Кислотой называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны отдавать протон, т. е. быть донором протонов; основанием называют всякое вещество, молекулярные частицы которого (в том числе и ионы) способны присоединять протоны, т.е. быть акцептором протонов.
Слайд 63Определения кислот и оснований позволяют включать в их число не только молекулы, но и ионы. Например, карбонат-ион согласно протонной теории является основанием, так как в водном растворе он присоединяет протон: CO32- + Н+ НСО3-
Слайд 64Согласно протонной теории кислоты подразделяют на три типа: нейтральные кислоты, например НС1, Н2SО4 Н3РО4 H2SO4 Н+ + HSO4- 2) катионные кислоты, представляющие собой положительные ионы, например NH4+ Н3О+: NH4+ NH3 + Н+
Слайд 65анионные кислоты, представляющие собой отрицательные ионы, например HSO4-, Н2РО4-, Н2РО2- H2SO4- Н+ + SO42- Подобного типа классификация имеется и для оснований: 1) нейтральные основания, например HCl, NH3, Н2О, С2Н5ОН NH3 + Н+ NH4+
Слайд 662) анионные основания, представляющие собой отрицательные ионы, например: С1-, СН3СОО-, ОН-: СН3СОО- + Н+ СН3СООН катионные основания, представляющие собой положительные ионы, например H2N—NH3+.
Слайд 67Растворители типа воды, жидкого аммиака, а также анионы многоосновных кислот, которые могут быть и донорами и акцепторами протонов, являются амфолитами. Например, в реакции Н2О + NH3 ОН- + NH4+ молекула воды отдает протон и является кислотой.
Слайд 68В реакции Н2О + НС1 Н3О+ + Сl- молекула воды присоединяет протон и является основанием. Таким образом вода — типичный амфолит.
Слайд 69Процесс диссоциации (ионизации) вещества происходит в контакте с растворителем. При этом растворитель выполняет функцию кислоты или функцию основания. Например, при растворении аммиака вода — кислота NH3 + Н2О NH4+ + ОН- При растворении водородфторида вода — основание HF + Н2О F- + Н3О+
Слайд 70Если сродство к протону у растворителя больше, чем у растворенного вещества, то растворитель выступает как основание (сродство к протону Н2О больше сродства к протону HF), а если оно меньше — как кислота (сродство к протону Н2О меньше сродства к протону NH3).
Слайд 71Согласно протонной теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте: I.(кислота)1 (сопряженное основание)1 + Н+ т. е. каждой кислоте соответствует сопряженное основание. Наоборот, основание, присоединяя протон, превращается в сопряженную кислоту: II.(основание)2 + Н+ (сопряженное основание)2
Слайд 72Кислотно - основное равновесие
Протон в растворах не существует в свободном виде, кислота может отдать протон только основанию, которой приняв протон, становится кислотой. Поэтому, согласно протонной теории имеет место кислотно-основное (КО) равновесие, обусловленное переносом протона (сумма процессов I и II по Гессу): III.(кислота)1+ (основание)2 (кислота)2 + (основание)1
Слайд 73Для краткости обратимый процесс кислотно-основного взаимодействия называют КО-равновесием. Реакции нейтрализации, ионизации, гидролиза с точки зрения протонной теории являются частными случаями КО-равновесий.
Слайд 74Реакция I типа СН3СООН + Н2О СН3СОО-+ Н3О+, протекающая в прямом направлении, представляет ионизацию уксусной кислоты, в обратном же направлении — нейтрализацию какого-либо ацетата, например, натрий ацетата сильной кислотой.
Слайд 75Реакция II типа NН4++ Н2О NH3 + H3O+, протекающая в прямом направлении, показывает гидролиз какой-либо соли аммония, а в обратном направлении — нейтрализацию аммиака сильной кислотой. В этих кислотно-основных равновесиях вода играет роль основания.
Слайд 76Будучи амфолитом в других кислотно-основных равновесиях, она может выполнять и роль кислоты, например: Н2О + СН3СОО- СН3СООН + ОН- Здесь прямая реакция кислотно-основного равновесия представляет гидролиз ацетата, а обратная — реакцию нейтрализации уксусной кислоты сильным основанием.
Слайд 77Протолитические кислотно-основные равновесия III типа могут иметь место не только в воде, но и в других растворителях, например, в жидком аммиаке: СН3СООН + NН3 СН3СОО- + NH4+ в безводном HF: С2Н5ОН + HF С2Н5ОН2+ + F-
Слайд 78Теория Бренстеда, как и теория Аррениуса, не применима к веществам, проявлявшим функцию кислоты, но не содержащих водорода, например, галогенидам бора, алюминия, кремния, олова. Поэтому более общей является электронная теория кислот и оснований Льюиса.
Слайд 79Диссоциация воды. рН
Вода как слабый электролит в незначительной степени диссоциирует на ионы Н+ и ОН-, которые находятся в равновесии с недиссоциированными молекулами Н2О -Н+ + ОН-. Опытом установлено, что в 1 л воды при комнатной температуре (22°С) диссоциации подвергаются лишь 10-7 моль и при этом образуется 10-7 моль/л ионов Н+ и10-7 моль/л ионов ОН-.
Слайд 80Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре Кв — величина постоянная. Численное значение его при температуре 22°С равно 10-14: Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14
Слайд 81Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять концентрацию Н+-ионов, если известна концентрация гидроксид-ионов ОН-, и наоборот. Если в водном растворе [Н+]= 10-3 моль/л, то [ОН-] определяется так:
Слайд 82Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН . Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов: рН = -lg[H+] где [Н+] концентрация ионов водорода, моль/л.
Слайд 83С помощью рН реакция растворов характеризуется так: нейтральная рН =7, кислая рН 7. Чем меньше рН, тем больше концентрация ионов Н+ т. е. выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
Слайд 84Существуют различные методы измерения рН. Качественно реакцию среды и рН водных растворов определяют с помощью индикаторов. Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды раствора, т. е. рН раствора. На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин.
Слайд 85Реакции обмена в водных растворах электролитов
Многие химические реакции протекают в водных растворах. Если в этих реакциях участвуют электролиты, то следует учитывать, что они находятся в водном растворе в диссоциированном состоянии, т. е. или только в виде ионов (сильные электролиты) и частично в виде молекул (слабые электролиты).
Слайд 86Реакции между водными растворами электролитов — это реакции, в которых участвуют ионы. Поэтому такие реакции называются ионными реакциями. Эти реакции возможны только в том случае, если между ионами происходит химическое взаимодействие.
Слайд 87Ионы одного электролита связываются с ионами другого электролита с образованием: а) нерастворимого вещества; б) газообразного вещества; в) малодиссоциирующего вещества (слабый электролит). г) комплексного соединения.
Слайд 88Ионные реакции и уравнения
При составлении ионных уравнений реакций следует руководствоваться тем, что вещества малодиссоциированные, малорастворимые (выпадающие в осадок) и газообразные изображаются в молекулярной форме.
Слайд 89Сильные растворимые электролиты, как полностью диссоциированные, пишутся в виде ионов. Например: AgNO3 + HCl = AgCl↓ + HNO3 Ag+ + NО3- + H+ + Cl- = AgCl↓ + H+ + NO3- Ag++ Cl- = AgCl↓ Na2CO3+H2SO4=Na2SO4+CO2↑+H2O 2Na++CO32-+2H++SO42-=2Na++SO42-+CO2↑+H2O CO32-+2H+= CO2↑+H2O
Слайд 90Термины и определения
Гидратация- взаимодействие веществ с водой, характеризующееся тем, что молекула воды присоединяется к исходной частице полностью. Гидраты- соединения, образовавшиеся в процессе присоединения воды к молекулам, атомам или ионам. Диполь-дипольное взаимодействие-взаимодействие между противоположно заряженными концами двух полярных связей или двух полярных молекул.
Слайд 91Диссоциация электролитическая(ионизация)-распад электролитов растворах или расплавах на составляющие их ионы. Ионизация-процесс образования ионов из нейтральных частиц атомов, радикалов, молекул. Ионы- электрически заряженные атомы ( простые атомы) или группы атомов(комплексные или многоатомные ионы).
Слайд 92Сольватация - взаимодействие частиц (молекул и ионов). Электроды- твердые фазы, характеризующиеся электрической проводимостью и находящиеся в контакте с электролитом. Электролит- вещество, водный раствор или расплав которого проводит электрический ток.
Слайд 93Литература
1. Л.М. Пустовалова, И.Е. Никанорова. Общая химия – Ростов-на-Дону: Феникс, 2005г. 2. Ершов, В. А. Общая химия. Биофизическая химия: учеб. для вузов-3-е изд.-М.: высш. шк., 2002. 3. Бабков А.В. Химия: учебник для студ. сред.мед. учеб. заведений.-М.: издательский центр «Академия», 2003г.
Слайд 944. Барковский Е.В. Аналитическая химия: учеб. пособие- Мн.: высш. шк., 2004г. 5. Глинка Н.Л. Общая химия. Учебное пособие.-Интеграл-пресс.-2008г. 6. Хаускофт К., Констебл Э. Современный курс общей химии. В 2-х т. пер. с англ. М: Мир, 2002г. 7. Слесарев В.И. Химия: Основы химии живого: Учебник для вузов. – 3-е изд., испр. – СПб: Химиздат, 2005.






































































































































![Для слабого электролита общей формулы: AnBm AnBm пАm+ + mBn- согласно закону действия масс, в состоянии равновесия, константа диссоциации равна: Кд=[Аm+]n ∙ [Bn-]m [AnBm] Для слабого электролита общей формулы: AnBm AnBm пАm+ + mBn- согласно закону действия масс, в состоянии равновесия, константа диссоциации равна: Кд=[Аm+]n ∙ [Bn-]m [AnBm]](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen41.jpg)
![Величина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит. Например: Кд(СН3СООН)=[СН3СОО-] ∙ [Н+] = 2∙10-5; [СН3СООН] Кд(HCN)= [Н+] ∙ [CN-] = 7∙10-10 при25°С. [HCN] Величина константы ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в его растворе, тем сильнее электролит. Например: Кд(СН3СООН)=[СН3СОО-] ∙ [Н+] = 2∙10-5; [СН3СООН] Кд(HCN)= [Н+] ∙ [CN-] = 7∙10-10 при25°С. [HCN]](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen42.jpg)



![Число ступеней диссоциации равно основности слабой кислоты. На первой ступени диссоциации сероводородной кислоты: H2S Н+ + HS-, К΄д=[Н+] ∙ [HS-] = 6,0 ∙10-8 [H2S] Число ступеней диссоциации равно основности слабой кислоты. На первой ступени диссоциации сероводородной кислоты: H2S Н+ + HS-, К΄д=[Н+] ∙ [HS-] = 6,0 ∙10-8 [H2S]](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen46.jpg)
![На второй ступени диссоциации от сложного гидросульфид-иона HS- отщепляется катион водорода Н+по уравнению: HS- Н+ + S2-, К΄΄д(HS-)= [Н+] ∙ [S2-] = 1,0 ∙10-14. [HS-] На второй ступени диссоциации от сложного гидросульфид-иона HS- отщепляется катион водорода Н+по уравнению: HS- Н+ + S2-, К΄΄д(HS-)= [Н+] ∙ [S2-] = 1,0 ∙10-14. [HS-]](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen47.jpg)
![К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14 [HS-] Сравнение величин К΄д и К˝д показывает, что диссоциация по второй ступени протекает в значительно меньшей степени, чем по первой. К΄΄д(HS-)=[Н+] ∙ [S2-] = 1,0 ∙10-14 [HS-] Сравнение величин К΄д и К˝д показывает, что диссоциация по второй ступени протекает в значительно меньшей степени, чем по первой.](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen48.jpg)

![Слабые многокислотные основания диссоциируют ступенчато и характеризуются несколькими константами диссоциации. Число ступеней диссоциации равно кислотности слабого основания. Рb(ОН)2 РbОН2++ОН- д=[РbОН+] ∙ [ОН-] =9,6 ∙10-4(tо=25оС ) [Рb(ОН)2 ] Слабые многокислотные основания диссоциируют ступенчато и характеризуются несколькими константами диссоциации. Число ступеней диссоциации равно кислотности слабого основания. Рb(ОН)2 РbОН2++ОН- д=[РbОН+] ∙ [ОН-] =9,6 ∙10-4(tо=25оС ) [Рb(ОН)2 ]](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen50.jpg)









![Диссоциация по первой ступени происходит по типу диссоциации сильных электролитов, а диссоциация комплексного иона — по типу диссоциации слабых электролитов. Например: [Ag(NH3)2]Cl [Ag(NH3)2]++C1- (сильный электролит) [Ag(NH3)2]+ Ag+ + 2NH30 (слабый электролит) Диссоциация по первой ступени происходит по типу диссоциации сильных электролитов, а диссоциация комплексного иона — по типу диссоциации слабых электролитов. Например: [Ag(NH3)2]Cl [Ag(NH3)2]++C1- (сильный электролит) [Ag(NH3)2]+ Ag+ + 2NH30 (слабый электролит)](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen60.jpg)



















![Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре Кв — величина постоянная. Численное значение его при температуре 22°С равно 10-14: Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14 Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре Кв — величина постоянная. Численное значение его при температуре 22°С равно 10-14: Кв = [Н+][ОН-] = 10-7 ∙ 10-7 = 10-14](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen80.jpg)
![Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять концентрацию Н+-ионов, если известна концентрация гидроксид-ионов ОН-, и наоборот. Если в водном растворе [Н+]= 10-3 мол Из постоянства произведения [Н+]и [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять концентрацию Н+-ионов, если известна концентрация гидроксид-ионов ОН-, и наоборот. Если в водном растворе [Н+]= 10-3 мол](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen81.jpg)
![Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН . Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов: рН = -lg[H+] где [Н+] концентрация ионов водорода, моль/л. Концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН . Водородным показателем рН называется отрицательный десятичный логарифм концентрации водородных ионов: рН = -lg[H+] где [Н+] концентрация ионов водорода, моль/л.](https://prezentacii.org/upload/cloud/15/05/42541/images/thumbs/screen82.jpg)