Презентация "Теория электролитической диссоциации обобщающий урок" по химии – проект, доклад
Презентацию на тему "Теория электролитической диссоциации обобщающий урок" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
Теория электролитической диссоциации
План урока. Теория электролитической диссоциации. I- е положение ТЭД. Задания к I-му положению ТЭД. II-е положение ТЭД. Задания к II-му положению ...Теория электролитической диссоциации.
Содержание ЭДМ. Введение. Требования ГОС. Цели занятия. Электролиты. Неэлектролиты С.Аррениус-основоположник теории электролитической диссоциации ...Процесс электролитической диссоциации
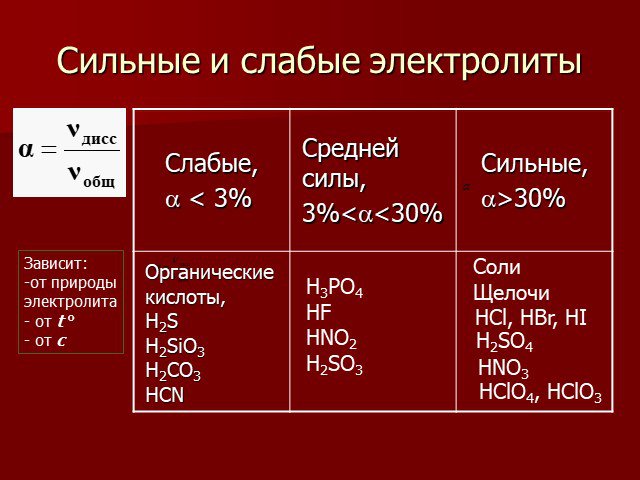
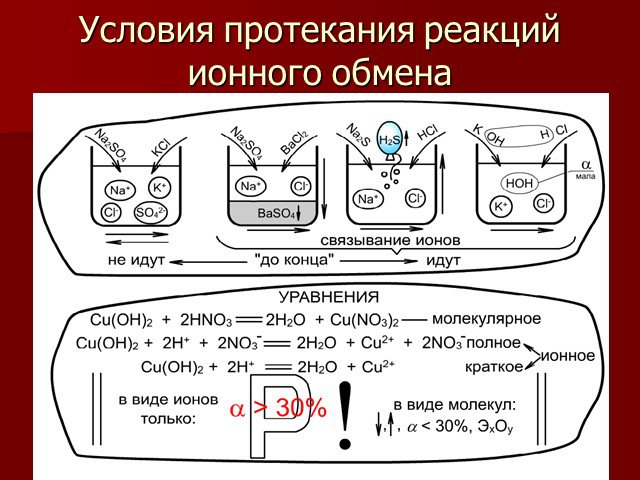
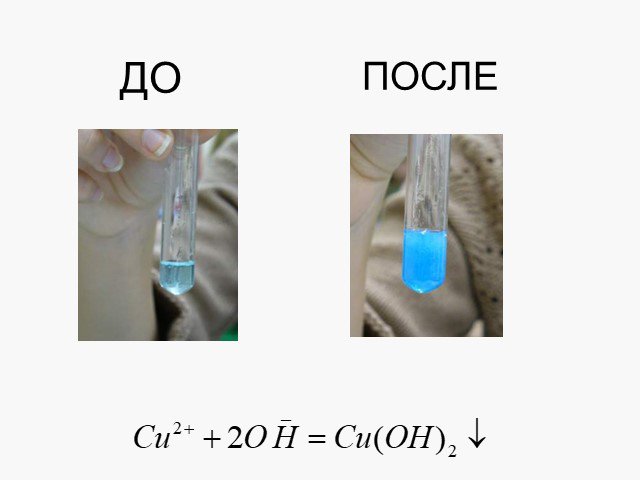
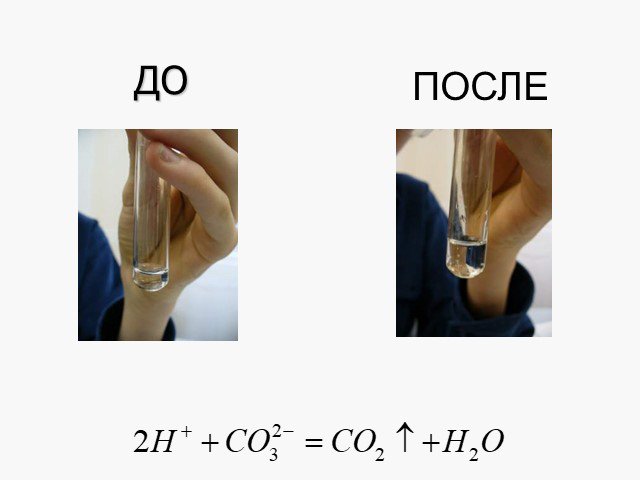
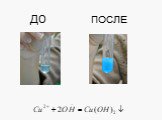
Электролитическая диссоциация. Исследование электропроводности жидкостей. Cu2+ SO42- + - H2O - +. Схема диссоциации сульфата меди. CuSO4=Cu2+ + SO42-. ...Химические свойства кислот с позиции теории электролитической диссоциации
Кислоты. Тема урока: «Химические свойства кислот с позиции теории электролитической диссоциации». «От кислых яблок сразу скисну». В. Шекспир. Кислота, ...Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации. 1) сформировать понятие об основаниях как электролитах; 2) рассмотреть ...Обобщающий урок
Эпиграф к уроку:. «Химик требуется не такой, который из одного чтения книг понял всю науку, но который собственным искусством в ней прилежно упражнялся…» ...Теория строения органических соединений
Например: Сбраживая виноградный сок, получали вино, а при его перегонке - спирт; Нагревая жир с содой, получали мыло; Из цветов извлекали эфирные ...Теория строения Бутлерова
Цели и задачи :. понимание специфики естественнонаучного и гуманитарного компонентов культуры, ее связей с особенностями мышления; формирование представлений ...Амины урок
Классификация аминов. Первичные амины. -NH2 аминогруппа СН3-NH2 метиламин С6Н5-NH2 фениламин (анилин). Амины - органические основания. .. .. H : N ...Вода урок
Тип урока: Обобщение и систематизация знаний с элементами новых знаний Вид урока: Урок-интервью Цель урока: Расширение представлений о воде как уникальном ...Теория химического строения органических веществ
"Просто знать - мало, знания нужно уметь использовать" Гёте. Кластер ОО. Органическая химия. Органические вещества. Теория химического строения. Валентные ...Теория строения химических соединений А.М.Бутлерова
Бутлеров Александр Михайлович (1828-1886). Русский химик, академик Петербургской АН (с 1874 г.). Окончил Казанский университет (1849 г.). Работал ...Теория строения строения органических соединений
Первые теории строения органических соединений. Органическая химия в начале XIX века: Ученые определяли количественный и качественный состав вещества. ...Теория строения органических соединений А. М. Бутлерова
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма). В состав органических веществ входят радикалы;. Радикалы всегда постоянны, не подвергаются ...первоначальные химические понятия открытый урок
Человек играет только тогда, когда он в полном значении слова человек, и он бывает вполне человеком лишь тогда, когда он играет. Ф. Шиллер. Цели игры. ...Основы строения органических соединений. Теория строения органических соединений
К первой половине XIX века в органической химии был накоплен громадный фактический материал, дальнейшее изучение которого тормозилось отсутствием ...Компетентностный урок
Что такое компетентностный подход? Компетентностный подход в образовании предполагает освоение учащимися умений, позволяющим действовать в новых, ...Интегрированный урок (химия + английский язык) "Углерод"
Любое препятствие преодолевается настойчивостью. Леонардо да Винчи. CARBON. Carbon is the basic element of organic chemistry. It is in every living ...Теория строения органических соединений А.М. Бутлерова
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма). В состав органических веществ входят радикалы;. Радикалы всегда постоянны, не подвергаются ...Серная кислота урок
Девиз урока:. «Лик планеты химически резко меняется человеком сознательно и главным образом бессознательно» (В. И. Вернадский). Цель урока:. Вспомнить ...Конспекты
Теория электролитической диссоциации
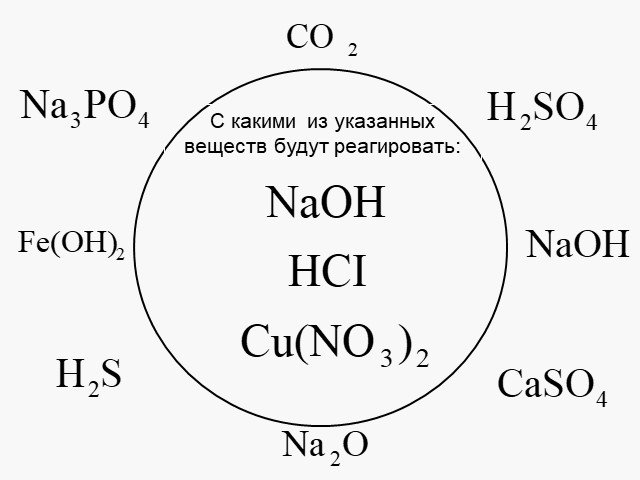
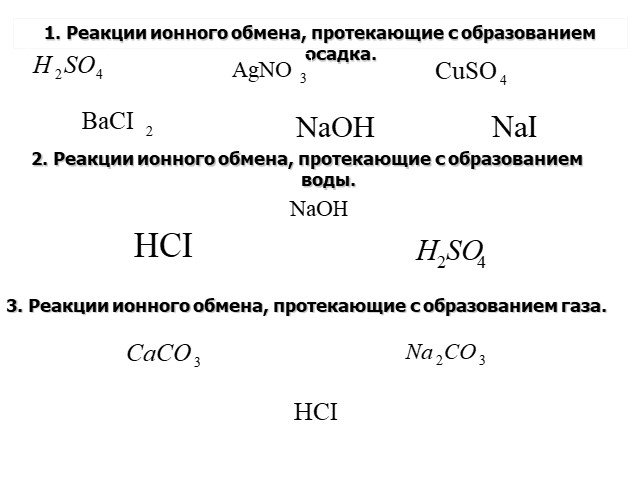
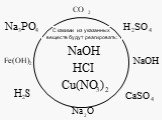
Тема:. Обобщение знаний по теме «Теория электролитической диссоциации». Цель:. Применить знания, полученные при изучении темы ТЭД для объяснения ...Теория электролитической диссоциации
Урок по химии в 11 классе по теме «Теория электролитической диссоциации». Цель:. Систематизация знаний учащихся по теме «Теория электролитической ...Основные положения теории электролитической диссоциации
Дисциплина: химия. План-конспект методической разработки урока. . с пояснениями по использованию материала. . в практической деятельности ...Основания, их классификация и химические свойства в свете теории электролитической диссоциации
ТЕМА УРОКА :. Основания, их классификация и химические свойства в. . свете теории электролитической диссоциации. . . II. слайд:. ЦЕЛЬ УРОКА:. ...Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации
Конспект урока химии. . 9 класс. Тема : «Обобщение свойств основных классов неорганических соединений в свете теории электролитической диссоциации». ...Кислоты. Химические свойства кислот в свете теории электролитической диссоциации
Урок химии в 8-м классе по теме: "Кислоты. Химические свойства кислот в свете теории электролитической диссоциации.". . Цели урока:. Образовательная. ...Соли в свете теории электролитической диссоциации
Муниципальное бюджетное общеобразовательное учреждение. «Средняя школа №9». Ульяновской области города Димитровграда. Конспект урока ...Химические свойства кислот в свете электролитической диссоциации
. Открытый урок. по теме:. «Химические свойства кислот в свете электролитической диссоциации». Урок-исследование. /химия. . . 8 класс. ...Соли, их классификация и химические свойства в свете теории электролитической диссоциации
Муниципальное общеобразовательное учреждение. . средняя общеобразовательная школа №2. г. Алексеевки Белгородской области. Конспект ...Соли в свете теории электролитической диссоциации, их свойства
Предмет – химия. Класс – 8. Тема урока: «Соли в свете теории электролитической диссоциации, их свойства». Тип урока: урок изучения нового ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:неизвестен
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию