Слайд 1ЛЕКЦИЯ № 15
ГРУППА ВЕЩЕСТВ, НЕ ТРЕБУЮЩИХ ОСОБЫХ МЕТОДОВ ИЗОЛИРОВАНИЯ Общая характеристика соединений. Токсикологическое значение. Особенности методов изолирования. Методы обнаружения и количественного определения. Метгемоглобинемия и метгемоглобинемические яды
Основные представители Оксиды углерода (угарный газ CO, CO2) Оксиды азота (N2O, NO, NO2, N2O3) Оксиды серы (SO2, SO3) Гидриды p-элементов V и VI групп ПСЭ (NH3, PH3, AsH3, H2S, H2Se, H2Te)

Слайд 2Угарный газ
Токсикологическое значение входит в состав светильного газа, выхлопных газов, газообразных продуктов взрыва и взрывчатых смесей (горные разработки, каменоломни) встречается в промышленных предприятиях (газовые, коксохимические заводы) образуется при больших пожарах в домах, горнопромышленных предприятиях, в недостаточно вентилируемых печах, при пользовании газовыми колонками в плохо проветриваемых помещениях CO возникает при даже умеренном нагревании карбонила и некоторых органических веществ. Симптомы отравления. Головная боль, стук в висках, головокружение, сухой кашель, боль в груди, слезотечение, тошнота, рвота. Возможно возбуждение со слуховыми и зрительными галлюцинациями. Гиперемия кожи. Тахикардия, повышение АД. Далее развиваются адинамия, сонливость, двигательные параличи, потеря сознания, кома, судороги, нарушение дыхания, нарушение мозгового кровообращения, отек мозга. Возможно развитие инфаркта миокарда, кохнотрофических расстройств.

Слайд 3Качественное определение Лабораторные и функциональные пробы. Кровь вишнево- или ярко-красного цвета. При подогревании крови на кипящей водяной бане и добавлении формалина или 10% NaOH кровь остается красной. (Кровь, не содержащая CO, становится коричневой). Количественное определение Спектрофотометрически Токсическая доза для человека 0,1 – 0,2 об. % в течение 0,5-1 часа (при ингаляции) или 0,3 – 0,5 об. % в течение нескольких минут приводят к смерти.

Слайд 4Углекислый газ
Токсикологическое значение используется в технике для глубокого охлаждения в медицине для удаления бородавок и т.д. большое количество CO2 скапливается на фабриках по производству дрожжей, в прессовых отделениях винодельческих и соковых цехов, в закрытых помещениях, нагруженных фруктами, в силосе из зерна, кормовых культур, сена и т.п. большая опасность возникает при обработке кислотой карбонатных источников, водопроводов, котлов с целью очистки. Симптомы отравления. В зависимости от продолжительности ингаляции без достаточного содержания кислорода во вдыхаемом воздухе (около 8-10 об. %) - головная боль, шум в ушах, головокружение, повышение АД, тахикардия, цианоз, состояние возбуждения, тошнота. При концентрации CO2 более 10 об. % развиваются атаксия, эпилептиформные судороги, утрачивается сознание, падает АД. При своевременном начале дыхания свежим воздухом наступает быстрое выздоровление, в противном случае – летальный исход вследствие ухудшения

Слайд 5Оксиды азота Нитрозные газы - NO, NO2, N2O3 Веселящий газ N2O
Токсикологическое значение Нитрозные газы образуются при реакции азотной и азотистой кислот с металлами (при травлении, автогенной сварке) и органическими веществами при сгорании нитроцеллюлозы при процессах нитрирования в химической промышленности или лабораториях содержатся в выхлопных газах автомобилей. Веселящий газ используется как газообразное топливо для форсунок и аэрозольных упаковок иногда в приготовлении взбитых сливок при достаточной подаче кислорода является идеальным наркотическим средством без собственного токсического действия. Симптомы отравления. При вдыхании - раздражения в области глаз, носа, глотки, головокружение, головная боль. При воздействии концентраций > 0,05 об. %) – асфиксия, в течение 15 минут – 1 часа раздражение стихает (латентная стадия) до 2 дней. Увеличивается респирация, учащается пульс, повышается количество тромбоцитов. Затем неожиданно - кашель, одышка, чувство удушения, что приводит к цианозу, выделению обильной пенистой коричнево-красной мокроты. Далее - бронхопневмония или асфиктическая стадия с потерей сознания и сердечно-сосудистой недостаточностью.

Слайд 6Оксиды серы SO2 и SO3
Токсикологическое значение SO2 применяют в сжатой форме в холодильных установках содержится в стальных баллонах используется в резиновой, целлюлозной, пищевой промышленности как дезинфицирующее, дезинсекционное и консервирующее средство входит в состав обесцвечивателей, отбеливающих средств может свободно выделяться (с серной или сернистой кислотами) из свечей против вредителей. Порог раздражания при 0,0002 об. %. Симптомы отравления. Поражает слизистые оболочки (влажные) (относительно быстрое, начиная с 0,001 – 0,01 об. %, воздействие 0,04 – 0,05 об. % в течение нескольких минут создает угрозу для жизни). Развивается сопровождающийся болями конъюнктивит. Воздействие сжиженного газа вызывает хемоз и помутнение роговицы, отморожение кожи и слизистых оболочек. После ингаляции симптоматика и течение отравления, как при интоксикации газообразным хлором.
Слайд 7Гидриды p-элементов V и VI групп ПСЭ Аммиак (Рассматривался в разделе соединений, изолируемых настаиванием биологического материала с водой) Фосфин
Токсикологическое значение используется в виде фосфидов при взаимодействии с водой (фосфиды кальция, цинка, алюминия) применяют как носитель фосфористого водорода для борьбы с грызунами и долгоносиком амбарным Симптомы отравления. После ингаляции - головная боль, головокружение, рвота, понос. Снижается АД, утрачивается сознание, развивается диспноэ. Иногда наблюдают судороги. В ранние сроки может наступить летальный исход в результате сердечно-сосудистой недостаточности или отека легких. В остальных случаях после 1-2 дней латентного периода характерны последствия нарушений функций печени и почек. Токсичность. Минимальная предостерегающая концентрация – 0,00014 – 0,00028 об.%. ЛД – 0,1 – 0,2 об. % в течение 10 минут.

Слайд 8Гидриды p-элементов V и VI групп ПСЭ Арсин
Токсикологическое значение серная кислота, получаемая камерным способом, содержит мышьяк и образует при контакте с металлами мышьяковистый водород арсин используется в БОВ, например, в форме арсенида цинка или алюминия Симптомы отравления. После вдыхания - гастроинтестинальные осложнения, последствия распространенного гемолиза, такие как гемоглобинурия (моча цвета портвейна), олигурия, переходящая в анурию и уремию. Развиваются метгемоглобинемия, анемия, гипоксемия, сопровождаемые диспноэ, удушьем (возможен паралич дыхания). Увеличиваются печень, селезенка, появляются желтуха, гиперкалиемия, сопровождающиеся подъемом температуры, ощущением холода. Летальный исход возможен через несколько дней в результате острой сердечно-сосудистой недостаточности. Токсичность. Доза 0,001 об.%. в течение 1 мин. токсична, 0,025 об.% - в течение 0,5 часа, ЛД – 1,55 об. % мгновенно.

Слайд 9Гидриды p-элементов V и VI групп ПСЭ Сероводород
Токсикологическое значение образуется при гниении продуктов растительного и животного происхождении токсичные концентрации (наряду с другими газами, образующимися при гниении) возникают в водосточных канавах, угольных шахтах, ямах для навозной жижи, в дубильных чанах, в помойных ямах, в серных рудниках, в сточных водах может быть побочным промышленным продуктом (например, в доменных печах, при получении вискозы и целлюлозы, при рафинировании нефти). Симптомы отравления. Ингаляция с 0,01 об. % - незначительное раздражение слизистых оболочек. В тяжелых случаях - конъюнктивит, слезотечение, фотофобия, блефароспазм, ринит. Возможен бронхит со слизистой, иногда кровянистой мокротой. При воздействии более высоких концентраций (0,05 % при экспозиции 0,5 часа заканчивается смертью) - головная боль, головокружение, атаксия, диспноэ (отек легких), тахикардия, снижение АД, судороги. Утрачивается сознание, прекращается дыхание (ранее остановки сердца). После массивной ингаляции (примерно с 1 об. %) - апоплектиформное течение: на несколько минут или секунд прекращается дыхание. В тяжелых случаях - легочные, сердечные осложнения, нарушения со стороны ЦНС, а также поздние расстройства (как при отравлении CO) вплоть до слепоты. Токсичность. Токсическое действие - при содержании его в воздухе в количестве 0,06 %. При больших концентрациях (1,2 – 1,8 мг в 1 л воздуха), могут наступать смертельные отравления.

Слайд 10Гидриды p-элементов V и VI групп ПСЭ Селеноводород
Токсикологическое значение может образовываться при металлургических процессах (выплавка меди, свинца и цинка), при обжиге серного колчедана в производстве резины, керамики и цемента производные (селеналканы) могут являться специальными добавками к бензину выделяется при добавлении кислот к селенидам (встречающимися в минералах, в полупроводниках). Симптомы отравления. Ингаляция селенистого водорода (начиная с 0,0001 об. %) - местное раздражение дыхательных путей (уже после одного вдоха возможен удерживающийся в течение дня «селеновый насморк»). В тяжелых случаях после 4 –5 часов латентного периода появляются симптомы токсического отека легких, иногда гемолиз (его последствия). У перенесших отравление возникает угроза развития бронхопневмонии, поражений печени, селезенки и почек, а также вторичной анемии и порфирии.

Слайд 11Гидриды p-элементов V и VI групп ПСЭ Теллуроводород
H2Te подобен селенистому водороду Симптомы отравления. После приема внутрь или парентерального введения - сухость и привкус металла во рту. Иногда в выдыхаемом воздухе, поте и моче в течение месяца сохраняется запах чеснока. В крайних случаях возможны желудочно-кишечные расстройства, цианоз, утрата сознания, сосудистый коллапс, как при отравлении селеном. Смотря по обстоятельствам, возникает опасность поражения печени и почек (канальцев). Фекалии принимают синюю и серую окраску.

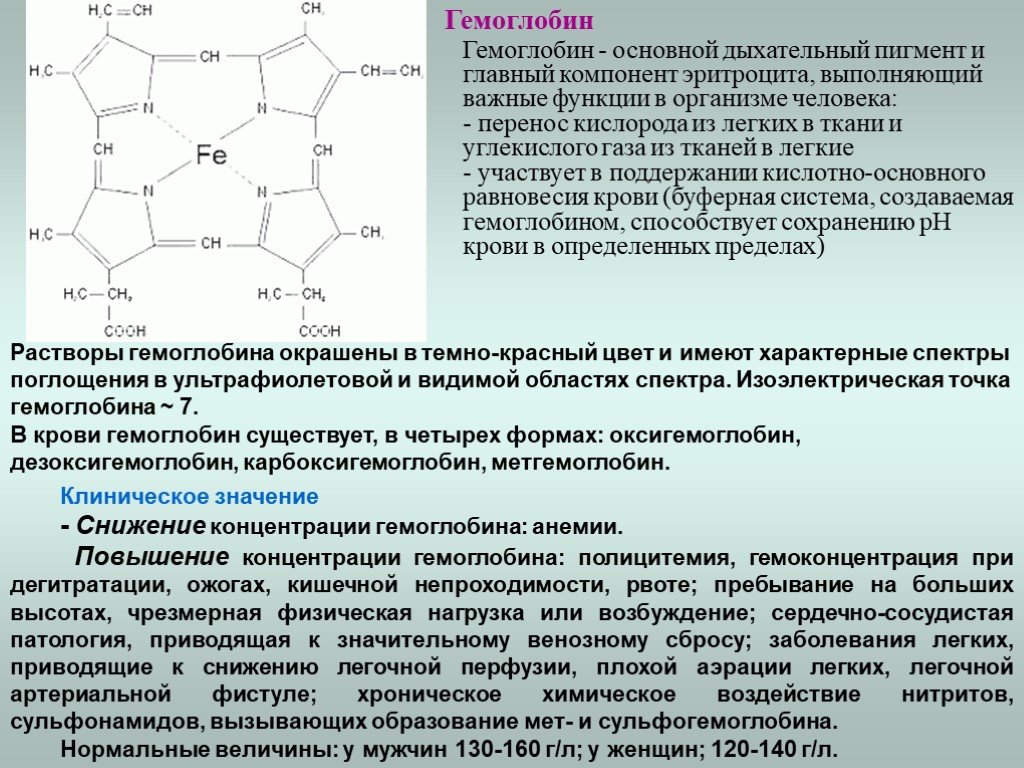
Слайд 12Гемоглобин
Гемоглобин - основной дыхательный пигмент и главный компонент эритроцита, выполняющий важные функции в организме человека: перенос кислорода из легких в ткани и углекислого газа из тканей в легкие участвует в поддержании кислотно-основного равновесия крови (буферная система, создаваемая гемоглобином, способствует сохранению рН крови в определенных пределах)
Растворы гемоглобина окрашены в темно-красный цвет и имеют характерные спектры поглощения в ультрафиолетовой и видимой областях спектра. Изоэлектрическая точка гемоглобина ~ 7. В крови гемоглобин существует, в четырех формах: оксигемоглобин, дезоксигемоглобин, карбоксигемоглобин, метгемоглобин.
Клиническое значение - Снижение концентрации гемоглобина: анемии. Повышение концентрации гемоглобина: полицитемия, гемоконцентрация при дегитратации, ожогах, кишечной непроходимости, рвоте; пребывание на больших высотах, чрезмерная физическая нагрузка или возбуждение; сердечно-сосудистая патология, приводящая к значительному венозному сбросу; заболевания легких, приводящие к снижению легочной перфузии, плохой аэрации легких, легочной артериальной фистуле; хроническое химическое воздействие нитритов, сульфонамидов, вызывающих образование мет- и сульфогемоглобина. Нормальные величины: у мужчин 130-160 г/л; у женщин; 120-140 г/л.

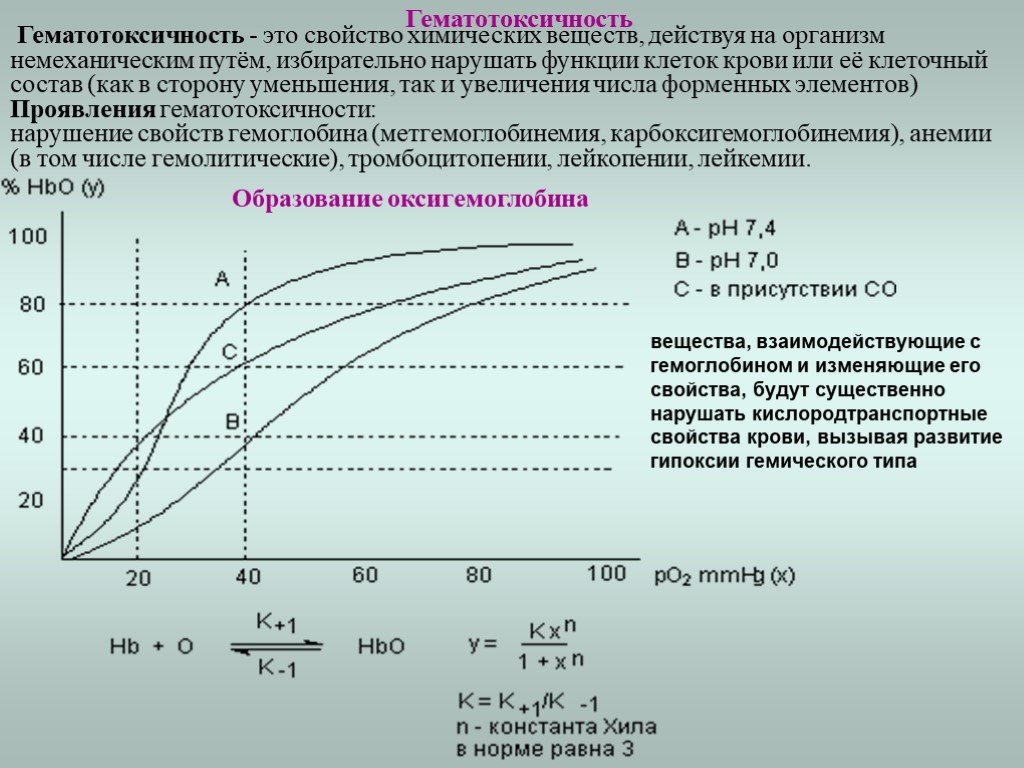
Слайд 13Гематотоксичность
Гематотоксичность - это свойство химических веществ, действуя на организм немеханическим путём, избирательно нарушать функции клеток крови или её клеточный состав (как в сторону уменьшения, так и увеличения числа форменных элементов) Проявления гематотоксичности: нарушение свойств гемоглобина (метгемоглобинемия, карбоксигемоглобинемия), анемии (в том числе гемолитические), тромбоцитопении, лейкопении, лейкемии.
Образование оксигемоглобина
вещества, взаимодействующие с гемоглобином и изменяющие его свойства, будут существенно нарушать кислородтранспортные свойства крови, вызывая развитие гипоксии гемического типа

Слайд 14Метгемоглобинообразование
Гемоглобин, железо которого трёхвалентно, называется метгемоглобином. Физиологический уровень метгемоглобина в крови - менее 1%. Высокое содержание метгемоглобина, развивающееся в результате действия некоторых токсикантов, приводит к нарушению кислородтранспортной функции крови, а спустя некоторое время и гемолизу, что сопровождается снижением парциального давления кислорода в тканях, развитию тяжёлой гипоксии. Причины метгемоглобинообразования Метгемоглобинемией называется состояние, при котором в крови определяется более 1% метгемоглобина. Приобретенная метгемоглобинемия развивается в результате действия на организм некоторых лекарств, промышленных и экотоксикантов, которые либо непосредственно окисляют железо, входящее в структуру гемоглобина, либо метаболизируют в организме с образованием реактивных продуктов, обладающих этим свойством.

Слайд 15Проявления метгемоглобинемии Цианоз кожных покровов и видимых слизистых (цвет цианотичных участков кожи от синеватого до шоколадного; слизистые более коричневого, чем синего цвета). Таблица. Проявления метгемоглобинемии различной степени выраженности
Слайд 16Лабораторная диагностика метгемоглобина в крови
1. Если пигмента в крови более 15% - капля крови окрашивает фильтровальную бумажку в "шоколадный" цвет, хорошо выявляемый при сравнении с цветом нормальной крови. 2. Пропускание кислорода через венозную кровь изменяет её вишневый цвет на алый. Кровь, содержащая метгемоглобин, не меняет при этом окраску. 3. Добавление к разведённой в 100 раз крови, содержащей метгемоглобин, кристаллика цианистого калия приводит её к окрашиванию в розовый цвет вследствие образования цианметгемоглобина. 4. Диагностическими признаками массивного метгемоглобинообразования является коричнево-черное окрашивание мочи, а также появления в ней белка.

Слайд 17Образование карбоксигемоглобина
Карбоксигемоглобин образуется при действии на организм угарного газа, а также при отравлении карбонилами металлов, прежде всего никеля и железа (Ni(CO)4; Fe(CO)5).
Клинические проявления Тошнота, рвота, головная боль, беспокойство, спутанность сознания, а в тяжелых случаях - кома. Вследствие гипоксии развивается отек мозга, гипертензия, сменяющаяся гипотонией. Нередко отмечаются деструктивные процессы в ткани мозга, приводящие к формированию стойких нарушений функций ЦНС. Изменение окраски кожных покровов (розовая), тахикардия, аритмии, ишемия и инфаркт миокарда; умеренный отек легких, буллезные высыпания на коже, рабдомиолиз с последующей острой почечной недостаточностью.

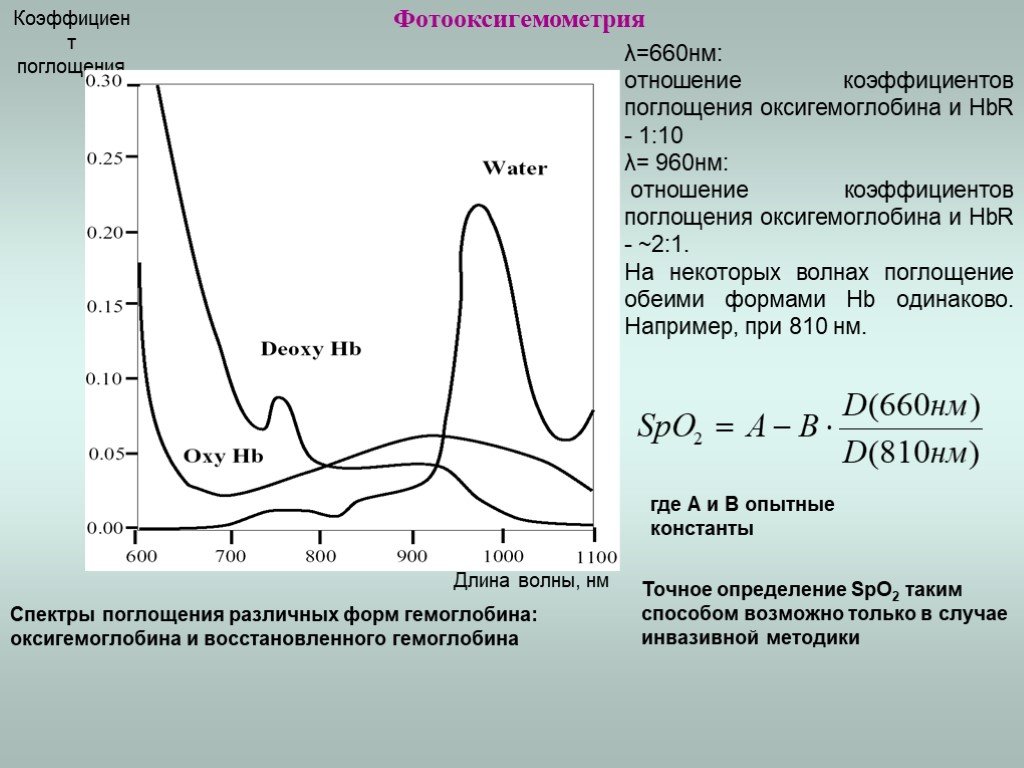
Слайд 18Фотооксигемометрия
В зависимости от того, с чем связаны молекулы гемоглобина различают: 1. Восстановленный гемоглобин HbR 2. Оксигемоглобин HbO2 3. Карбоксигемоглобин HbCO 4. Метгемоглобин MetHb – нейтрализованная форма гемоглобина не способная связываться с кислородом. Кислородная емкость – способность данного объема крови связывать определенный объем кислорода. Кислородная емкость определяется концентрацией Hb в крови (1г гемоглобина способен связать 1,355см3 О2). Степень насыщения (сатурации) крови кислородом (SpO2) определяется по формуле: или

Слайд 19Длина волны, нм
λ=660нм: отношение коэффициентов поглощения оксигемоглобина и HbR - 1:10 λ= 960нм: отношение коэффициентов поглощения оксигемоглобина и HbR - ~2:1. На некоторых волнах поглощение обеими формами Hb одинаково. Например, при 810 нм.
где А и В опытные константы
Спектры поглощения различных форм гемоглобина: оксигемоглобина и восстановленного гемоглобина
Точное определение SpO2 таким способом возможно только в случае инвазивной методики

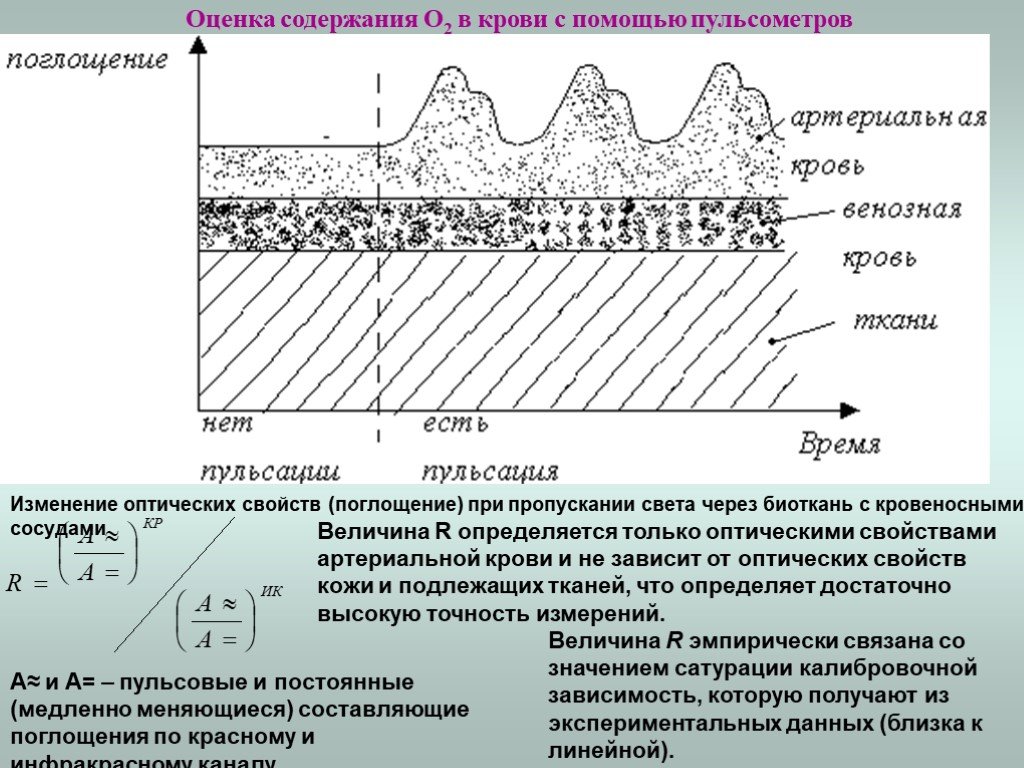
Слайд 20Оценка содержания О2 в крови с помощью пульсометров
Для измерения используется пульсовая волна. Сигнал с выхода датчика: пропорционален абсорбции света, проходящего через ткани, и включает две составляющие: пульсирующую, обусловленную изменением объема артериальной крови при сердечном выбросе крови, и постоянную базовую составляющую, определяемую оптическими свойствами кожи, венозной и капиллярной крови и других тканей исследуемого участка. Измерение проводят на двух длинах волн 660 – красный и 940 – инфракрасный (ИК). Производят измерение в момент максимума амплитуды сигнала, и измеряется постоянная составляющая в момент диастолы.
основная задача пульсового оксиметра – измерить с возможно большей точностью величину R и ей в соответствие величину SpO2 по градуировочной характеристике, заложенной в память прибора в виде функции или таблицы. Пульсометры используются при монеторировании состояния пациента: · при операциях с наркозом; · при транспортировке больных; · кислородной терапии и респираторной поддержке; · в палатах интенсивной терапии

Слайд 21Изменение оптических свойств (поглощение) при пропускании света через биоткань с кровеносными сосудами
A≈ и A= – пульсовые и постоянные (медленно меняющиеся) составляющие поглощения по красному и инфракрасному каналу.
Величина R эмпирически связана со значением сатурации калибровочной зависимость, которую получают из экспериментальных данных (близка к линейной).
Величина R определяется только оптическими свойствами артериальной крови и не зависит от оптических свойств кожи и подлежащих тканей, что определяет достаточно высокую точность измерений.