Конспект урока «Сущность химических реакций. Закон сохранения атомов» по химии для 8 класса
Урок химии в 8 классе
Учитель Димчикова Людмила Дымбрыловна
Тема урока: «Сущность химических реакций. Закон сохранения атомов»
Новое содержание: Закон сохранения атомов. Закон сохранения массы веществ.
Дидактическая цель: Сформулировать законы сохранения атомов и сохранения массы веществ
Учебные задачи:
1. Доказать на опыте, что в реакциях атомы не исчезают и не возникают вновь, а только связываются в иных комбинациях.
2. Развивать логическое мышление, наблюдательность, умение устанавливать причинно- следственные связи, обобщать и делать выводы;
3.Способствовать формированию ответственности, патриотизма
Оборудование: реактивы (медь, соляная кислота, щелочь, серная кислота), железный гвоздь, свеча, весы, спиртовка.
Организационный момент.
Демонстрация опыта горение бенгальского огня
-Начнем урок с выдвижения гипотез.
-Что происходит в веществе в ходе химической реакции? Ваши гипотезы.
Ожидаемые ответы: атомы перегруппировываются, атомы соединяются по-другому.(верная гипотеза).
Атомы разрушаются, а из их осколков собираются новые атомы.(неверная гипотеза)
-Две гипотезы нужно доказать опытным путем. Проведем цепь взаимосвязанных опытов.
Цель эксперимента- доказать сохраняемость атомов .
-Посмотрите на химический элемент Си в виде простого вещества до реакции, затем проводим его через ряд превращений, а в конце получаем в прежнем виде.
- это можно проделать на таких превращениях:
Cu CuO CuCl2 Cu(OH)2 CuSO4 Cu
Проводим следующие опыты:
1.Медную проволоку подвергаем прокаливанию и получаем оксид меди (II).
2. Соляную кислоту НСL нагреваем, а затем в нее опускаем почерневшую проволоку. Отмечаем растворение оксида и зеленоватое окрашивание раствора.
3. В остывший раствор осторожно понемногу добавляем концентрированный раствор гидроксила натрия. Получаем гидроксид меди (II).
4.К осадку добавляем разбавленную серную кислоту. Отмечаем растворение осадка и образование голубого раствора.
5. В полученный раствор опускаем зачищенный железный гвоздь и через некоторое время демонстрируем образовавшуюся медь.
-Результаты опытов заносим в таблицу:
| Воздействие на исходное вещество | Наблюдение | Образовавшееся вещество | |
| Медь Cu | Нагревание, O2 | Черный налет | Оксид меди CuO (II) |
| Оксид меди CuO | Соляная кислота HCl | Зеленоватый раствор | Хлорид меди CuCl2 (II) |
| Хлорид меди CuCl2 (II) | Щелочь NaOH | Голубой осадок | Гидроксид меди Cu(OH)2 |
| Гидроксид меди Cu (OH)2 (II) | Серная кислота | Голубой раствор | Сульфат меди CuSO4 |
| Сульфат меди CuSO4 | Железный гвоздь | Красный налет | Медь Cu |
| Вывод: | | | |
Физкультминутка на зрение проводит министр спорта класса. (2-4 мин)
-Какой вывод следует из проведенных опытов?
Ожидаемые ответы уч-ся: Из опытов следует, что атомы в реакциях не исчезают и не возникают ниоткуда, остаются те же самые атомы.
-
Атомы соединяются по-другому;
-
Число атомов не изменяется.
Посмотрите на модельную схему превращений одних веществ в другие (схема 2). Включить проектор.
Модельная схема превращений соединений меди Схема 2
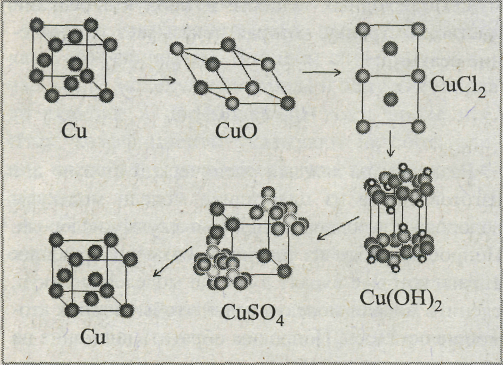
-Что вы видите на экране? (На экране атомы переходят из одной кристаллической решетки в другую).
-Атомы меди образующие простое вещество, в реакциях связываются с другими атомами в различных сочетаниях ив конце снова ,образует простое вещество.
-Отсюда можно сформулировать закон сохранения атомов
Атомы в реакциях ниоткуда не возникают и никуда не исчезают, а только перегруппировываются.
-Общее число атомов в ходе реакции изменяется или остается одинаковым до после реакции? (Сколько атомов каждого элемента было до реакции, столько же осталось после ее завершения)
-Знание этого закона вам понадобится уже на следующем уроке при подборе коэффициентов.
-Если обще число атомов в химической реакции сохраняется, сохраняется ли масса веществ в процессе реакции?
(Сохраняется)
-Выведем еще один закон- Закон сохранения массы веществ.
Общая масса веществ до реакции и после нее не изменяется.
Учитель демонстрирует опыт: Уравновесим весы с укрепленной на одной чашке свечой. Зажжем свечу, через некоторое время равновесие нарушается, масса свечи уменьшается.
-Как видим , масса свечи после реакции уменьшается, а вы сказали, что масса веществ в ходе реакции не меняется. Значит, закон сохранения массы не соблюдается?
(Соблюдается. Это образующиеся газы улетучиваются, и масса веществ уменьшается).
-Как доказать, что в этой реакции масса до и после реакции одинакова?
(уч-ся предлагают закрыть свечу стаканом). Опыт повторить предварительно закрыв свечу колпаком)
История открытия закона сохранения массы.
Просмотр видео фрагмента.
Закон сохранения материи известен с древности. Первая формулировка принадлежит Эпикуру.
Прослушать сообщение учащихся о М.В. Ломоносове, Р. Бойле.
Что нового вы узнали на этом уроке?
Какой из закон сформулированных на уроке является более глубоким?
Довольны ли вы своей работой на уроке? (учащиеся дают самооценку). Выставление оценок в журнал.
Домашнее задание. Подготовить сообщения по желанию об ученых предшественниках М. В. Ломоносова
Здесь представлен конспект к уроку на тему «Сущность химических реакций. Закон сохранения атомов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

