Конспект урока «Неметаллы» по химии для 9 класса
МБОУ Тацинская СОШ № 3
Обобщающий урок по теме «Неметаллы»
Учитель химии
Гамалицкая Елена Николаевна
2014 год
Обобщающий урок по теме "Неметаллы» -9 класс
Задачи урока:
• Обучающие: Систематизировать и обобщить знания особенностей строения атомов неметаллов, свойств простых веществ, а также их соединений; сделать вывод о физических и химических свойствах неметаллов; сформировать устойчивый интерес к изучаемой теме.
• Развивающие: мотивировать учебную деятельность учащихся, умение использовать свои знания при решении практических задач, приемы обращения с лабораторным оборудованием, умение работать в группе;
• Воспитательные: формировать умение работать с имеющейся информацией.
Тип урока: обобщение и систематизация учебного материала с использованием информационно-коммуникационных технологий.
Оборудование:
Компьютер, мультимедиа, презентация «Неметаллы» по щелчку.
Раздаточный материал: приложения 1,2,3,4.
Оценочные листы по теме «Неметаллы». Приложение 5
Реактивы: раствор нитрата серебра, хлорид натрия, сульфат натрия, карбонат натрия, хлорид бария.
Ход урока.
-
Организационный момент. Вступительное слово учителя:
Здравствуйте, садитесь, пожалуйста. Мы с вами закончили изучение раздела «Неметаллы».
Слайд 1 – тема урока.
-
Актуализация:
Слайд 2 Какие цели мы поставим перед собой на этот урок?
- Обобщить полученные знания по теме «Неметаллы»
- Закрепить полученные знания о применении неметаллов в жизни
-
Работа в группах.
Урок пройдет в форме соревнования между четырьмя командами: Деление класса на группы (на выбор учителя), а названия командам вы определите сами, отгадав загадки.
Слайд №3 Конкурс 1: Названия команд ( все по щелчку)
Загадка №1: Я светоносный элемент.
Я спичку вам зажгу в момент.
Сожгут меня, и под водой
Оксид мой станет кислотой. (Фосфор)
Загадка №2: Удивить готов он нас -
Он и уголь, и алмаз,
Он в карандашах сидит,
Потому что он – графит.
Грамотный народ поймет
То, что это …(Углерод)
Слайд № 4
Загадка № 3: В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …(кислород)
Загадка № 4: Предупреждаю вас заранее:
Я не пригоден для дыхания!
Но все как будто бы не слышат
И постоянно мною дышат. (Азот)
Слайд 5 Конкурс 2 Я предлагаю вспомнить строение неметаллов. (задание на экране) приложение 1
Провести сравнительную характеристику неметаллов на примере углерода, фосфора, серы и хлора. Каждая группа получает таблицу и заполняет один столбец и совместно проверяем на документ- камере. (5 минут)
| Углерод | Фосфор | Сера | Хлор | |
| Положение в П.С. | | | | |
| Электронная формула | | | | |
| Формулы простых веществ (аллотропия) | | | | |
| Физические свойства | | | | |
| Высший оксид | | | | |
| Летучее водородное соединение | | | | |
Конкурс 3: Дальше- дальше
(фронтальный опрос) каждой команды по очереди , за каждый правильный ответ - 1 балл
Слайд 6 1. Второй элемент по распространенности в земной коре, в свободном виде в природе не встречается, его соединения входят в состав растительных и животных клеток, некоторые организмы обладают способностью его накапливать. Что это за элемент? (Кремний.)
Слайд 7 2.Аллотропное видоизменение какого элемента пахнет чесноком? (Белый фосфор.)
Слайд 8 3. Из этого вещества при высоких температуре и давлении получают искусственные алмазы. (Графит.)
Слайд 9 4. В атмосфере какого газа-неметалла хранят старинные рукописи? (Азот.)
Слайд 10 5. Недостаток какого элемента в организме человека приводит к кариесу? (фтор).
Слайд 11 6. Каким элементом богата морская капуста - ламинария? (Йод.)
Слайд 12 7. Этот неметалл издавна употребляли для изготовления лекарственных препаратов, чернения оружия, приготовления черного пороха, в производстве спичек; оксид этого неметалла - для отбеливания тканей. О каком неметалле идет речь? (Сера.)
Слайд 13 8. Этот газ нашел применение в рекламной индустрии, заполненные им стеклянные трубки дают ярко-красное свечение. Название этого газа в переводе с греческого означает «новый». Что это за газ? (Неон.)
Слайд 14 9. Первенство открытия этого химического элемента принадлежит китайскому ученому VIII в. Мао Хао, который за 1000 лет до А.Л.Лавуазье установил, что в состав воздуха входит газ, поддерживающий горение и дыхание. О каком газе идет речь? (Кислород.)
Слайд 15 10. Этот неметалл считается самым активным среди всех неметаллов. (Фтор.)
Слайд 16 11. Какой химический элемент называют «элеменом жизни и мысли»? (Фосфор.)
Слайд 17 12.Какой неметалл академик А.Е.Ферсман назвал «двигателем химической промышленности»? (Сера).
Слайд 18 Конкурс 4. Найди ошибки. (Конкурс капитанов)
Необходимо найти ошибки в «абсолютно правдивом рассказе».
Для того чтобы ответить на этот вопрос нам необходимо поработать с текстом, следующим образом, в пропущенные места необходимо вставить слова по смыслу. Проверка текста через документ-камеру.
ТЕКСТ.
Все химические элементы разделяют на …….. и ……. в зависимости от строения и свойств их атомов.
Если для атомов ……… характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне (1ē – З ē), атомам …………., наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют очень небольшой радиус). Отсюда и стремление атомов …….. к приему недостающих до заветной восьмерки электронов, т. е. окислительные свойства, а для атомов …….— стремление к отдаче внешних электронов, т. е. восстановительные свойства.
Среди 109 известных сегодня химических элементов (из них 88 элементов- …….. найдено в природе), а …….. - 22 элемента. ……….. в периодической системе расположены в основном под диагональю В—At, а …….. — по этой диагонали и над ней.
Свойства простых веществ, образуемых ………, отличаются большим разнообразием. Судите сами: водород Н2, кислород и озон 02 и 03, фтор F2, хлор С12, азот N2 — газы при обычных условиях, бром Вг2 — жидкость, а бор, углерод (алмаз, графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод 12, астат — твердые вещества.
Если для подавляющего большинства ….. характерен серебристо-белый цвет, то окраска ……. — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый жидкий бром), желтый (сера), зеленый
(хлор — желто-зеленый газ), фиолетовый (пары йода).
Температуры плавления ……. лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота.
Эта особенность свойств ……. является следствием образования ими двух типов кристаллических решеток: молекулярной (02, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решеток объясняется и явление аллотропии. Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой — красный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример — простые вещества, образуемые кислородом: обычный кислород 02 и озон О3.
А пока капитаны работают над своим заданием, мы продолжаем конкурсы с командами.
Конкурс 5: Загадочный элемент
Задание: Учитель зачитывает определения, относящиеся к загаданному химическому элементу неметаллу. Если ответ готов после первого определения, то команда получает 5 баллов, после второго – 4, после третьего – 3,после четвертого – 2, после пятого – 1, не угадано вещество – 0.
Слайд 19 Задание для группы №1
- Его простое вещество называют все съедающим.
- Он обладает высокой химической активностью.
- Его соединения входят в состав зубных паст.
- Он входит в состав фреона.
-Его находят в тефлоновых покрытиях.
О т в е т. Фтор
Слайд 20 Задание для группы №2
- Это распространенный неметалл.
- Его атомы входят в состав белков.
- Простое вещество горит синеватым пламенем.
- Используют в производстве резины.
-Используют в производстве спичек.
О т в е т. Сера
Слайд 21 Задание для группы №3
- Простое газообразное вещество оказывает сильное раздражающее действие на слизистую оболочку глаз и дыхательную систему.
- Он входит в состав некоторых гербицидов, инсектицидов и пестицидов.
- Простое вещество получают главным образом в результате электролиза солей.
- Войска Антанты и германские войска применяли это вещество в боевых действиях.
- Соединения этого элемента используют для дезинфекции воды в плавательных бассейнах.
О т в е т. Хлор
Слайд 22 Задание для группы № 4
- Этот неметалл образует аллотропные модификации.
- Академик А.Е. Ферсман навал его «элементом жизни и мысли»
- Входит в состав костей.
- Открыт в 1669 году немецким алхимиком Брандом.
- Одна из аллотропных модификаций светится в темноте.
О т в е т. Фосфор
Слайд 23 Конкурс 6: Химический практикум. Приложение 3
Для решения многих химических задач главным вопросом является знания качественных реакций. Сейчас на практике вам предлагается провести экспериментальную работу по определению веществ, основанную на знаниях аналитической химии (знаний качественных реакций).
Химический практикум (работа в группе) .
Задание: Определить, в какой из пробирок находятся хлорид натрия, сульфат натрия, карбонат натрия, используя предложенные реактивы. При проведении химического эксперимента соблюдайте ТЕХНИКУ БЕЗОПАСНОСТИ.
| Реактивы | Исследуемое вещество | |||
| AgNO3 | ВаСl2 | НСl | | |
| 1 | | | | |
| 2 | | | | |
| 3 | | | | |
Конкурс 7: «Крестики – нолики» раздается задания командам
приложение 4
Химические свойства неметаллов и их соединений повторяем, играя в «крестики-нолики». Уравнения реакций представители команд записывают на листе с заданием. Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №1
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с оксидом серы (IV). Составьте уравнения реакций взаимодействия оксида серы (IV) с веществами, формулы которых составляют выигрышный путь.
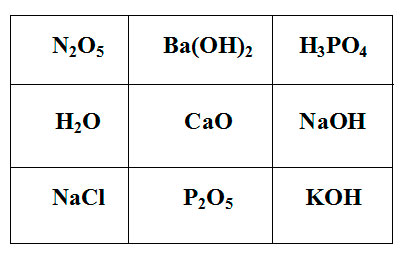
Задание для группы №2
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с соляной кислотой. Составьте уравнения реакций взаимодействия соляной кислоты с веществами, формулы которых составляют выигрышный путь.
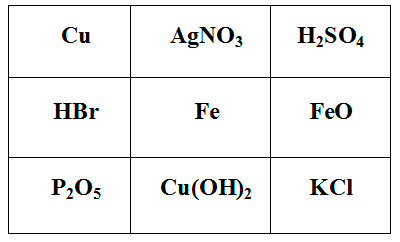
Задание для группы №3
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с аммиаком. Составьте уравнения реакций взаимодействия аммиака с веществами, формулы которых составляют выигрышный путь.
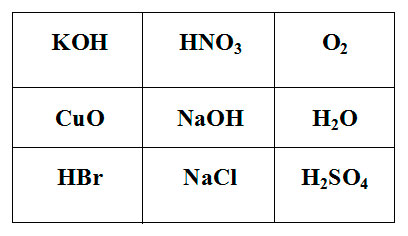
Задание для группы №4
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с карбонатом калия. Составьте уравнения реакций взаимодействия карбоната калия с веществами, формулы которых составляют выигрышный путь.
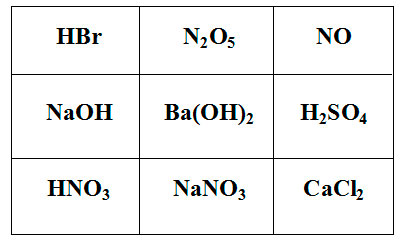
-
Подведение итогов урока.
Выставление оценок по полученным баллам команд.
-
Домашнее задание: Подготовка к контрольной работе.
Приложение 1
Конкурс 2
Провести сравнительную характеристику неметаллов на примере углерода, фосфора, серы и хлора. Каждая группа получает таблицу и заполняет один столбец. (5 минут)
| Углерод (1) | Фосфор (2) | Сера (3) | Хлор (4) | |
| Положение в П.С. | | | | |
| Электронная формула | | | | |
| Формулы простых веществ (аллотропия) | | | | |
| Физические свойства | | | | |
| Высший оксид | | | | |
| Летучее водородное соединение | | | | |
Приложение 1
Конкурс 2
Провести сравнительную характеристику неметаллов на примере углерода, фосфора, серы и хлора. Каждая группа получает таблицу и заполняет один столбец. (5 минут)
| Углерод (1) | Фосфор (2) | Сера (3) | Хлор (4) | |
| Положение в П.С. | | | | |
| Электронная формула | | | | |
| Формулы простых веществ (аллотропия) | | | | |
| Физические свойства | | | | |
| Высший оксид | | | | |
| Летучее водородное соединение | | | | |
Приложение 2
ТЕКСТ.
Все химические элементы разделяют на …….. и ……. в зависимости от строения и свойств их атомов.
Если для атомов ……… характерны сравнительно большие радиусы и небольшое число электронов на внешнем уровне (1ē – З ē), атомам …………., наоборот, свойственны небольшие радиусы атомов и число электронов на внешнем энергетическом уровне от 4 до 8 (у бора этих электронов 3, но атомы этого элемента имеют очень небольшой радиус). Отсюда и стремление атомов …….. к приему недостающих до заветной восьмерки электронов, т. е. окислительные свойства, а для атомов …….— стремление к отдаче внешних электронов, т. е. восстановительные свойства.
Среди 109 известных сегодня химических элементов (из них 88 элементов- …….. найдено в природе), а …….. - 22 элемента. ……….. в периодической системе расположены в основном под диагональю В—At, а …….. — по этой диагонали и над ней.
Свойства простых веществ, образуемых ………, отличаются большим разнообразием. Судите сами: водород Н2, кислород и озон 02 и 03, фтор F2, хлор С12, азот N2 — газы при обычных условиях, бром Вг2 — жидкость, а бор, углерод (алмаз, графит), кремний, фосфор (красный и белый), сера (пластическая и ромбическая), селен, теллур, иод 12, астат — твердые вещества.
Если для подавляющего большинства ….. характерен серебристо-белый цвет, то окраска ……. — простых веществ охватывает все цвета спектра: красный (красный фосфор, красно-бурый жидкий бром), желтый (сера), зеленый
(хлор — желто-зеленый газ), фиолетовый (пары йода).
Температуры плавления ……. лежат в очень широком интервале: от 3800 °С у графита до -210 °С у азота.
Эта особенность свойств ……. является следствием образования ими двух типов кристаллических решеток: молекулярной (02, N2, галогены, белый фосфор и др.) и атомной (алмаз, графит, кремний, бор и др.). Разным строением кристаллических решеток объясняется и явление аллотропии. Например, элемент фосфор образует простое вещество с молекулярной кристаллической решеткой — белый фосфор, молекулы которого имеют состав Р4, и простое вещество с атомной кристаллической решеткой — красный фосфор Р.
Вторая причина аллотропии связана с разным числом атомов в молекулах простых веществ. Типичный пример — простые вещества, образуемые кислородом: обычный кислород 02 и озон О3.
Приложение 3
Конкурс 6: Химический практикум (работа в группе)
Лабораторная работа
Инструкция
Определить - в какой из пробирок находятся: находятся хлорид натрия, сульфат натрия, карбонат натрия, используя предложенные реактивы. Уравнения записать в молекулярной и ионной форме.
1. Разделить полученные растворы пополам.
2. Определить под какими номерами находятся неизвестные вещества
При проведении химического эксперимента соблюдайте ТЕХНИКУ БЕЗОПАСНОСТИ.
| Реактивы | Исследуемое вещество | |||
| AgNO3 | ВаСl2 | НСl | | |
| 1 | | | | |
| 2 | | | | |
| 3 | | | | |
Конкурс 6: Химический практикум (работа в группе)
Лабораторная работа
Инструкция
Определить - в какой из пробирок находятся: находятся хлорид натрия, сульфат натрия, карбонат натрия, используя предложенные реактивы. Уравнения записать в молекулярной и ионной форме.
1. Разделить полученные растворы пополам.
2. Определить под какими номерами находятся неизвестные вещества
При проведении химического эксперимента соблюдайте ТЕХНИКУ БЕЗОПАСНОСТИ.
| Реактивы | Исследуемое вещество | |||
| AgNO3 | ВаСl2 | НСl | | |
| 1 | | | | |
| 2 | | | | |
| 3 | | | | |
Приложение 4
Конкурс 7: «Крестики – нолики»
Химические свойства неметаллов и их соединений. Уравнения реакций записываете на листе с заданием . Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №1
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с оксидом серы (IV). Составьте уравнения реакций взаимодействия оксида серы (IV) с веществами, формулы которых составляют выигрышный путь.

Конкурс 7: «Крестики – нолики»
Химические свойства неметаллов и их соединений. Уравнения реакций записываете на листе с заданием . Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №2
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с соляной кислотой. Составьте уравнения реакций взаимодействия соляной кислоты с веществами, формулы которых составляют выигрышный путь.

Приложение 4
Конкурс 7: «Крестики – нолики»
Химические свойства неметаллов и их соединений. Уравнения реакций записываете на листе с заданием . Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №3
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с аммиаком. Составьте уравнения реакций взаимодействия аммиака с веществами, формулы которых составляют выигрышный путь.

Конкурс 7: «Крестики – нолики»
Химические свойства неметаллов и их соединений. Уравнения реакций записываете на листе с заданием . Правильное выполнение задания оценивается в 5 баллов.
Задание для группы №4
Покажите выигрышный путь, состоящий из формул веществ, взаимодействующих с карбонатом калия. Составьте уравнения реакций взаимодействия карбоната калия с веществами, формулы которых составляют выигрышный путь.

Приложение 5
Оценочный лист: Команда № ________
| Конкурс | Балл |
| Конкурс 1: Название команды | |
| Конкурс 2: Характеристика неметалла | |
| Конкурс 3: Дальше - дальше | |
| Конкурс капитанов 4: Найди ошибки | |
| Конкурс 5: Загадочный элемент | |
| Конкурс 6: Химический практикум | |
| Конкурс 7: Крестики-нолики | |
Оценочный лист: Команда № ________
| Конкурс | Балл |
| Конкурс 1: Название команды | |
| Конкурс 2: Характеристика неметалла | |
| Конкурс 3: Дальше - дальше | |
| Конкурс капитанов 4: Найди ошибки | |
| Конкурс 5: Загадочный элемент | |
| Конкурс 6: Химический практикум | |
| Конкурс 7: Крестики-нолики | |
Оценочный лист: Команда № ________
| Конкурс | Балл |
| Конкурс 1: Название команды | |
| Конкурс 2: Характеристика неметалла | |
| Конкурс 3: Дальше - дальше | |
| Конкурс капитанов 4: Найди ошибки | |
| Конкурс 5: Загадочный элемент | |
| Конкурс 6: Химический практикум | |
| Конкурс 7: Крестики-нолики | |
Оценочный лист
1 задание – 1 балл
2 задание – 3 балла (по 0,5 балла за параметр)
3 задание – 1 балл (за правильно угаданный элемент)
4 задание – 15 баллов (за одно правильно вставленное слово 1 балл)
5 задание – 5 баллов (Если ответ готов после первого определения, то команда получает 5 баллов, после второго – 4, после третьего – 3,после четвертого – 2, после пятого – 1, не угадано вещество – 0)
6 задание – 3 балла (по 1 баллу за каждое правильно определенное вещество)
7 задание- 2 балла
| Процент | Оценка | |
| 27-30 | 81 - 100 | 5 |
| 20 - 26 | 66 - 81 | 4 |
| 15 - 20 | 50 - 65 | 3 |
| Меньше 14 | Меньше 50 | 2 |
Здесь представлен конспект к уроку на тему «Неметаллы», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

