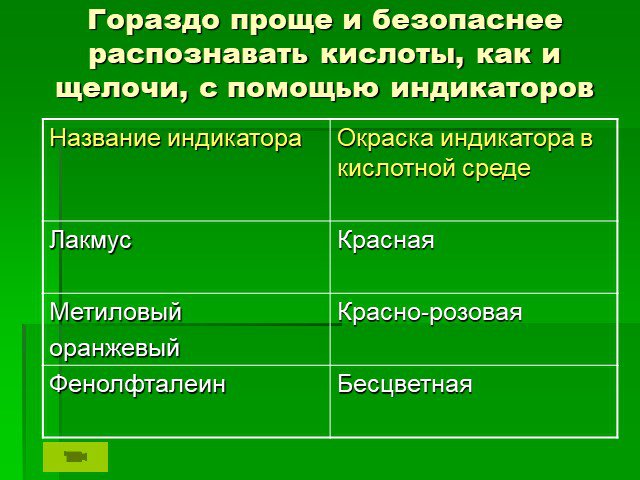
Презентация "Знакомство с кислотами" по химии – проект, доклад
Презентацию на тему "Знакомство с кислотами" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Знакомство с Алканами
План. Определение. Общая формула класса углеводородов. Гомологический ряд. Виды изомерии. Номенклатура алканов Строение алканов. Физические свойства. ...Знакомство с лабораторным оборудованием. Приемы нагревания
Цель:. Познакомиться с лабораторным оборудованием; Освоить приёмы нагревания. Техника безопасности. Ознакомьтесь с правилами ТБ на стр. 43-44. Лабораторное ...Органические вещества. Нуклеиновые кислоты
Цель урока: изучение строения и функций нуклеиновых кислот. Задачи: Образовательная: показать взаимосвязь строения и выполняемой функции на примере ...Соли угольной кислоты
Соли угольной кислоты-карбонаты и гидрокарбонаты. Na2CO3 –карбонат натрия NaHCO3 -гидрокарбонат натрия CaCO3 -карбонат кальция Ca(HCO3)2 –гидрокарбонат ...Свойства уксусной кислоты
Немного истории... Уксус является продуктом брожения вина. Первое упоминание о его практическом применении относится к третьему веку до н. э. Греческий ...Производство серной кислоты
Серная кислота. H2SO4 cуществует в природе как самостоятельное химическое соединение, представляет собой бесцветную маслянистую жидкость без запаха ...Производство серной кислоты
Исторические сведения. Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса ...Предельные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Карбоновые кислоты
Карбоновые кислоты – это производные углеводородов, содержащие функциональную группу СООН(карбоксил). Формулы и названия некоторых распространённых ...Карбоновые кислоты
План изучения темы:. Определение. Классификация карбоновых кислот. Номенклатура . Изомерия. Физические свойства. 6. Химические свойства. 7. Получение. ...Карбоновые кислоты
Цель урока. Дать понятие о карбоновых кислотах и их классификации. Рассмотреть основы международной и тривиальных номенклатур, применение карбоновых ...Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых ...Карбоновые кислоты
Карбоновые кислоты. Карбоновые кислоты – это органические вещества, содержащие в своем составе карбоксильную группу (- COOH). Классификация карбоновых ...Высшие природные полимеры - Белки и Нуклеиновые кислоты
Цель урока: Закрепить и углубить представления учащихся о природных полимерах на примере белков и нуклеиновых кислот. Систематизировать знания о составе, ...Воздействие серной кислоты на углеводы
Углеводы. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся ...Органические кислоты
Выберите раздел Лимонная кислота. Муравьиная кислота. Ацетилсалициловая кислота. Молочная кислота Яблочная кислота. Высшие жирные кислоты. Уксусная ...Подготовка к ЕГЭ: Кислородсодержащие органические соединения. Карбоновые кислоты
Органические карбоновые кислоты характеризуются наличием карбоксильной группы –СООН. По числу групп различают: одно- СН3-СООН – уксусная или этановая ...Карбоновые кислоты
Классификация карбоновых кислот. По числу карбоксильных групп. непредельные ароматические одноосновные двухосновные многоосновные предельные. По типу ...Предельные одноосновные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Карбоновые кислоты
Метановая кислота, НСООН. Муравьиная кислота В природе: хвоя, крапива, фрукты, выделения пчёл и муравьёв Применение: заготовка корма - антибактериальное ...Конспекты
Знакомство с наукой химией
Селиверстова Т.Г. МОУ СОШ № 106. г. Волгоград. Урок по теме: «Знакомство с наукой химией». Цели урока:. Формирование у обучающихся начальной ...Генетическая связь между углеводородами,спиртами,альдегидами,спиртами,карбоновыми кислотами
Тажибаева Асемгуль Исинтаевна. Учитель Каменнобродской средней школы. Урок химии в 11 классе. Тема урока:Генетическая связь между углеводородами,спиртами,альдегидами,спиртами,карбоновыми ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Федотова Елена Геннадьевна Учитель химии
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию