Презентация "Производство серной кислоты" по химии – проект, доклад
Презентацию на тему "Производство серной кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 23 слайд(ов).
Слайды презентации
Список похожих презентаций
Производство серной кислоты
Сернокислотные заводы. Пирит обыкновенный. Черный пирит. Самородная сера. Сероводород. Сульфиды цветных металлов. Подготовка сырья. Измельчение пирита. ...Производство серной кислоты
Цель: обобщить сведения о стадиях и принципах, используемых при промышленном производстве серной кислоты. Рифмованные строчки. Для закрепления сейчас ...Производство серной кислоты
Сырьё. FeS2 - пирит, серный колчедан, железный колчедан S8 самородная ромбическая сера H2S – сероводород Сu2S; ZnS; PbS – сульфиды цветных металлов ...Производство серной кислоты (польза и вред)
Цель работы:. Узнать: из чего получают серную кислоту; как получают серную кислоту; для чего получают серную кислоту; вредно ли производство серной ...Производство серной кислоты контактным способом
Сырьё, используемое для производства серной кислоты:. 1. Самородная сера S 2. Пирит (серный колчедан) FeS2 3.Сероводород H2S 4. Сульфиды цветных металлов ...Производство серной кислоты контактным способом.
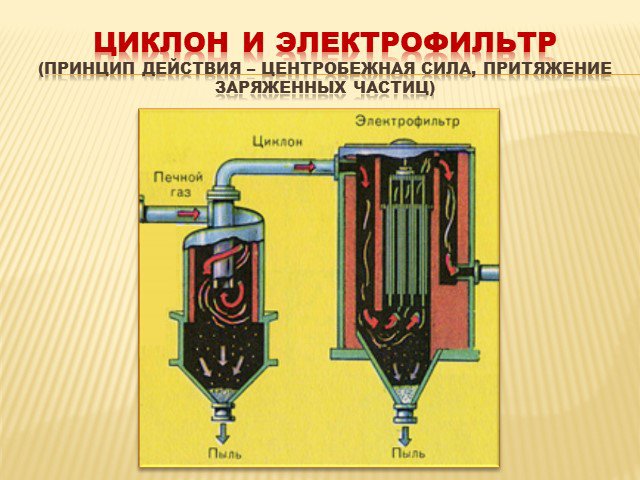
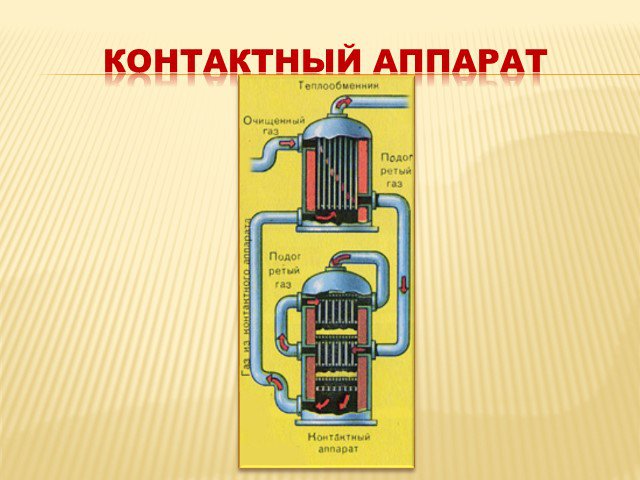
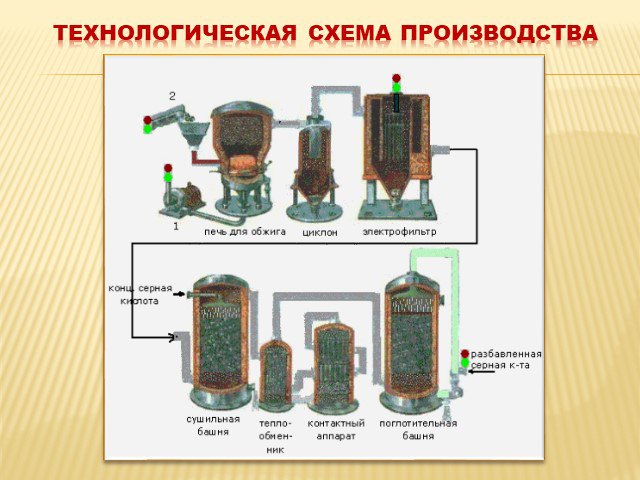
газ. Сжигание серного колчедана, при этом образуются печной газ SO2 и огарок Fe2O3 : 4FeS2 +11O2→2Fe2O3+8SO2. Печь для обжига в кипящем слое. Циклон ...Производство серной кислоты
Исторические сведения. Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса ...Химические свойства серной кислоты
Ход урока:. Повторение предыдущей темы: 1. Что такое кислота с точки зрения ЭД. 2. Формула серной кислоты, валентность атома серы и степень окисления. ...Воздействие серной кислоты на углеводы
Углеводы. Углеводы – органические вещества, молекулы которых состоят из атомов углерода, водорода и кислорода, причем водород и кислород находятся ...Нитрозный способ получения серной кислоты
Реагенты. Медь Азотная кислота Сульфит натрия Раствор серной кислоты 70%. Приборы. Две колбы Вюрца Трехгорлая колба 2 газоотводных шланга Штативы ...Серная кислота, свойства серной кислоты
Состав. Кислоты - это сложные вещества, в молекулах которых содержат атомы водорода и кислотный остаток H-R, где R-кислотный остаток При электролитической ...Производство мыла
Знать – хорошо, но уметь – лучше. Гейбель ИСТОРИЯ 1. «ВОПРОСИТЕЛЬНАЯ» В этом учебном году мы начали изучать органическую химию и перед нами открылся ...Производство алюминия
ПЛАН ИЗУЧЕНИЯ АЛЮМИНИЯ: 1. Алюминий – химический элемент 1.1. Положение в ПСХЭ; 1.2. Строение атома. 2. Алюминий – простое вещество. 2.1 Нахождение ...Производство аммиака
Изучить научные принципы производства аммиака. Цель. Задачи. Разработать оптимальные условия синтеза аммиака. Составить технологическую схему производства. ...Угольная и кремниевая кислоты и их соли
Напишите уравнения соответствующих реакций в ионном виде. Na2CO3 →NaHCO3 →Na2CO3.Запишите уравнения реакций, соответствующих схеме. Качественные ...
Предельные одноосновные карбоновые кислоты
Тема урока: «Предельные одноосновные карбоновые кислоты». Цель урока: •Знать строение одноосновных карбоновых кислот, их определение, изомеры, гомологи, ...Карбоновые кислоты
Карбоновые кислоты — класс органических соединений, молекулы которого содержат карбоксильную группу - COOH. Состав предельных одноосновных карбоновых ...Карбоновые кислоты
Общая формула карбоновых кислот: 1) R – СНО 2) R – СООН 3) R – СН2 – ОН 4) R – СО – О – R΄. Карбоксильную группу содержат молекулы: 1) сложных эфиров ...Муравьиная и уксусная кислоты
Карбоновые кислоты очень часто встречаются в нашей жизни .Человек использует их практически во всех сферах жизни, наиболее используемые это муравьиная ...Неорганические кислоты
Кислотный остаток. Задание классу. Прослушайте аудиозапись определения кислот. Ответьте на вопросы:. 1.В данном ряду найдите формулу кислоты. Поясните. ...Конспекты
Производство серной кислоты
Производство серной кислоты. . Сырьё для получения:. самородная ромбическая сера, пирит (серный колчедан, железный колчедан), сульфиды цветных ...Производство серной кислоты контактным способом
Салищева О. льга Георгиевна. . Федеральное государственное казенное общеобразовательное учреждение «СОШ №3» г. Приозерск. . учитель химии. ...Окислительные свойства концентрированной серной кислоты
Дата_____________ Класс_______________. Тема: Окислительные свойства концентрированной серной кислоты. Цели урока:. ознакомиться с окислительными ...Химические свойства серной кислоты
Урок химии, 9 класс, 45 мин. разработан учителем химии МОУ «Рамешковская СОШ» Габлиной В.И. Тема: Химические свойства серной кислоты. Цели: Сформировать ...Химические свойства серной кислоты
. Химические свойства серной кислоты. Данный урок- презентация по теме « Химические свойства серной кислоты» позволяет реализовать ...Свойства серной кислоты
Свойства серной кислоты. Девиз: "Наши знания суть зерна наших творений". . . Г. Бюффон. Цели. : повторить строение молекулы серной кислоты, ...Производство азотной кислоты
ПЛАН-КОНСПЕКТ УРОКА. «Производство азотной кислоты. ». . 1. ФИО:. Семёнычева Лариса Витальевна. 2. Место работы:. МОУ СОШ №12. 3. Должность:. ...Пути познания серной кислоты
Пути познания. серной кислоты. Познание - это солнечный свет, без которого не может развиваться человечество. Н.Бердяев. «. О мощности государства ...Приключения серной кислоты
Урок - сказка «Приключение Серной Кислоты». (9 класс). Цели урока: Закрепить и проверить знания учащихся по теме «Подгруппа кислорода», сравнить ...Окислительные свойства серной кислоты
Конспект урока. Данные об учителе: Загребина Анастасия Павловна. учитель МБОУ Июльской СОШ, 1 категория, запрашиваемая 1 категория. Предмет. : химия. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:25 апреля 2015
Категория:Химия
Содержит:23 слайд(ов)
Поделись с друзьями:
Скачать презентацию