Презентация "Химическое равновесие" по химии – проект, доклад
Презентацию на тему "Химическое равновесие" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 19 слайд(ов).
Слайды презентации
Список похожих презентаций
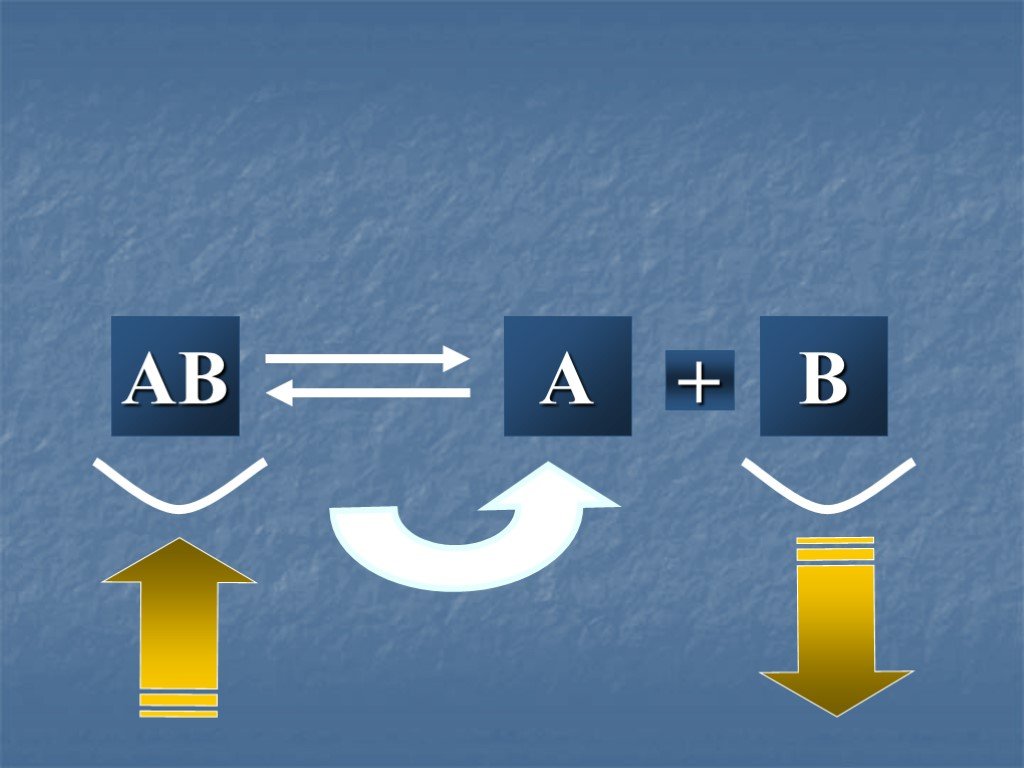
Обратимость химических реакций. Химическое равновесие
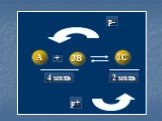
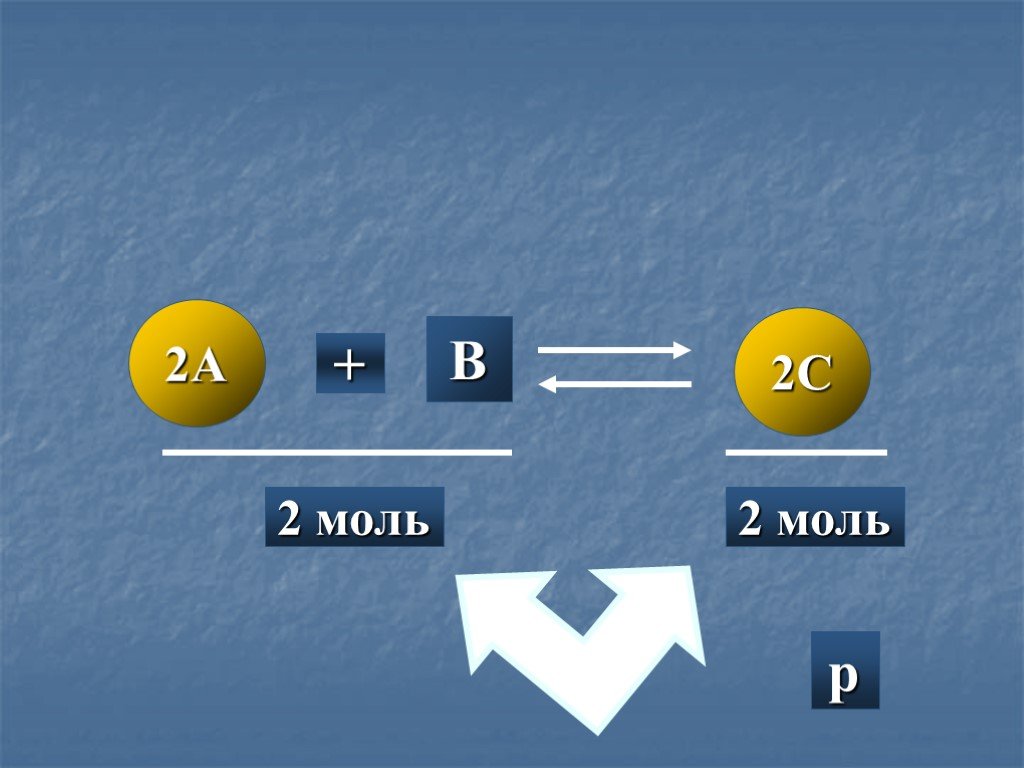
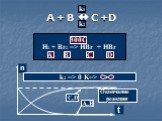
Какие из химических реакций являются обратимыми?1. NaOH + HCl NaCl + H2O 2. N2 + 3H2 2NH3 3. AgNO3 + NaCl AgCl + NaNO3 4. SO3 + H2O H2SO4 ...
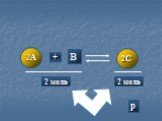
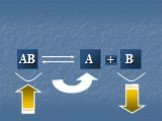
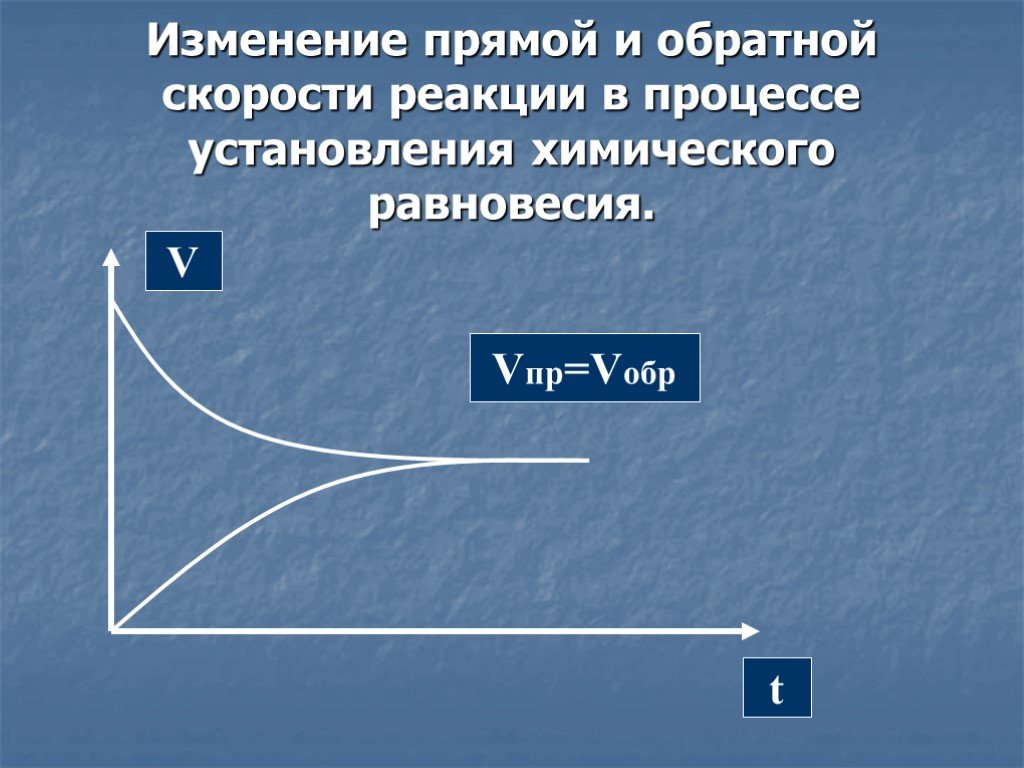
Химическое равновесие
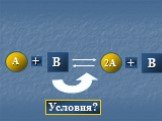
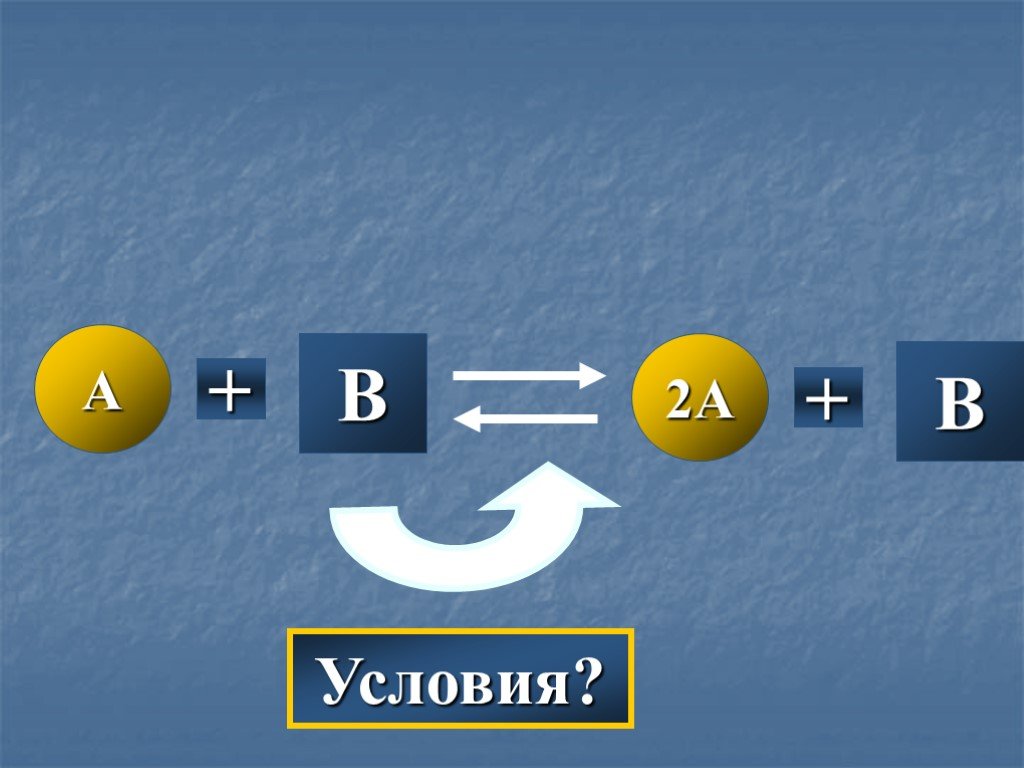
1.В пробирку №1 и №2 поместили оксид меди. В каждую добавили серной кислоты. Пробирку №2 нагрели. Объясните, как идет реакция в обоих пробирках? CuO+H2SO4=CuSO4 ...Химическое равновесие. Факторы, влияющие на смещение равновесия
1) NaOH + HCl → NaCl + H2O; 2) H2 + I2 → 2HI; 3) C + O2 → CO2; 4) CaCO3 + 2HCl → CaCl2 + CO2 + H2O. 5) N2 + 3H2 → 2NH3 6) С6Н12 → С6Н6 + 3Н2. Обратимые ...Кинетика химических реакций.Химическое равновесие
NaOH + HCl = NaCl + H2O Na+ + OH ─ + H+ + Cl─ = Na+ + Cl─ + H2O. Секунды и доли секунд. + _. MgO(к) + H2O = Mg(OH)2 (к) при 25оС - 5 ÷ 6 месяцев (медленно) ...Химическое оружие
Виды ОВ. Отравляющие вещества кожно-нарывного действия. Отравляющие вещества общеядовитого действия. Отравляющие вещества нервно-паралитического действия. ...Химическое оружие
В последние годы в западных средствах массовой информации дискутируются проблемы новой «экзотической войны», подстерегающей человечество в XXI веке. ...Химическое оборудование
Классификация химической посуды. По материалу посуда из обычного стекла: бутыли для хранения растворов, мензурки и др.; посуда из специального химически ...Химическое кафе «Кислоты»
Меню. 1. Дегустация 2. Первое блюдо. Понятийный тест 3.Химческое печенье 4.Английская закуска 5.Бутерброды 6.Винегрет 7.Коктейль 8.Дисерт «Фантазия» ...Химическое загрязнение среды
На всех стадиях своего развития человек был тесно связан с окружающим миром. Но с тех пор как появилось высокоиндустриальное общество, опасное вмешательство ...Мыло. История получения. Химическое строение.
КЛАССИФИКАЦИЯ МЫЛОВ. ИСТОРИЯ СОЗДАНИЯ МЫЛОВ. Около 2800 года до нашей эры – изобретение мыла в Вавилоне Около 2200 года – подробное описание технологии ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Органическая химия "Жиры"
Рацион питания Белки Жиры Углеводы 2а, 2б 1 4б, 5. Роль жиров в здоровом питании спортсменов.Жиры хорошо усваиваются организмом, имеют высокую калорийность, ...
Органическая химия как наука
Содержание. Знакомство с историей возникновения науки органическая химия Органические вещества Схемы реакций Органическая химия Электронное строение ...«Задачи» химия
- исследование задач по нанонауке; - ознакомление с наномиром: о достижениях нанохимии и нанотехнологии; - составление задач по нанонауке; - решение ...Органическая химия
Органическая химия – химия углеводородов и их производных. Углеводороды (УВ) – простейшие органические вещества, молекулы которых состоят из атомов ...Сложные эфиры химия
Цели урока:. 1.Изучить строение сложных эфиров. 2.Познакомиться с механизмом реакции этерификации. Номенклатура. Названия сложных эфиров происходит ...Углеводы химия
Содержание. Классификация углеводов Моносахариды Нахождение в природе Изомерия Получение Физические свойства Химические свойства Источники информации. ...Коллоидная химия
Признаки объектов коллоидной химии. Поперечный размер частицы (а) – диаметр для сферических частиц (d) и длина ребра для кубических частиц (l). Дисперсность ...Кто ты и откуда химия?
Откуда пошло слов химия? Хи́мия (от араб. کيمياء, предположительно от египетского «chemi» — чёрный, откуда также греческое название Египта, чернозёма ...Азот химия
План урока:. История открытия Цели Нахождение в природе Строение и свойства атома и молекулы Физические и химические свойства Получение и применение ...Конспекты
Понятие о скорости химической реакции. Катализаторы. Химическое равновесие
Дата_____________ Класс_______________. Тема:. . Понятие о скорости химической реакции. Катализаторы. Химическое равновесие. Цели урока:. повторить ...Скорость химических реакций. Химическое равновесие
Обобщение знаний по теме «Скорость химических реакций. Химическое равновесие». Цель:. Обобщение теоретических знаний учащихся о скорости химической ...Химическое ассорти
Из опыта работы. В современных условиях одной из главных. . задач образования-развитие функциональной грамотности учащихся, подготовка ребенка ...Металлы. Химическое пятиборье
Металлы. Химическое пятиборье. Урок повторения и обобщения темы « Металлы» в 9 классе. . . Учитель: Гузева В.П. МБОУ « СОШ с. Сергиевка» Калининского ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:3 марта 2019
Категория:Химия
Содержит:19 слайд(ов)
Поделись с друзьями:
Скачать презентацию







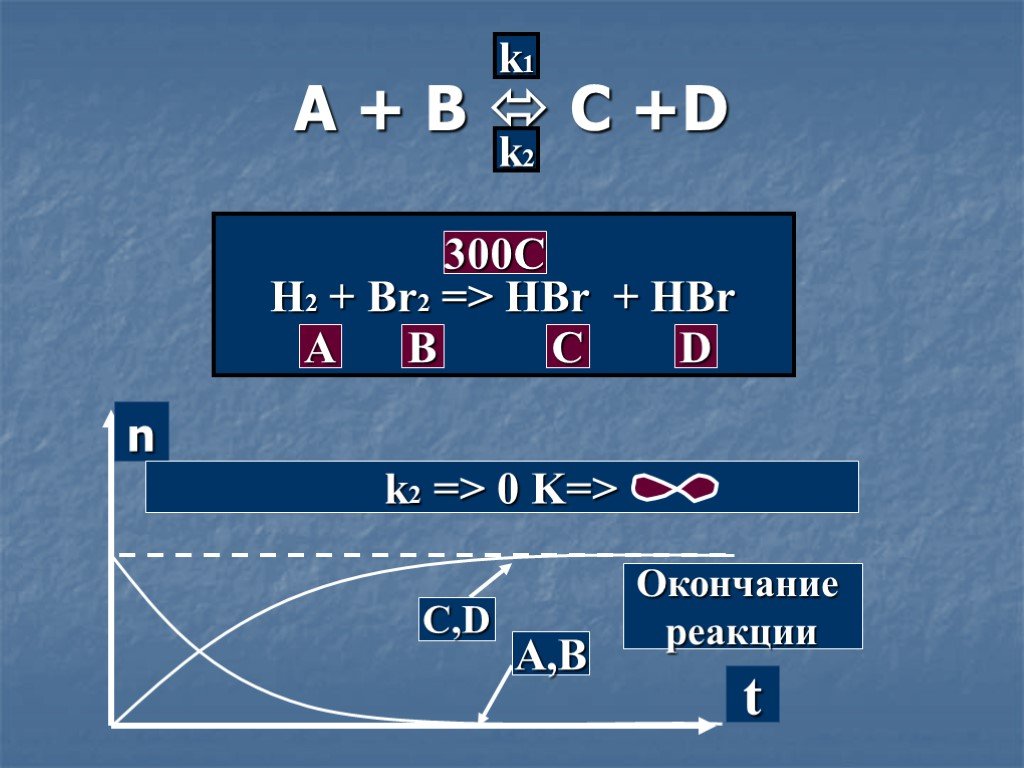
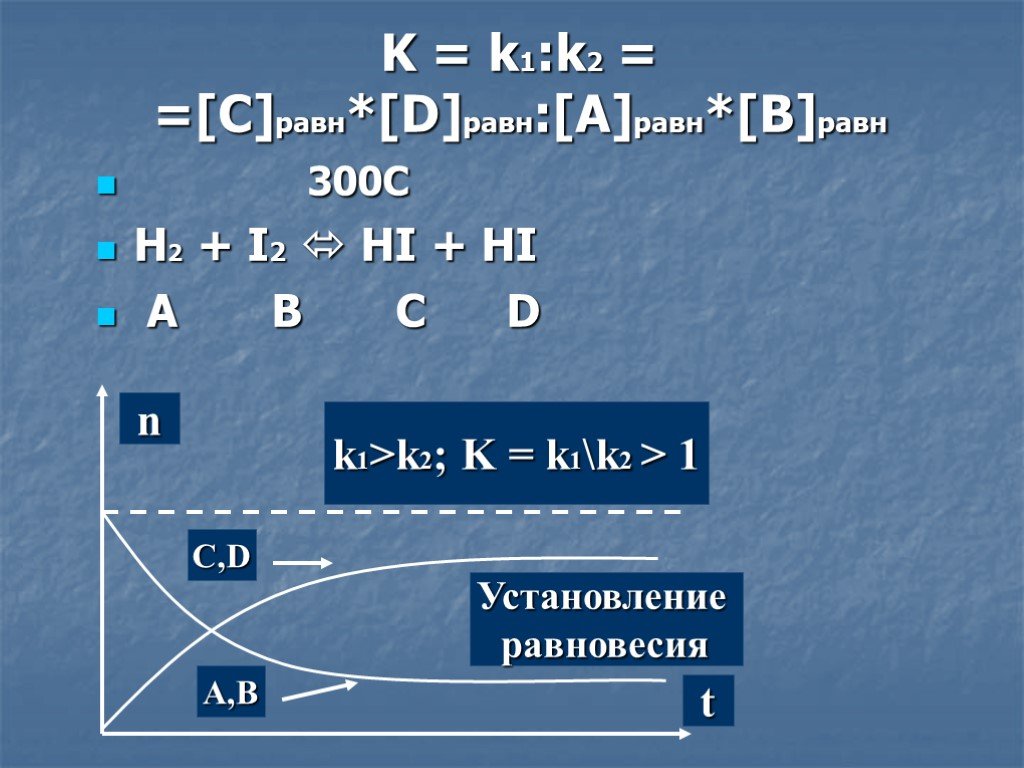



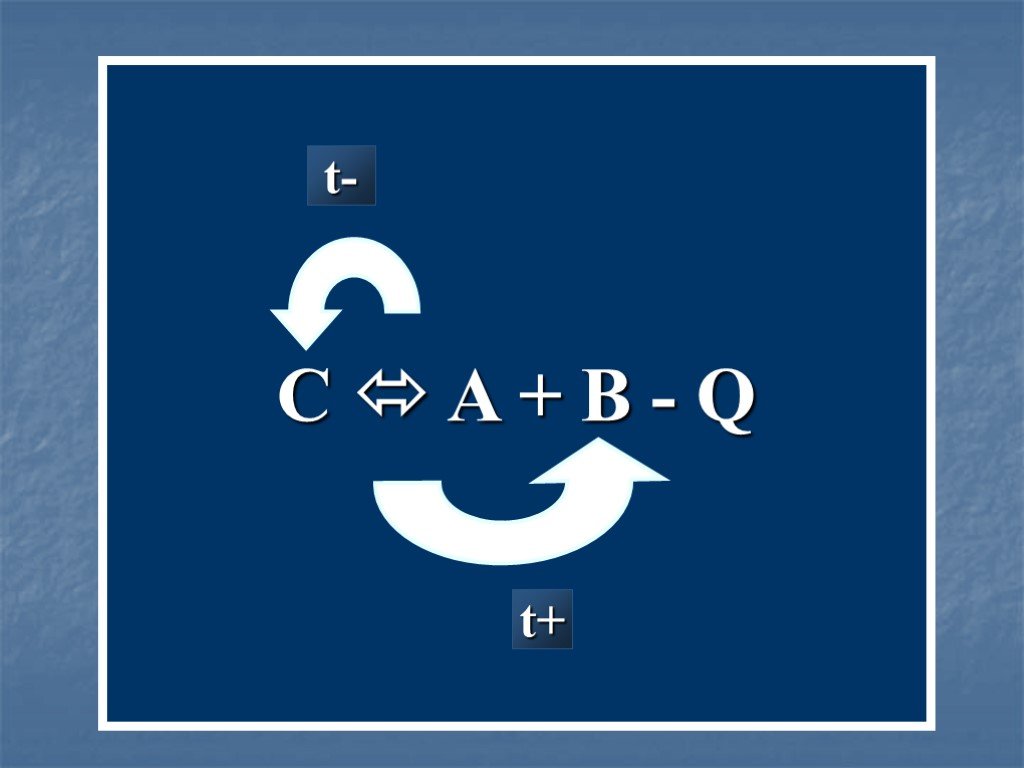
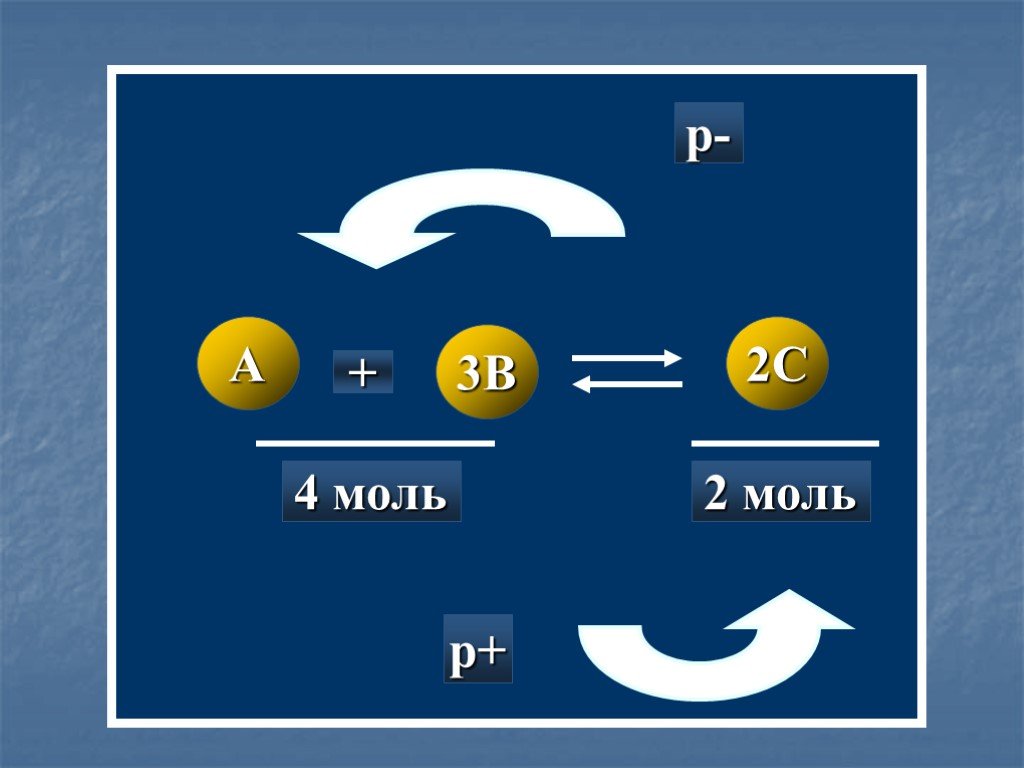








![K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн. 300C H2 + I2 HI + HI A B C D. Установление равновесия. k1>k2; K = k1\k2 > 1 K = k1:k2 = =[C]равн*[D]равн:[A]равн*[B]равн. 300C H2 + I2 HI + HI A B C D. Установление равновесия. k1>k2; K = k1\k2 > 1](https://prezentacii.org/upload/cloud/19/03/130145/images/thumbs/screen10.jpg)