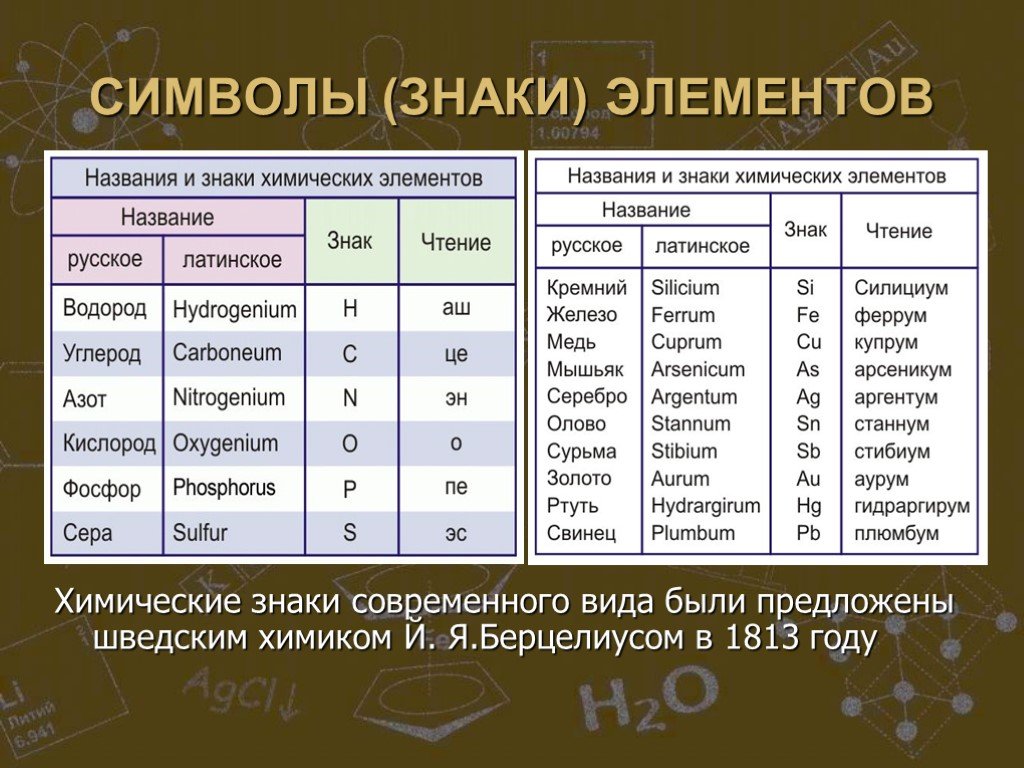
Презентация "Строение вещества" по химии – проект, доклад
Презентацию на тему "Строение вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 28 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение вещества
Вещество – то, из чего состоит физическое тело. Состояние вещества. Твердое Жидкое Газообразное. Твердое Жидкое Газообразное Стекло Железо Соль. Твердое ...Строение вещества химия
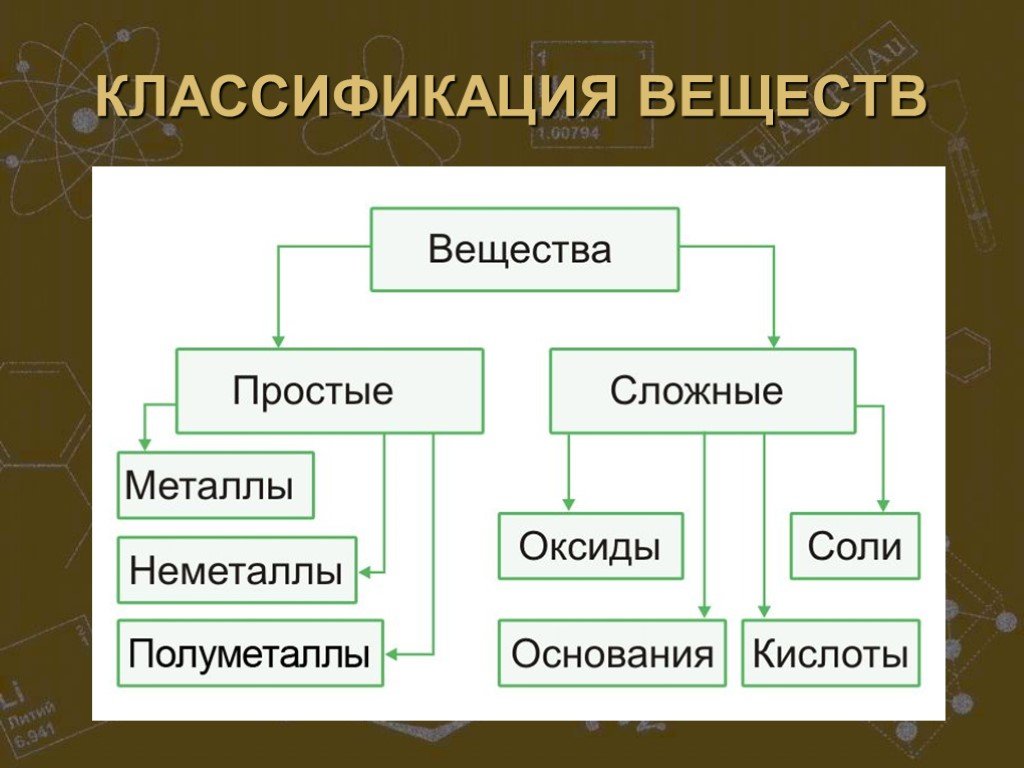
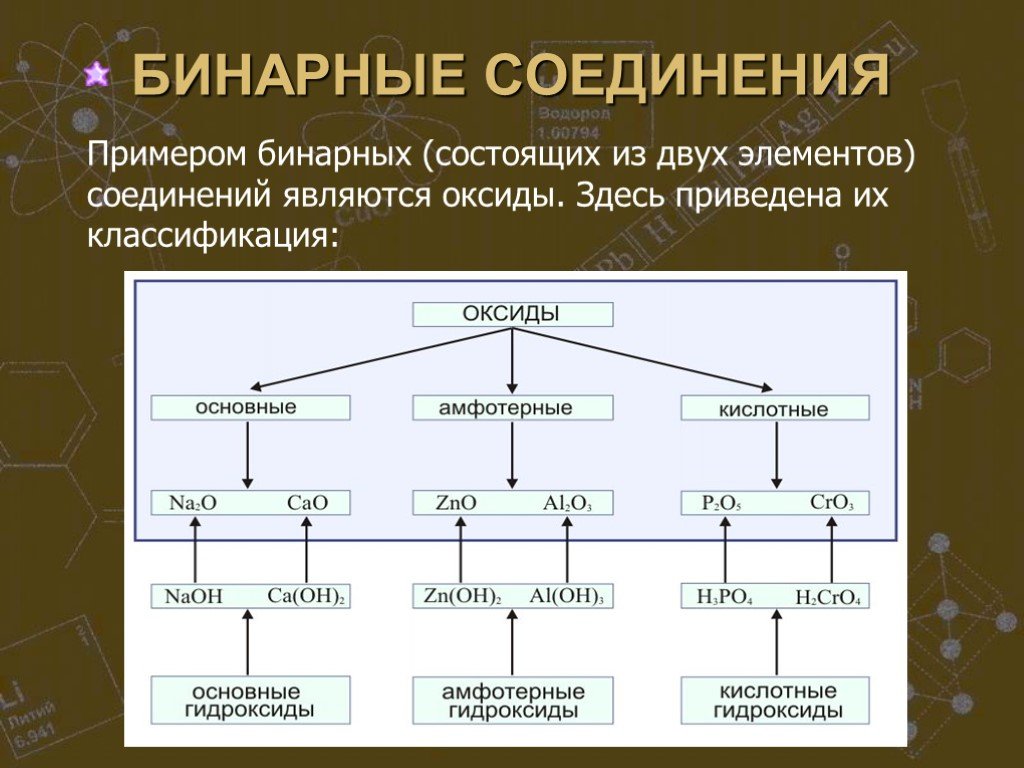
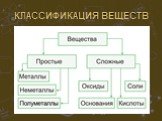
СТРОЕНИЕ ВЕЩЕСТВА. Основополагающий вопрос КАК УСТРОЕН МИР? Проблемные вопросы Из чего сделано все на Земле? Почему все устроено так, а не иначе? ...Сложные и простые вещества
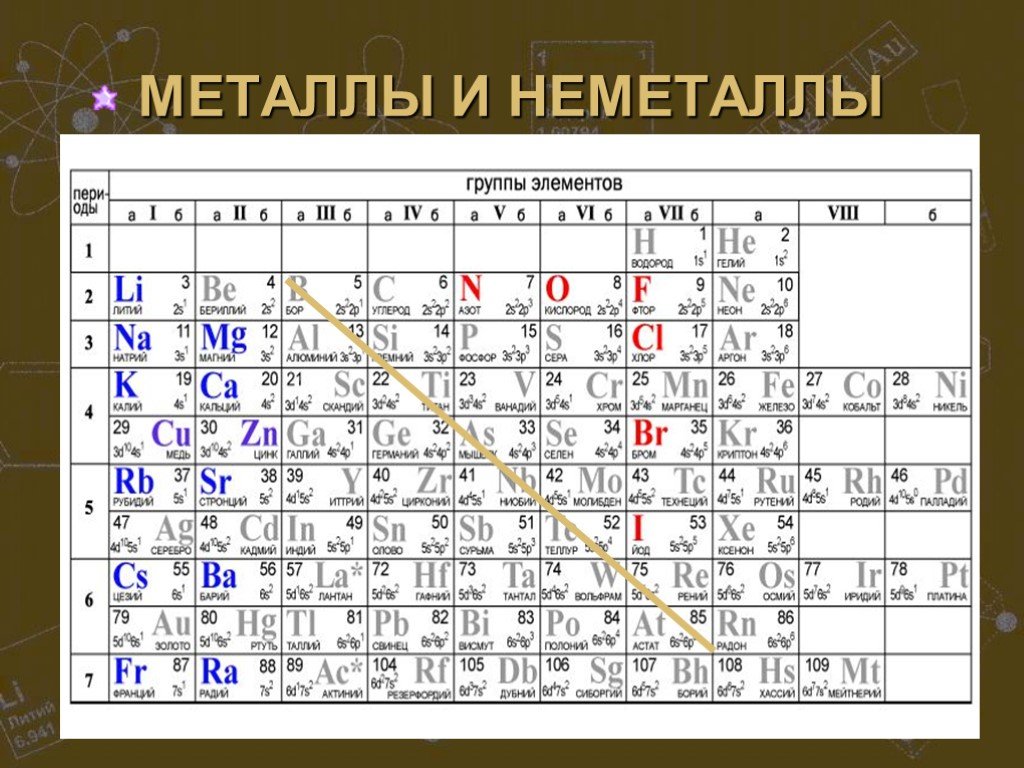
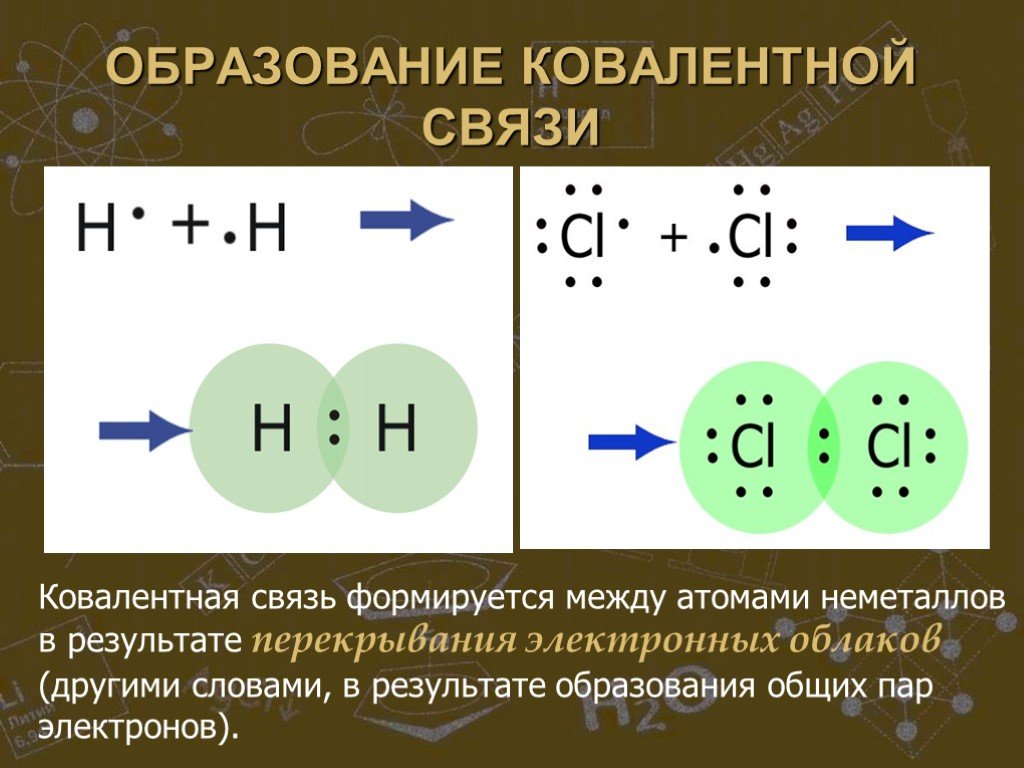
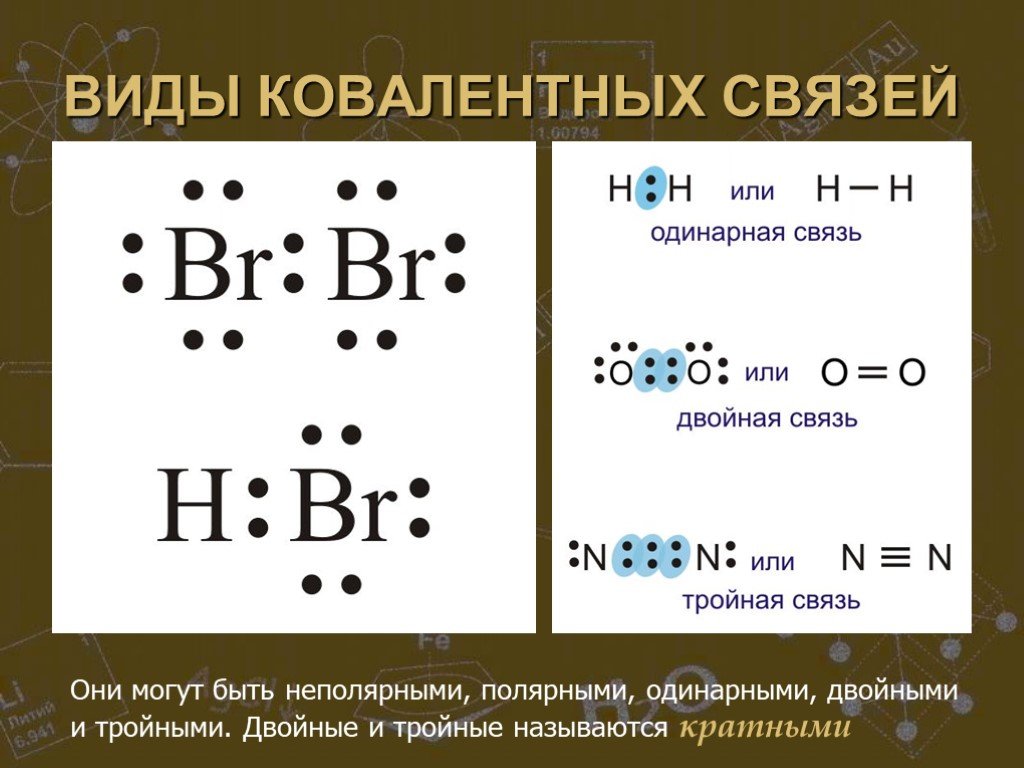
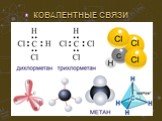
Простые вещества можно разделить по свойствам на металлы и неметаллы. Сера, хлор, алмаз и многие другие являются представителями неметаллов. К металлам ...Строение атома
Планетарная модель атома. электрон +. Общий заряд атома равен 0. - 3. Сравнение размеров ядра и электрона. Распределение электронов по электронным ...Чистые вещества и смеси
Цели урока:. Выяснить, какое вещество считают чистым. Что такое смесь? Какие бывают смеси? Выяснить различия между смесью и химическим соединением. ...Простые вещества металлы
Цель урока:. Рассмотреть свойства металлов во взаимосвязи с областью их применения Продолжить работу по формированию интереса к предмету, расширению ...Агрегатное состояние вещества
Общие понятия. Агрегатное состояние вещества- состояние вещества, характеризующееся определенными качественными свойствами. Строение твердых тел. ...Химические вещества в архитектуре города Минусинска
Цели:. показать влияние развития науки химии на архитектуру городов на примере г. Минусинска исследовать химический состав материалов, применяемых ...Белки. Строение и свойства
Белки. Белки – это высокомолекулярные органические соединения, состоящие из остатков аминокислот представляющие собой биополимер, состоящий из мономеров, ...Строение атомного ядра
Ядро. Ядро представляет собой центральную часть атома (см. также АТОМА СТРОЕНИЕ). В нем сосредоточены положительный электрический заряд и основная ...Агрегатные состояния вещества
План урока. Определение целей урока Выполнение лабораторного исследования Определение основных следствий эксперимента Решение качественных задач Решение ...Арены. Бензол. Строение молекулы бензола
1)Углеводороды с общей формулой СnН2n+2 2) Частица с одним свободным электроном 3) Суффикс, который используется в названиях органических веществ ...Агрегатные состояния вещества
1. Учение об агрегатных состояниях 1.3. Жидкое состояние вещества. 1.3.1. Основные понятия Жидкое агрегатное состояние является промежуточным между ...Агрегатное состояние вещества
Твердое тело. Состояние, характеризующееся способностью сохранять объём и форму. Атомы твёрдого тела совершают лишь небольшие колебания вокруг состояния ...Агрегатное состояние вещества
Существуют 3 основных агрегатных состояния вещества. Газообразное Твердое Жидкое. Чем же различаются данные вещества. Агрегатное состояние. Различия. ...Строение атома и атомного ядра
1896 г. Анри Беккерель (франц.) открыл явление радиоактивности. Радиоактивность – способность атомов к самопроизвольному излучению. 1899 г. Эрнест ...Строение и свойства предельных и непредельных углеводородов
Разминка. I I Вариант. 1.Углеводороды, содержащие. только простые связи. 2.Вещесва, сходные по строению, но отличающие на одну или несколько групп ...Строение атома углерода
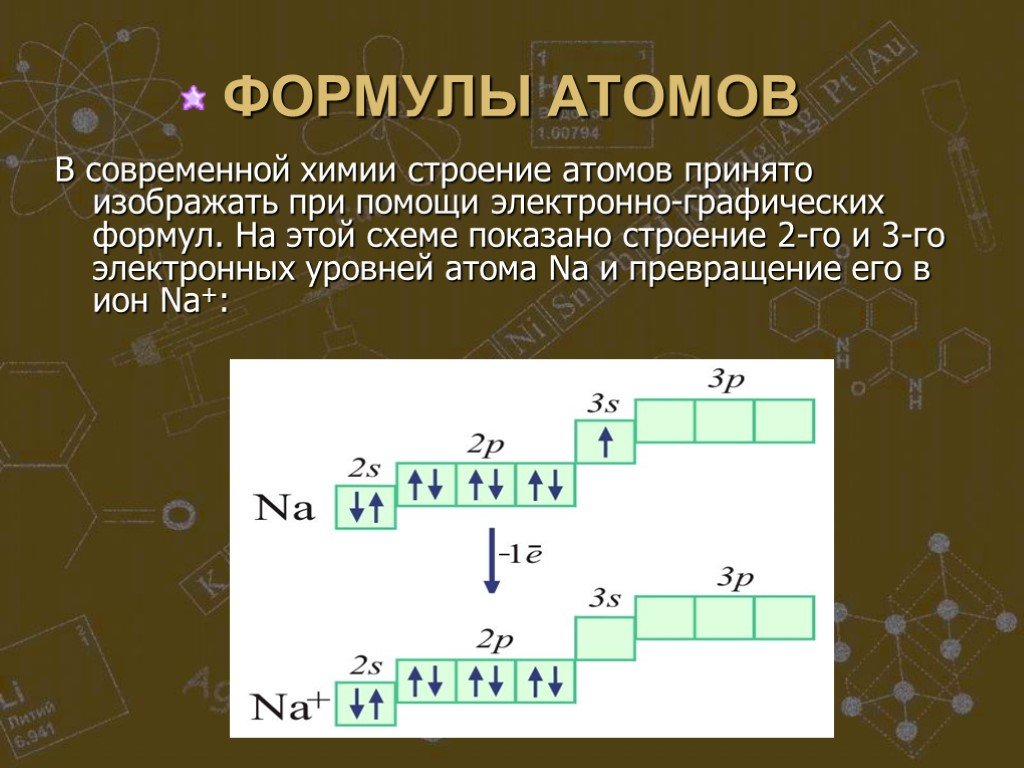
↓ ↓↑. Валентность углерода IV. Валентность углерода II. Строение атома углерода. 6 С 2е4е 1S2 2S2 2P2 6 С 2е4е 1S2 2S1 2P3. Гибридизация. Гибридизация ...Строение электронных оболочек атомов
Соотнесите химические формулы и формы существования химических элементов. 1) 2S 2) S8 3) 3H2O 4) Al2O3 5) 2Al 6) CuO. 1) свободные атомы 2) простые ...Вычисления массовой доли растворенного вещества
. Задачи ЕГЭ.1. Массовая доля серной кислоты в растворе, полученном при смешивании 120г 20 %-го и 40г 50 %-го растворов кислоты, равна ……...% (Запишите ...
Конспекты
Строение вещества
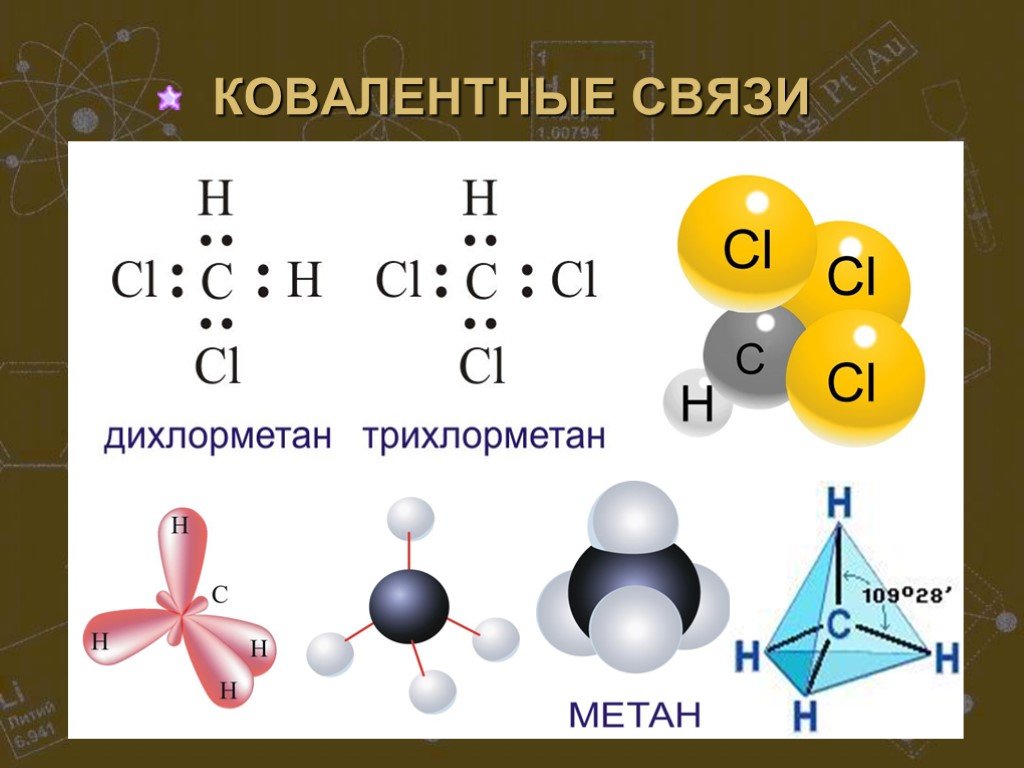
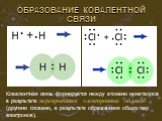
Автор: Теплов Сергей Евгеньевич. Место работы: МБОУ ООШ №30, г. Сургут. Должность: учитель физики. 7 класс. Тема урока: «Строение вещества». ...Химическая связь. Строение вещества. Кристаллические решетки
Дата ____________ Класс _____________. Тема: Химическая связь. Строение вещества. Кристаллические решетки. Цели урока:. закрепить и повторить ...Химическая связь. Строение вещества
Тема: Систематизация и обобщение знаний по теме «Химическая связь. Строение вещества». (стр. флипчарта 1 скрыть / показать). Цель:. . обобщить и ...Периодический закон и Периодическая система элементов Д. И. Менделеева. Строение вещества (ПОВТОРЕНИЕ)
Дата ______________ Класс_______________. Тема:. Периодический закон и Периодическая система элементов Д. И. Менделеева. Строение вещества (ПОВТОРЕНИЕ). ...Азот. Строение атома и молекулы, свойства простого вещества
Тема урока. «. Азот. Строение атома и молекулы, свойства простого вещества. » 9-й класс. . Цель урока:. . . изучение строения атома и молекулы ...Алюминий. Строение атома, физические и химические свойства простого вещества
ПЛАН-КОНСПЕКТ УРОКА. Тема: Алюминий. Строение атома, физические и химические свойства простого вещества. . . ФИО (полностью). . Иванова ...Строение атома
Урок по теме: «Строение атома». Задачи урока:. Образовательные. : сформировать представления о строении атома; дать понятие протон, электрон, ...Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной массе, количеству вещества или объему одного из вступающих или получающихся в реакции веществ
Дата_____________ Класс_______________. Тема:. . Вычисления по химическим уравнениям реакций массы, количества вещества или объема по известной ...Чистые вещества и смеси. Способы разделения смесей. Массовая доля вещества в смеси
Урок 38 / 8 « Чистые вещества и смеси. Способы разделения смесей. Массовая доля вещества в смеси». ( 8 класс – базовый уровень). Учитель:. . Дронова ...Чистые вещества и смеси. Способы разделения смесей
МОУ «Украинская СОШ». Омская облсть, Исилькульский район, с.Украинка. Тема урока:. «. Чистые вещества и смеси. . . Способы разделения ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Химия
Содержит:28 слайд(ов)
Поделись с друзьями:
Скачать презентацию