Слайд 1Спирты: классификация, изомерия, номенклатура Подготовила учитель химии Несмеянова М.В. МОУ «Сытьковская СОШ»Рузский район Московская область
Слайд 2Элементный состав этилового спирта установил А. Лавуазье Молекулярную формулу С2Н6О определил в 1833 г. Й. Я. Берцелиус, он же предложил называть термином алкоголи все подобные этиловому спирту вещества. Молекулярная формула этилового спирта С2Н5ОН
Слайд 3Спирты – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на гидроксильные группы -ОН. Этиловый спирт – одноатомный спирт.
Слайд 4Общая формула одноатомных спиртов CnH2n+1- OH В зависимости от природы углеводородного радикала различают предельные, непредельные и ароматические спирты. Спирты, в молекулах которых имеется одна гидроксильная группа, называются одноатомными.
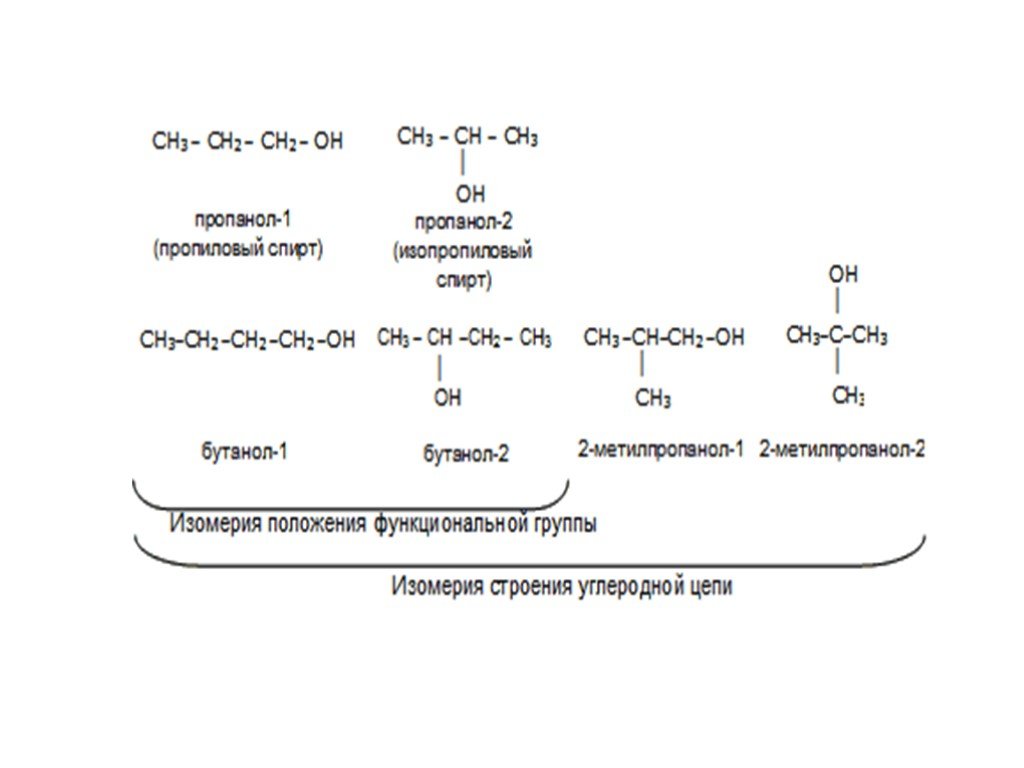
Слайд 5Простейшие одноатомные предельные спирты: CH3OH метанол (метиловый спирт), C2H5OH этанол (этиловый спирт). Все последующие их гомологи имеют изомеры:
Слайд 7Это интересно! Метиловый спирт (метанол) более широко известен как древесный спирт, т.к. раньше его получали исключительно при сухой перегонке древесины.
Слайд 8Это интересно! Этанол (этиловый спирт) еще называют “винным спиртом”, “алкоголем”, “медицинским спиртом”, и, наконец, когда говорят просто “спирт”, зачастую имеют в виду именно этанол. Это самый распространенный наркотик. Воздействуя на кору головного мозга, он вызывает характерное алкогольное возбуждение, связанное с ослаблением процессов торможения. Легкость его проникновения в различные ткани организма обусловлена его хорошей растворимостью и в водной среде, и в жировых тканях.
Слайд 9Это интересно! Амиловые (пентанолы) спирты содержатся в низкосортных алкогольных напитках, и именно их присутствие объясняет отчасти те неприятные последствия от злоупотребления алкоголем, которые называют “похмельем”. Именно эту ядовитую часть алкогольных напитков называют сивушными маслами.
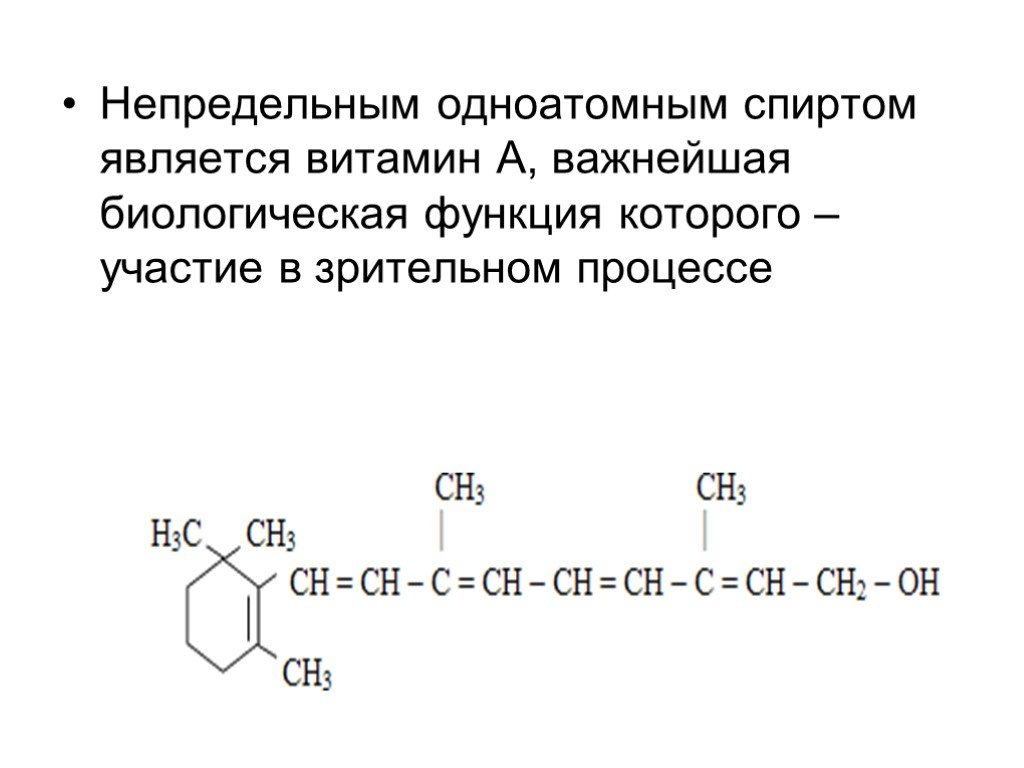
Слайд 10Непредельным одноатомным спиртом является витамин А, важнейшая биологическая функция которого – участие в зрительном процессе
Слайд 11Обратите внимание на особенности номенклатуры спиртов: • Самая длинная цепочка атомов углерода номеруется с того конца, к которому ближе гидроксильная группа • Основой названия спирта является название соответствующего углеводорода с добавлением суффикса –ол • После суффикса ставится цифра, указывающая на положение гидроксильной группы. Вместе с тем для названий некоторых спиртов используется и рациональная номенклатура – метиловый спирт, этиловый спирт, изопропиловый спирт и др.

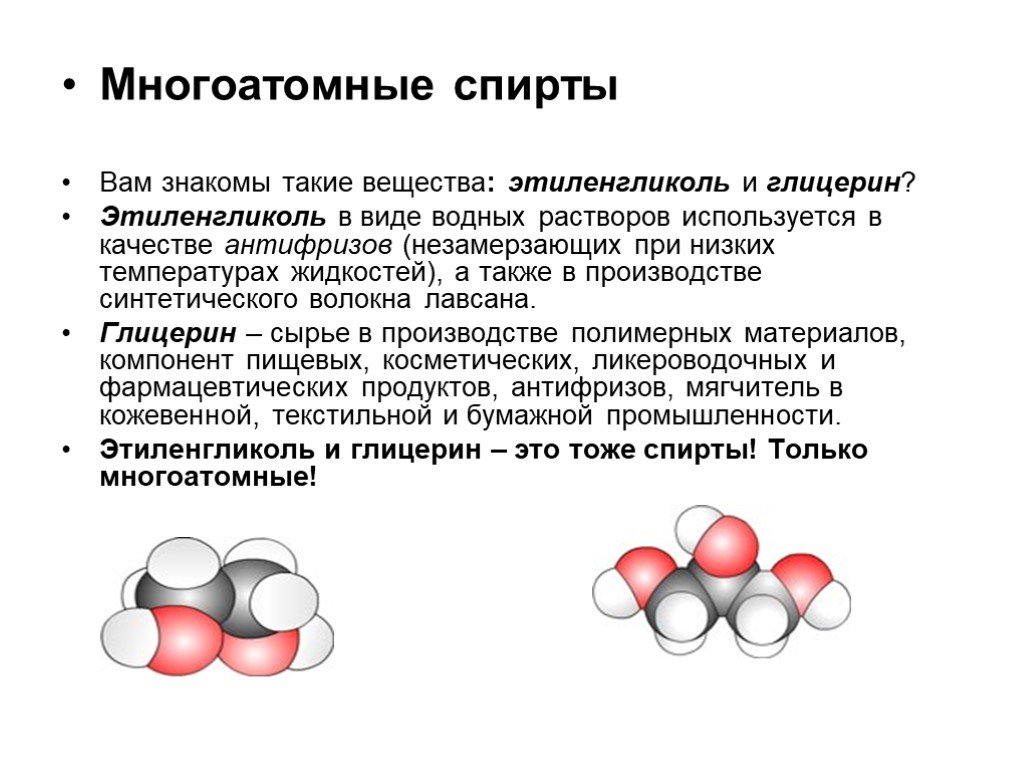
Слайд 12Многоатомные спирты Вам знакомы такие вещества: этиленгликоль и глицерин? Этиленгликоль в виде водных растворов используется в качестве антифризов (незамерзающих при низких температурах жидкостей), а также в производстве синтетического волокна лавсана. Глицерин – сырье в производстве полимерных материалов, компонент пищевых, косметических, ликероводочных и фармацевтических продуктов, антифризов, мягчитель в кожевенной, текстильной и бумажной промышленности. Этиленгликоль и глицерин – это тоже спирты! Только многоатомные!
Слайд 13Спирты, молекулы которых содержат несколько гидроксильных групп, называются многоатомными. Подчеркнем: гидроксильные группы в многоатомных спиртах всегда связаны с разными атомами углерода.
Слайд 14Двухатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, имеют общее название – гликоли.
Слайд 15Тест Проверь себя 1. Спирты: классификация, изомерия, номенклатура 1. Общая формула одноатомных предельных спиртов: CnH2n-1OH CnH2nOH CnH2n+1OH CnH2n-2OH 2. Укажите формулу “лишнего” вещества: CH3 - CH2 - CH2 - OH CH3 - OH HO - CH2 - CH2 - CH2 - OH CH3 - CH2 - OH
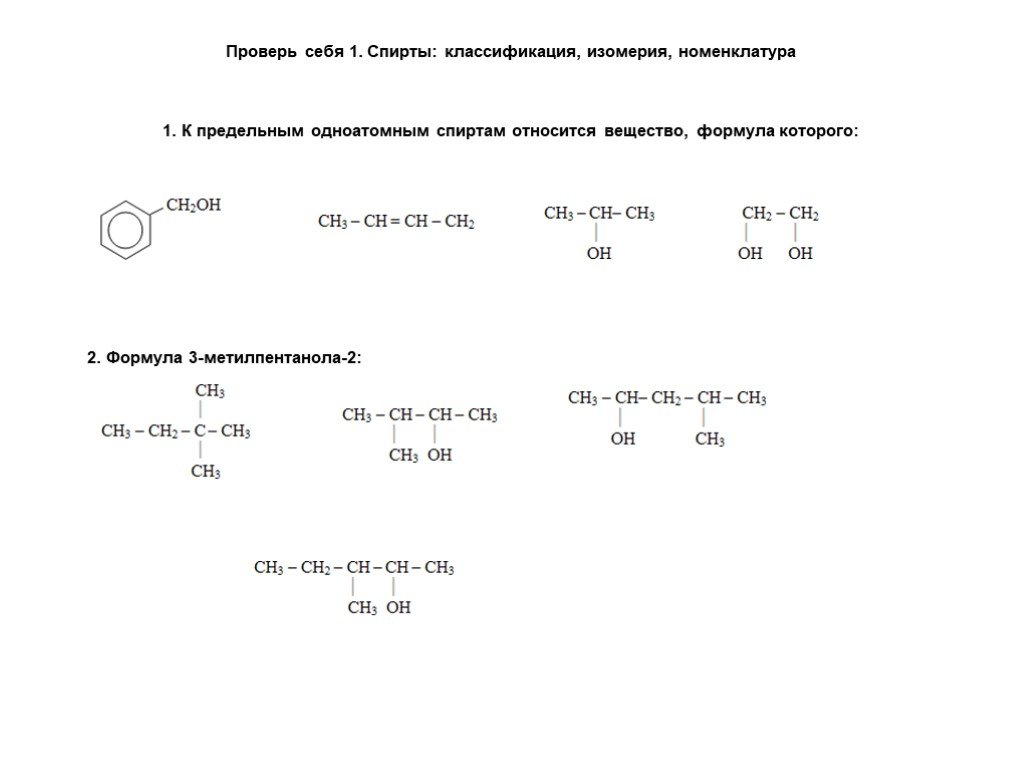
Слайд 16Проверь себя 1. Спирты: классификация, изомерия, номенклатура 1. К предельным одноатомным спиртам относится вещество, формула которого:
2. Формула 3-метилпентанола-2:
Слайд 17Найдите формулу изомера бутанола-1:
Слайд 18Даны вещества: 2-метилбутанол-2, пентанол-2, пропилэтиловый эфир, 2-метилбутанол-1, 2,2-диметилпропанол-1. Среди этих веществ число изомеров пентанола-1 равно ...
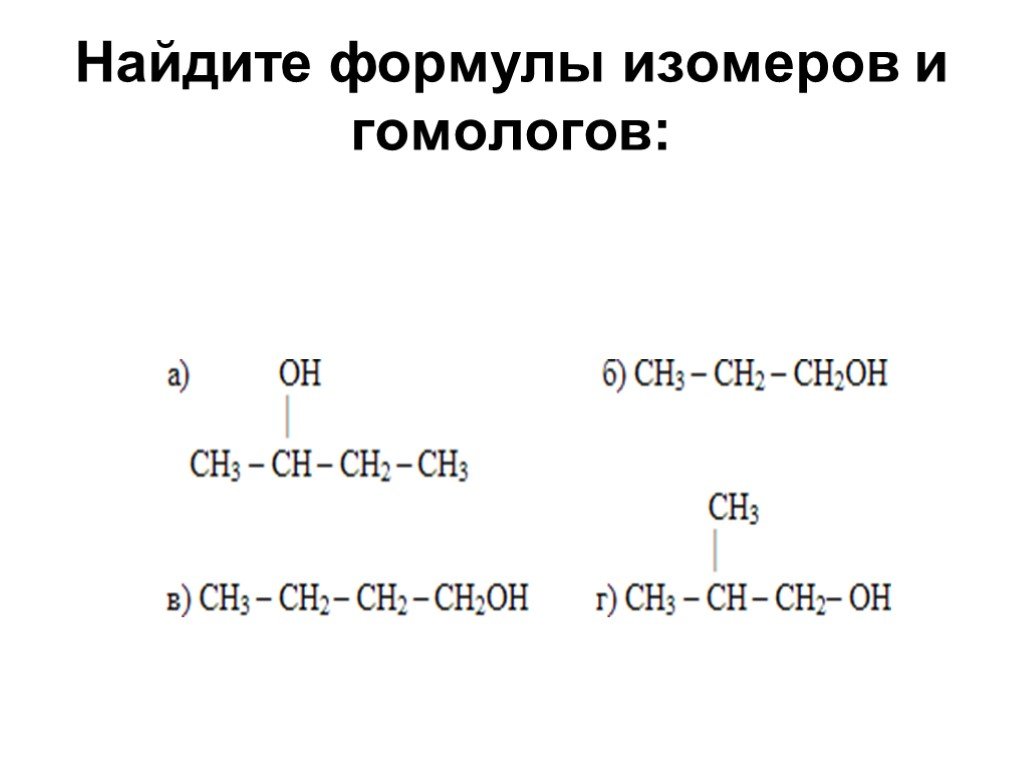
Слайд 19Найдите формулы изомеров и гомологов:
Слайд 20Физические свойства и биологическое воздействие на организм
Низшие спирты, метанол и этанол, бесцветные жидкости со специфическим запахом, неограниченно растворимые в воде. Метанол очень ядовит! А этанол? Действие этанола зависит от количества вещества, поступившего в организм, и от состояния здоровья. Этиловый спирт – известное дезинфицирующее и антибактериальное средство, но при чрезмерном употреблении вызывает нарушение психики, разрушение внутренних органов и даже смерть.
Слайд 21Температуры плавления и кипения спиртов значительно выше, чем у соответствующих углеводородов. Вещества Ткип, °С CH4 метан -162 CH3OH метанол 64,7 C2H6 этан -89 C2H5OH этанол 78,3 Это объясняется тем, что молекулы спирта, как и молекулы воды, образуют между собой водородные связи, благодаря наличию гидроксильной группы с сильнополярной ковалентной связью (А, Б).
Слайд 22Эти связи возникают также между молекулами спирта и воды в водных растворах (В). При этом образуются устойчивые гидраты C2H5OH . H2O, C2H5OH . 3H2O и др. Об этом свидетельствует повышение температуры при растворении спирта в воде.
Слайд 23Это интересно! Метанол содержится в древесном дыме, в следовых количествах – в молодом вине. “Methy” – по гречески “опьянять”, но нельзя забывать, что метанол – яд!
Слайд 24Прием внутрь 5–10 мл метанола приводит к тяжелому отравлению, а более 30 мл – к смерти.
Знаете ли вы, что... … глицерин получил название от греческого слова glykeros – сладкий.
Слайд 25Многоатомные спирты Низшие многоатомные спирты – бесцветные вязкие жидкости из-за густой сетки водородных связей,сладковатые на вкус, без запаха, хорошо растворимы в воде. Этиленгликоль ядовит! Глицерин безвреден. Кроме того, глицерин очень гигроскопичен: если оставить его в открытом сосуде, его масса может увеличиться на 40% за счет поглощения влаги воздуха.
Слайд 26Проверь себя 1. Физические свойства спиртов 1. Водородные связи имеются между молекулами: пропана 2-метилбутана бутанола-1 водорода 2. В ряду веществ, формулы которых C4H9OH, C3H7OH, C2H5OH, растворимость в воде: уменьшается увеличивается не изменяется сначала увеличивается, затем уменьшается
Слайд 27Проверь себя 1. Физические свойства спиртов 1. Способность спиртов к образованию водородных связей приводит к: снижению растворимости в воде увеличению их температуры кипения возникновению окраски вещества уменьшению их температуры кипения 2. Не растворяется в воде: метанол глицерин этиленгликоль бензол
Слайд 28Проверь себя 1. Физические свойства спиртов 1. Этанол, в отличие от своего изомера диметилового эфира СН3ОСН3, является жидкостью, т.к.: между его молекулами есть водородные связи между молекулами эфира есть водородные связи в молекулах этанола более длинный углеводородный радикал в молекулах диэтилового эфира два углеводородных радикала 2. Не растворяется в воде вещество формула которого: СН3ОН С2Н5ОН СН2ОН - СН2ОН С9Н19ОН
Слайд 29Физические свойства спиртов 1. Водородные связи отсутствуют между молекулами: этиленгликоля пропанола воды водорода 2. Растворяются в воде оба вещества пары: этанол и этан метиламин и глицерин метанол и бензол метан и аммиак

Слайд 30Химические свойства предельных одноатомных спиртов Прогноз реакционной способности Конечно, химические свойства спиртов в первую очередь связаны с наличием в их молекулах функциональной гидроксильной группы. Она содержит сильно электроотрицательный атом кислорода, поэтому связи С – О и О – Н ковалентные полярные. Более полярна связь в гидроксильной группе. При химических реакциях она может гетеролитически разрываться с отщеплением протона, т.е. спирты имеют слабые кислотные свойства. Разрыв связи С – О и уход группы ОН происходит при атаке атома углерода нуклеофильным реагентом (нуклеофильное замещение), это позволяет рассматривать спирты как слабые основания. Обратите внимание, спирты сами могут выполнять роль нуклеофильного реагента, ведь атом кислорода имеет две неподеленные пары электронов. Таким образом, спирты, проявляя слабые кислотные и слабые основные свойства, являются амфотерными соединениями. Наряду с названными свойствами спирты могут участвовать в реакциях элиминирования. Для них характерны также реакции окисления.

Слайд 31Активные металлы, такие как Na, вытесняют из спиртов водород с образованием алкоголятов: Алкоголяты – соединения с ионным типом связи, это бесцветные твердые вещества. В присутствии воды они гидролизуются: Эта реакция показывает, что низшие спирты практически не реагируют со щелочами и проявляют даже более слабые кислотные свойства, чем вода. В этом можно убедиться и на основании следующего эксперимента.
Слайд 32Эксперимент Взаимодействие этанола и воды с натрием Помещаем примерно одинаковые кусочки металла натрия в воду и этиловый спирт, наблюдаем за протеканием химических реакций. Обратите внимание: скорости этих реакций сильно отличаются. Натрий значительно активнее взаимодействует с водой. Почему? Кислотные свойства воды выражены сильнее, чем у спирта. Кислотные свойства спирта снижаются под влиянием +I-эффект (положительного индуктивного эффекта) углеводородного радикала.

Слайд 33Основные свойства Спирты взаимодействуют с галогеноводородами и галогеноводородными кислотами, эта реакция является обратной гидролизу галогеналканов: Напомним, что прямую реакцию проводят в присутствии концентрированной серной кислоты. С ее помощью образуется галогеноводород: Помимо этого, в сильнокислотной среде протон Н+ присоединяется к неподеленной паре электронов атома кислорода. Образуется промежуточная очень активная частица, которая далее реагирует с бромид-
Легкость разрыва связи С – О, а значит основные свойства спиртов, соответствует такой последовательности спиртов: третичный > вторичный > первичный, что также обусловлено соответствующим влиянием углеводородного радикала.

Слайд 34Реакции дегидратации При нагревании спиртов в присутствии серной кислоты проходят реакции дегидратации, причем в зависимости от температуры преимущественно протекает одна из двух конкурирующих реакций – внутримолекулярная или межмолекулярная дегидратация спирта: • внутримолекулярная (t>1400С):
• межмолекулярная (t
Слайд 35Межмолекулярная дегидратация – это реакция нуклеофильного замещения, которая приводит к получению простых эфиров. Общая формула простых эфиров: R1 - O - R2 Внутримолекулярное отщепление воды от вторичных и третичных спиртов протекает согласно правилу Зайцева: протон предпочтительно отщепляется от соседнего менее гидрированного атома углерода.
Слайд 36Напишите уравнение реакции дегидратации 2,3-диметилпентанола-3.
Окисление • Низшие спирты горят на воздухе бледно-голубым пламенем: С2H5OH + 3O2 2CO2 + 3H2O + 1370 кДж Эту реакцию применяют не только в спиртовках, но и в двигателях внутреннего сгорания, так как этанол в качестве добавки к моторному топливу повышает его октановое число. Более того, в ряде стран этиловый спирт рассматривается как альтернативное бензину экологически чистое автомобильное топливо.
Слайд 37Это интересно! Бразилия славится не только футболом. Это первая страна, понявшая, что спирт хорошо горит не только в пуншах. Сегодня в этой стране все автомобильное горючее представляет собой смесь бензина и этанола – “газохол” (сокращенно от слов “газолин” – бензин и “ алкоголь”), содержащий 22% безводного спирта.
Слайд 38Алкогольные напитки, содержащие этанол, очень калорийны. При метаболизме этанола в организме выделяется примерно 770 кДж/моль энергии (меньше, чем при горении), так как при окислении в более мягких условиях образуются не углекислый газ и вода, а другие, промежуточные вещества, причем более токсичные, чем этиловый спирт.
Окисление в более мягких условиях (неполное окисление) приводит к образованию карбонильных соединений – альдегидов или кетонов:
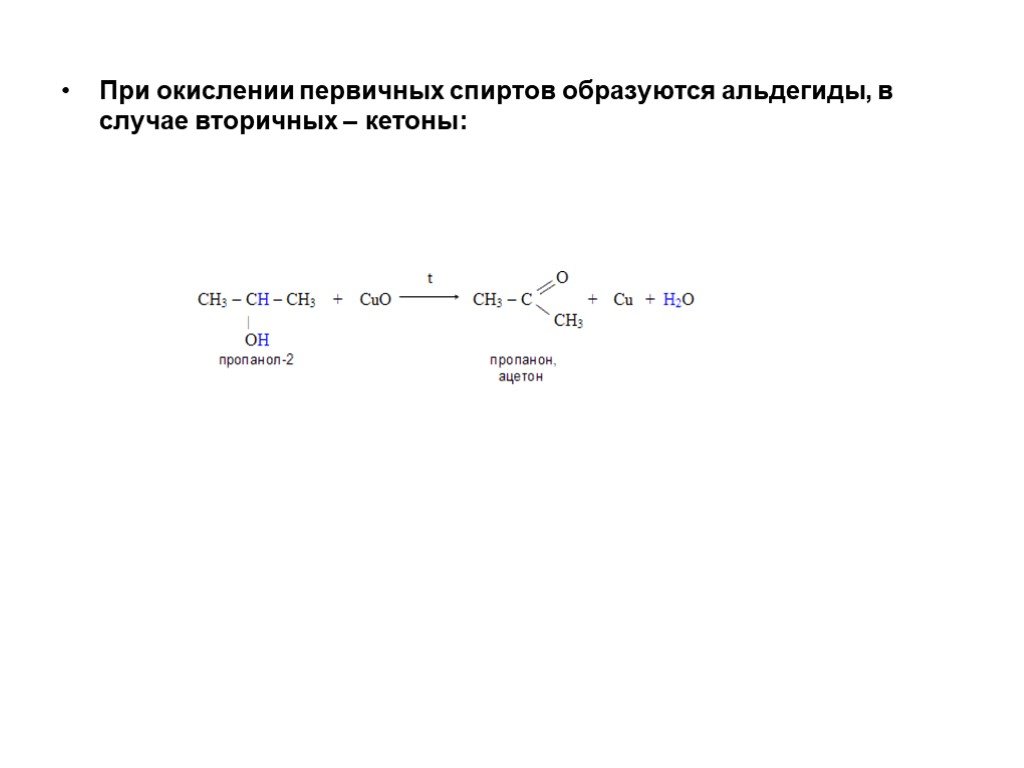
Слайд 39При окислении первичных спиртов образуются альдегиды, в случае вторичных – кетоны:
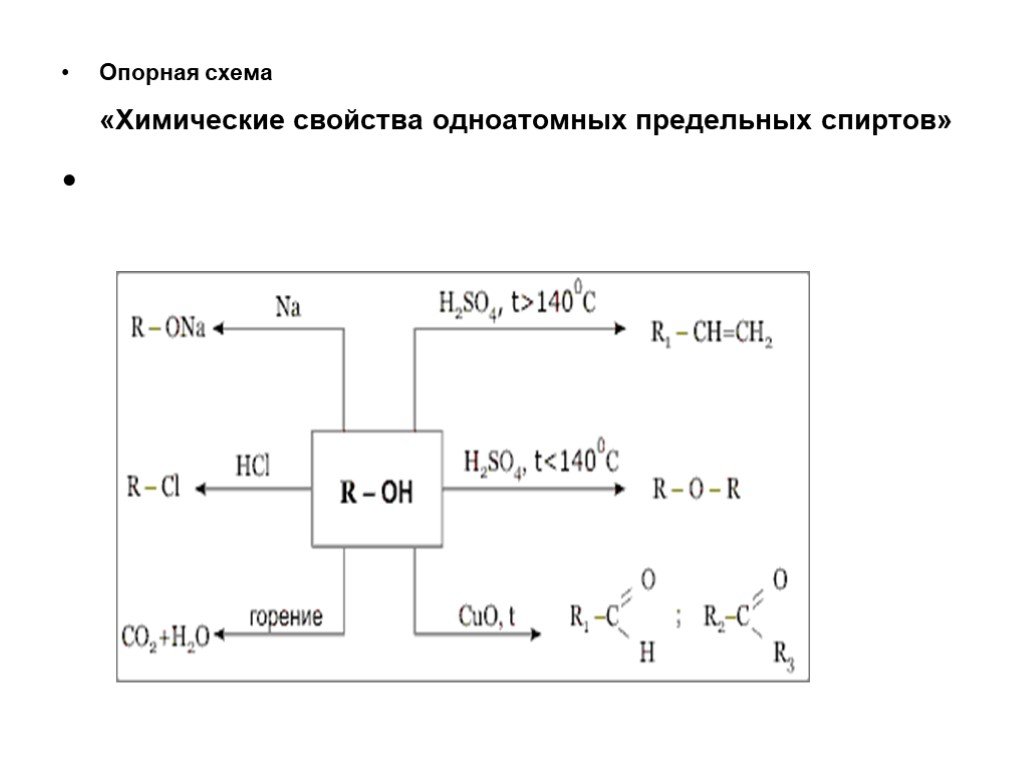
Слайд 40Опорная схема «Химические свойства одноатомных предельных спиртов»
Слайд 41Проверь себя 1. Химические свойства одноатомных спиртов 1. Одноатомные предельные спирты не вступают в реакцию: замещения окисления дегидратации присоединения 2. При дегидратации метанола можно получить: метан этан диметиловый эфир этен
Слайд 42Проверь себя 1. Химические свойства одноатомных спиртов 1. Одноатомные предельные спирты не взаимодействуют с: кислородом щелочами галогеноводородными кислотами оксидом меди(II) 2. Метанол может взаимодействовать с: гидроксидом натрия оксидом натрия хлоридом натрия натрием
Слайд 43Проверь себя 1. Химические свойства одноатомных спиртов 1. При окислении одноатомных первичных спиртов оксидом меди (II) образуются: альдегиды простые эфиры алкены алканы 2. Этанол взаимодействует с обоими веществами пары: кислородом и этаном калием и гидроксидом калия натрием и кислородом бромом и метаном
Слайд 44Проверь себя 1. Химические свойства одноатомных спиртов 1. Этанол не взаимодействует с: кислородом калием водородом бромоводородом 2. Метилат натрия СН3ОNa образуется при взаимодействии метанола с: гидроксидом натрия оксидом натрия хлоридом натрия натрием
Слайд 45Проверь себя 2. Химические свойства одноатомных спиртов Даны вещества: а) кислород, б) калий, в) гидроксид меди (II), г) бромоводород, д) метан. Этанол может реагировать с веществами ... Укажите буквы, соответствующие веществам, в алфавитном порядке без пробелов.
Слайд 46Химические свойства многоатомных спиртов • Многоатомные спирты как и одноатомные проявляют слабые основные свойства, взаимодействуют с галогеноводородными кислотами. В реакции может участвовать одна или несколько гидроксильных групп. • Кислотные свойства многоатомных спиртов выражены сильнее, чем у одноатомных, что объясняется взаимным влиянием гидроксильных групп, стоящих у соседних атомов углерода.
Качественная реакция на многоатомные спирты Многоатомные спирты могут взаимодействовать со свежеприготовленным гидроксидом меди (II) в избытке щелочи. В результате реакции образуются соединения ярко-синего цвета (качественная реакция на многоатомные спирты).

Слайд 47Это интересно! Глицерин под воздействием особых грибков образуется в некоторых сортах винограда. Полученные из этого винограда вина отличаются чрезвычайно сладким и мягким вкусом.
Проверь себя 1. Химические свойства многоатомных спиртов 1. Этанол и этиленгликоль можно отличить с помощью: гидроксида калия натрия бромной воды гидроксида меди (II)
Слайд 48Применение спиртов Метанол прекрасный растворитель, сырье для производства формальдегида и некоторых лекарственных веществ, добавка к моторному топливу для увеличения октанового числа.
Слайд 49Мировое производство метанола превышает 20 млн. тонн в год, и спрос на него постоянно растет, что связано с наметившейся тенденцией по использованию метанола в новых областях, например для получения высокооктановых бензинов, альтернативного, экологически более чистого топлива для электростанций, как сырья для синтеза белка и т.д.
Слайд 50Применение этанола обширно. Но, в связи с применением его в приготовлении алкогольных напитков, напомним, что этиловый спирт – это наркотик и яд. Алкогольный напиток может на некоторое время улучшить самочувствие человека (справиться со стрессом, волнением, привести в радостное состояние), так как он подавляет активность центральной и периферической нервной системы. Но при этом снижается острота зрения, замедляются реакции, речь, уменьшается способность здраво рассуждать, угнетается деятельность головного мозга и нарушается координация движений.
Слайд 51Промежуточный продукт окисления этанола в организме – уксусный альдегид – крайне ядовит и вызывает тяжелые отравления. Систематическое употребление алкогольных напитков приводит к снижению продуктивности работы головного мозга, гибели клеток печени.
Слайд 52Антифризы заливаются в системы охлаждения, в частности автомобильных двигателей (различные тосолы). В гораздо больших количествах этиленгликоль используется в производстве полимеров, которые являются основой некоторых видов пластмасс и волокон.
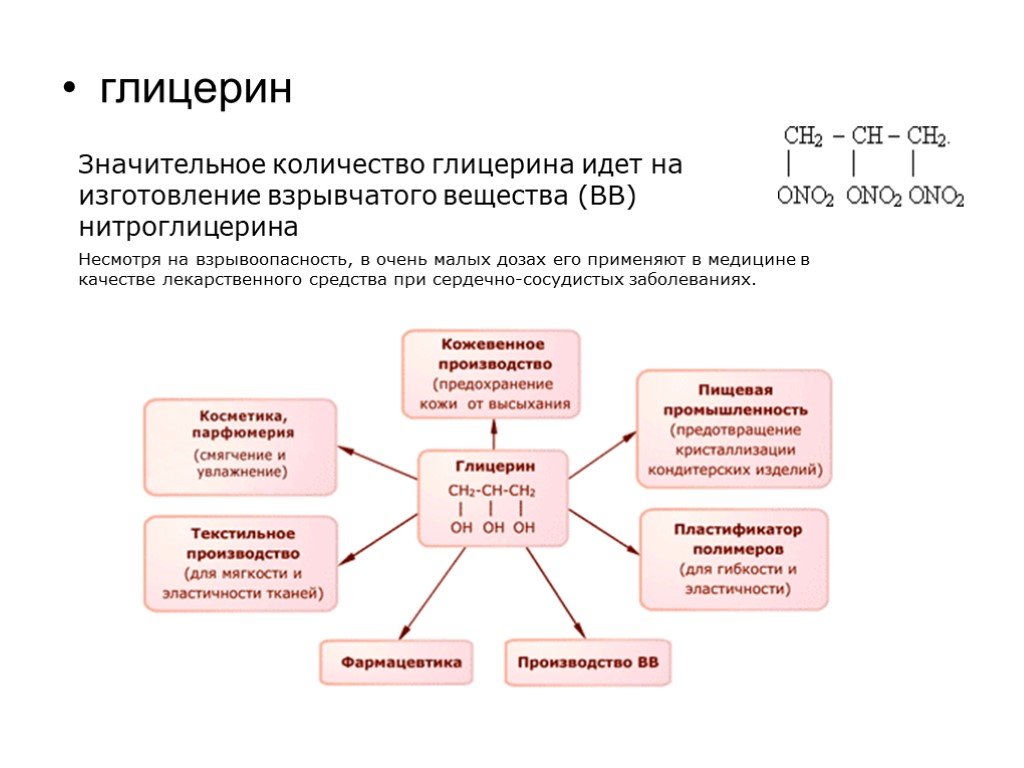
Слайд 53глицерин
Значительное количество глицерина идет на изготовление взрывчатого вещества (ВВ) нитроглицерина Несмотря на взрывоопасность, в очень малых дозах его применяют в медицине в качестве лекарственного средства при сердечно-сосудистых заболеваниях.
Слайд 54Получение Одноатомные и многоатомные спирты для столь широкого использования необходимо получать. Вспомним уже известные вам способы получения спиртов и познакомимся с некоторыми другими. Одноатомные спирты 1) Гидратация алкенов: Эта реакция катализируется неорганическими кислотами (серной, фосфорной) и протекает по правилу Марковникова.
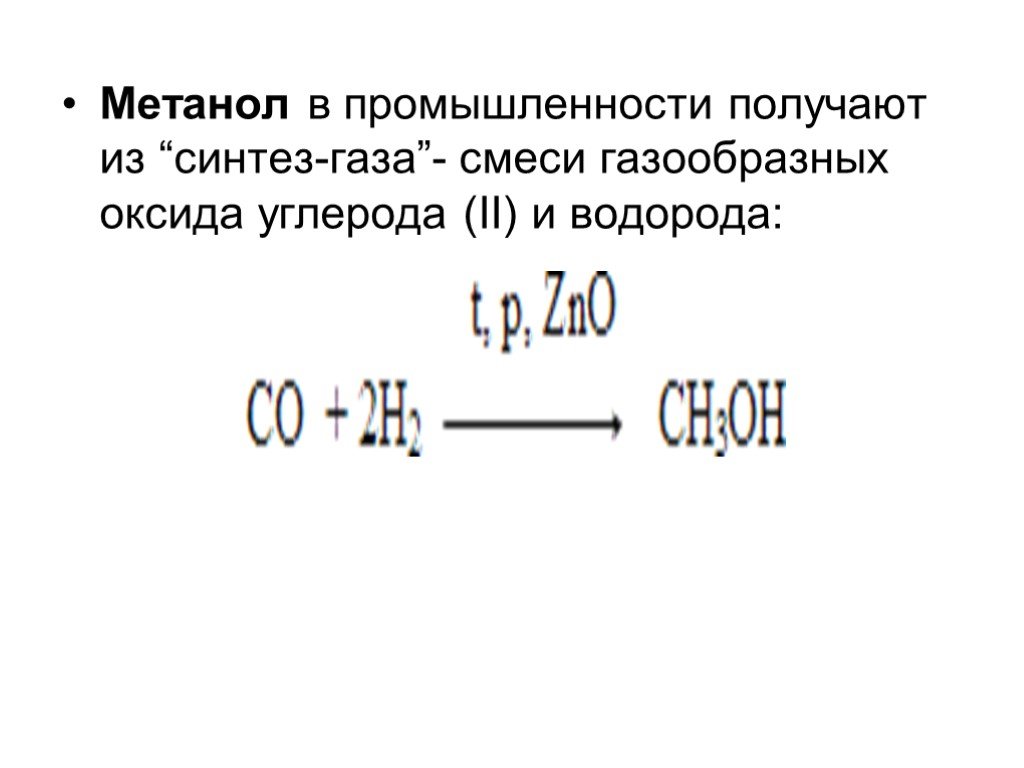
Слайд 55Метанол в промышленности получают из “синтез-газа”- смеси газообразных оксида углерода (II) и водорода:
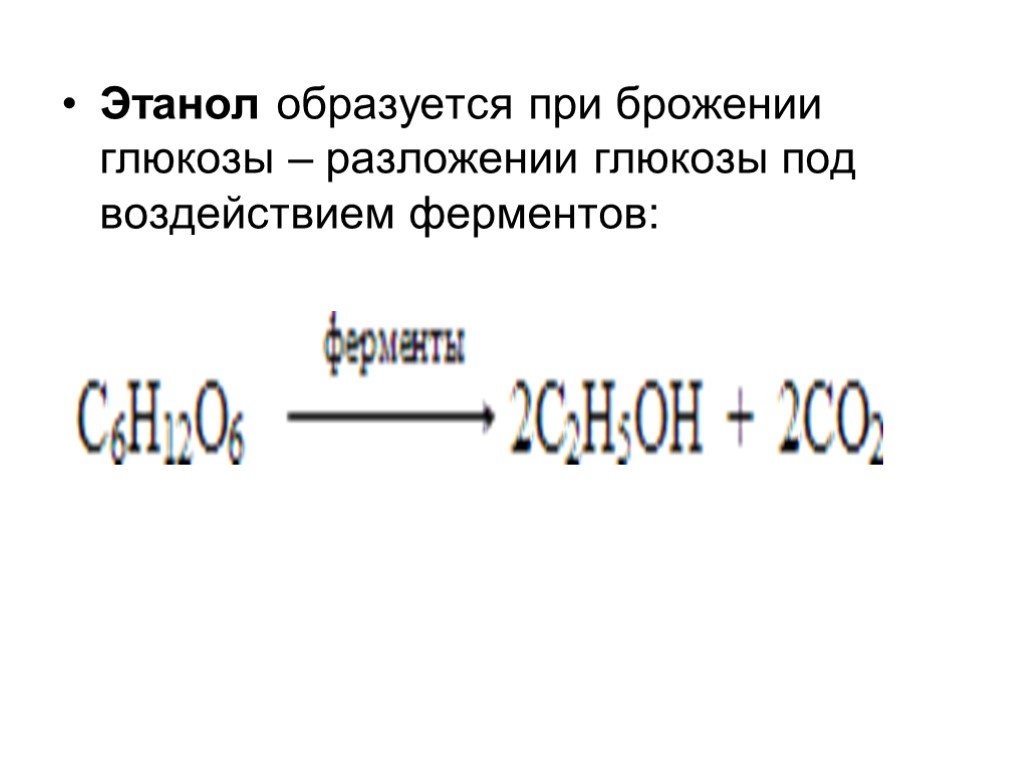
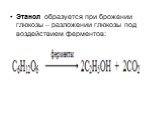
Слайд 56Этанол образуется при брожении глюкозы – разложении глюкозы под воздействием ферментов:
Слайд 57Получение Многоатомные спирты 1) Гликоли образуются при окислении алкенов водным раствором перманганата калия.
Упрощенно процесс получения этиленгликоля можно записать так:
Слайд 58Щелочной гидролиз полигалогенопроизводных алканов – общий способ получения многоатомных спиртов:
Слайд 59Готовимся к ЕГЭ
Задание 1 1. Состав одноатомных предельных спиртов соответствует формуле: CnH2n+2O CnH2n+1OH оба предыдущих ответа верны все ответы не верны 2. “Лишним” является вещество, формула которого: С2H5OH C6H5OH СH3OH С3H7OH 3. Число изомеров, имеющих состав C3H8O, равно: одному двум трем четырем
Слайд 604. Вещество, формула которого имеет название: 2-метилбутанол-4 3-метилбутанол-1 3-метилпентанол-1 2-метилбутанол-1 5. Этиленгликоль и глицерин являются: изомерами гомологами многоатомными спиртами вторичным и третичным спиртом соответственно
Слайд 616. Не способно образовывать водородные связи вещество: вода бензол пентанол-2 метанол 7. Глицерин в отличие от этанола взаимодействует с: натрием бромоводородом гидроксидом меди (II) оксидом меди (II)
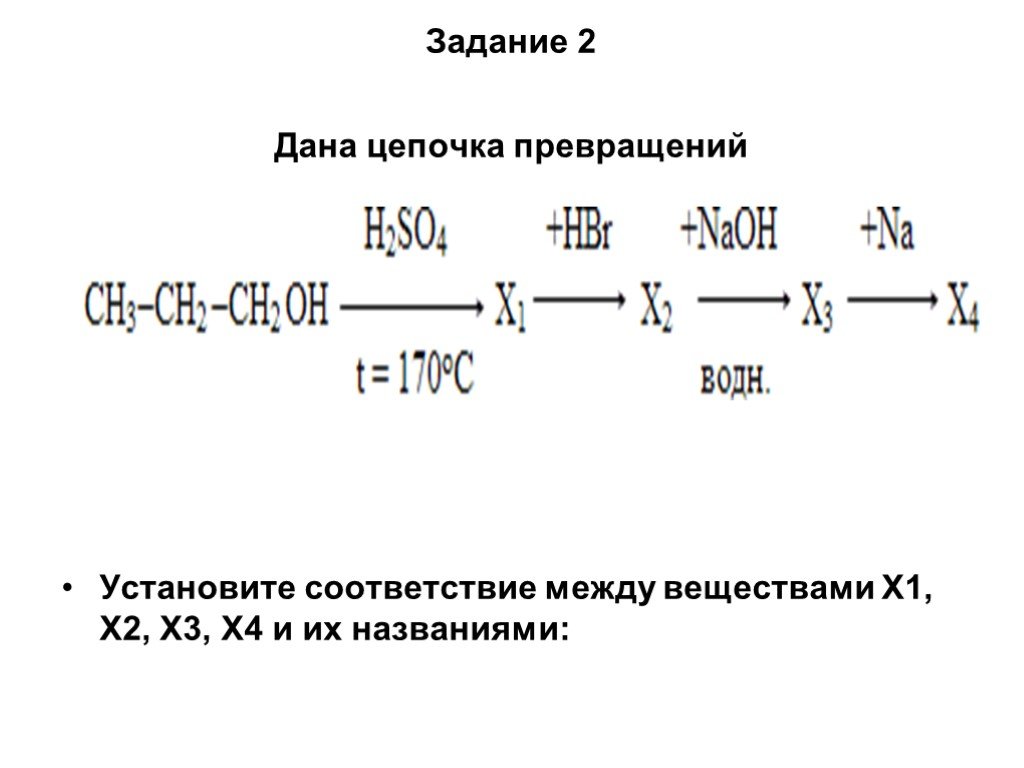
Слайд 62Задание 2 Дана цепочка превращений
Установите соответствие между веществами X1, Х2, Х3, Х4 и их названиями:
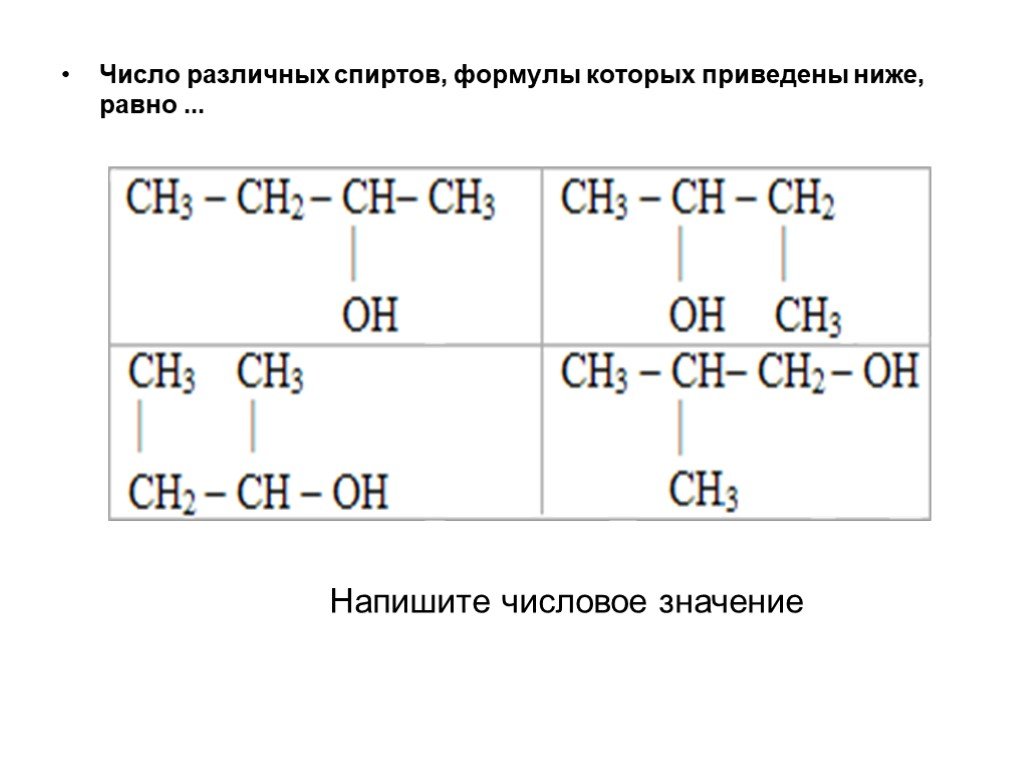
Слайд 63Число различных спиртов, формулы которых приведены ниже, равно ...
Напишите числовое значение
Слайд 64Задание 5 Из 336 л этилена (н.у.) получили этанол с выходом 70%. Его масса составила ... г. Напишите числовое значение