Конспект урока «Метод аналогии при изучении химии в средней школы»
Муниципальное бюджетное общеобразовательное учреждение
средняя общеобразовательная школа с.Балгазын
Доклад: «Метод аналогии при изучении химии в средней школы»
Выполнила: учитель химии
высшей категории
Евдокимова Татьяна
Валерьевна
Балгазын
Тема: «Метод аналогии при изучении химии».
Аналогия – это прием познания, при котором на основании сходства объектов по одним признакам заключают об их сходстве и по другим признакам. В основе аналогии лежит факт, что объекты сходны не только в одном, но и в других отношениях.
Аналогия – это особо познавательный прием, заключающийся в сравнении. Если два или более объектов имеют сходные признаки, то и может наблюдаться сходство и других признаков. Значение такого метода при обучении связано с повышением научно- теоретического уровня изложения материала на уроках химии, с формированием научного мировоззрения учащихся, развитием исследовательской компетентности.
Аналогия – эффективна при изучении тех разделов химии, которые не могут быть проиллюстрированы экспериментами и требуют развитого абстрактного мышления. В этих случаях аналогии – это единственный способ сделать учебный материал доступным для определенных категорий учащихся.
Мы знаем, что вещества существуют в трех агрегатных состояниях: твердом, жидком и газообразном и по своему поведению отличаются друг от друга. Для понимания этих различий необходимо представить субмикроскопическое строение вещества в разных агрегатных состояниях. Это можно сделать с помощью аналогий, уподобляя строения вещества с некоторыми ситуациями в отношениях между людьми.
Например: при изучении темы «Металлы, строение», «Оксиды металлов, 9 класс «Соли» 8 класс. Я использую сравнение строения, этих веществ с армейским строем. Представим строй солдат, за каждым солдатом закреплено место. Это место солдатом сохраняется при построении и движении. Самовольное перемещение внутри строя запрещается, возможно только движение всей колонной. Точно также построены твердые вещества, имеющие кристаллическую решетку. Молекулы в них занимают четко установленные места в узлах решетки, расстояния между ними минимальные (как между солдатами в строю), хаотичное движение молекул практически отсутствует. Одним словом, порядок и дисциплина.
Строение жидких веществ можно представить в виде дружеской вечеринки. Представим, что вечер проходит в тесном зале. Приглашенные ведут себя по-разному: кто-то танцует, кто-то ходит, кто-то беседует с друзьями. Каждый из присутствующих может относительно перемещаться, но в целом движение ограничено размерами зала. Так как гостей много, то все время нужно оглядываться, чтобы кого-то не толкнуть или не наступить на ногу. Расстановка людей в зале все время меняется; кто-то начинает танцевать, кто-то подходит к стойке бара, кто-то отходит. Хотя люди развлекаются, но если посмотреть на зал сверху, то возникает впечатление их спокойного «перемещения» по помещению. Но если добавить горячительных напитков, то перемещение людей станет быстрее.
Аналогично и строение жидкостей, например: растворов солей, в расположении молекул нет четкой упорядоченности, хотя они расположены близко друг от друга, хаотичное движение молекул есть, но выражено слабо. И потом жидкости несжимаемы, точно также участники вечера откажутся перейти в зал вдвое меньший; и так тесно!
При изучении темы 8 класса «Газы» можно использовать аналогию футбольного матча. На футбольном поле достаточно пространства для маневров – перебежек, обводок, многоходовых комбинаций. Поведение футболистов сходно с движением молекул газов: они независимо и быстро перемещаются, расстояния между молекулами, как и игроками большие. Если команды проигрывают, то игроки начинают двигаться быстрее, точно также молекулы газов движутся быстрее при нагревании.
При изучении темы 8 класса «Основные классы неорганических соединений», при рассмотрении «Основания», рассматривая опыт иллюстрирующих действие индикатора на растворы гидроксида калия, учащихся приходят к выводу, что аналогичный эффект будет наблюдаться при применении индикатора к растворам других щелочей.
При изучение темы 8 класса «Типы химических реакций», при рассмотрении реакций соединения я принимаю аналогию приготовления теста.
Для приготовления теста для пирога берутся компоненты: мука, соль, сахар, дрожжи, масло. Берутся эти вещества, а образуется один сложный продукт – тесто. В реакциях соединения тот же принцип: вступают несколько простых или сложных веществ, а образуется одно сложное.
При изучении темы «Кристаллические решетки» в 9 классе можно привести аналогию поведения людей. Например: У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами, а связи между отдельными молекулами намного слабее, что делает молекулярный кристалл непрочным. Эту структуру можно уподобить группе семейных пар. В каждой паре супругов связывают прочные узы брака (подобно прочной связи атомов внутри молекулы), а вот отношения между парами носят поверхностный характер: они могут дружить семьями, испытывать друг к другу дружеские чувства, но довольно свободно могут обойтись и друг без друга
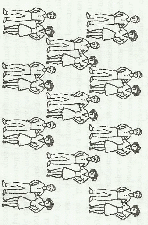
Прочным является ионный кристалл, в узлах, которого расположены разноионно заряженные ионы, которые удерживаются силами электростатического притяжения. Расположим мужчин в шахматном порядке:
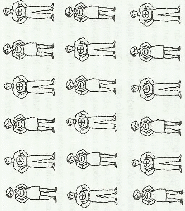
Мужчины символизируют катионы (+), женщины анионы (-). Тогда каждый человек оказывается в зоне действия обаяния окружающих его представителей противоположного пола, к которым он (она) в силу закона притяжения противоположностей испытывает интерес. Интерес этот одинаково выражен во всех направлениях, т.к. мужчины холостые и женщины незамужные. Взаимным притяжением и объясняется повышенная прочность ионного кристалла.
В узлах атомной решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. Эта структура отличается внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу. Вещества с таким типом строения плавятся при более высоких температурах, чем ионные соединения.
Например: алмаз, кварц, кремний и др. Аналогией атомного кристалла может являться гимнастическая пирамида.
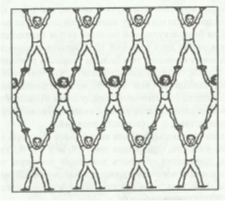
Каждый гимнаст в ней символизирует атом углерода, связанный четырьмя ковалентными связями с соседними атомами. Целостность пирамиды поддерживается усилиями каждого гимнаста. Таким образом, зависимость людей друг от друга больше, чем в других структурах. Пирамида демонстрирует высокую взаимосвязанность узлов атомной кристаллической решетки: стоит одному из гимнастов ослабить только одну связку и вся пирамида может рухнуть. Этот пример показывает важную особенность веществ с атомным строением: являясь тугоплавкими и очень твердыми, они в то же время отличаются хрупкостью. А при рассмотрении строения металлических решеток можно применить интересную аналогию.
Группа мужчин, изображающих катионы металлов, окружены пчелами (свободные электроны).
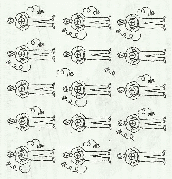
Этот рисунок убедительно показывает силы, удерживающие одноименно заряженные катионы в узлах решетки: при всем желании деваться некуда – всюду пчелы.
Метод аналогии, также можно использовать по многим темам химии с 8-го по 11-й класс. (Химическое взаимодействие – «автодром», электронная плотность – «скитания студента». Химическое равновесие – «супермаркет», межмолекулярное взаимодействие – «рукопожатие» и многие другие.
Сравнение сложных химических процессов с различными ситуациями из повседневной жизни выполняют разнообразные функции: предоставляют возможность представить то, что невозможно увидеть в школьных условиях, служат средством открытия новых закономерностей, объясняют некоторые явления, помогают запомнить сложные научные понятия и понять их сущность.
Метод аналогии делает уроки более интересными, разнообразными, а учебный материал более понятными и доступным для понимания.
Метод аналогии применяется в самых различных областях науки: в математике, физике, химии, кибернетике, в гуманитарных дисциплинах и т.д. О познавательной ценности метода аналогии хорошо сказал известный ученый – энергетик В.А. Веников: «Иногда говорят: «Аналогия – не доказательство» … Но ведь если разобраться, можно легко понять, что ученые и не стремятся только таким путем, доказать, что–нибудь. Разве мало того, что верно увиденное сходство дает могучий импульс творчеству?.. Аналогия способна скачком выводить мысли на новые, неизведанные орбиты, и, безусловно, правильно положение о том, что аналогия, если обращаться с ней с должной осторожностью, - наиболее простой и понятный путь от старого к новому»
Используемая литература:
1. О.С.Габриелян Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. О.С. Габриелян Химия 11 класс. Учебник общеобразовательных учреждений. Дрофа М -2008г
3. О.С. Габриелян . Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
4. Л.С. Гузей, В.В. Сорокин, Р.П. Суровцева. Химия. 9 класс. Учебник для общеобразовательных учреждений. Дрофа М- 2003г.
5. Л.С. Гузей, В.В. Сорокин, Р П. Суровцева. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа М- 2003г.
6. В.Н. Алексинский «Занимательные опыты по химии» М , «Просвещение» 1980 г.
7. В.Н. Головнер. Химия 8-11 классы. Интересные игры. (Из зарубежного опыта).
Здесь представлен конспект к уроку на тему «Метод аналогии при изучении химии в средней школы», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

